Enzim
Enzim (grč. ένζυμο, énsimo = kvasac) je svaki protein sposoban da katalizira neku biohemijsku reakciju u živim organizmima.[1]
Dva iona cinka koji su potrebni peilikom djelovanja enzima, prikazani su kao ljubičaste kuglice. Inhibitor enzima S-heksiglutation je prikazan kao prostorno-popunjavajući modul, u dva aktivna mjesta.

Struktura dijela mitohondrijske akonitaze: katalitski centar sa Fe4S4 klasterom (sredina, dolje) izocitrata (ICT) (Enzim prstenasto okružuje narednu aminokiselinu enzima).
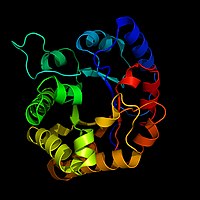

Smatra se da je TIM katalitski savršen enzim (pogledajte odjeljak kinetika ovog članka).
Reakcije koje se dešavaju u organizmu ne mogu uvijek same de se završe, a u tom slučaju im pomažu enzimi. Svaka biohemijska reakcija ima svoj posebni enzim, mada postoje i enzimi koji mogu katalizirati (pomoći, ubrzati) par reakcija više. Enzimi su prema reakcijama koje kataliziraju podijeljeni u šest grupa i svi oni imaju svoju oznaku u međunarodno prihvaćenom indeksu. Za enizme se često upotrijebljava i naziv fermenti. Nauka koja proučava enzime označava se kao enzimologija.[2][3][4][5]

Aktivno mjesto ostatka (crveno), maltozni supstrat (crno) i kofaktor NAD (žuto).
Dijagram glikozidaze sa strelicom koja pokazuje cijepanje maltoznog šećernog supstrata u glukozne proizvode.
Prisutnost enzima omogućuje složene hemijske cikluse u organizmima uključujući i one koje organizmi koriste za metabolizam. Naprimjer, pepsin i tripsin se koriste u procesu probave proteina.
Poznato je da enzimi kataliziraju više od 5.000 vrsta biohemijskih reakcija. Većina enzima su proteini, iako ih je nekoliko u kategoriji katalitskih molekula RNK. Posebnost enzima potiče iz njihove jedinstvene trodimenzionalne strukture.
Kao i svi katalizatori, enzimi povećavaju stopu reakcije, smanjenjem svoje aktivacijske energije. Neki enzimi mogu pretvaranje supstrata u proizvod učiniti na milione puta bržim. Ekstremni primjer je orotidin 5'-fosfat dekarboksilaza, koja omogućava reakciju koja bi inače trajala milione godina da se obavi u milisekundi. Hemijski, enzimi su kao i svaki katalizator i ne troše se u hemijskim reakcijama, niti se njima mijenja ravnoteža reakcije. Enzimi se razlikuju od većine drugih katalizatora tako što djeluju mnogo konkretnije. Aktivnost enzima može biti pod utjecajem drugih molekula: inhibitori su molekule koje smanjuju aktivnost enzima, a aktivatori su molekule koje povećavaju aktivnost. Mnogi lijekovi i otrovi su inhibitori enzima. Izvan njihove optimalne temperature i pH, aktivnost enzima se znatno smanjuje.[6][7][8][9] [10]
Neki enzimi se koriste u komercijalne svrhe, naprimjer, u sintezi antibiotika. Neki proizvodi za domaćinstvo imaju enzime koji pomažu u ubrzanju hemijske reakcije: enzimi u biološkim prašcima za pranje razgrađuju mrlje na odjeći koje potiču od proteina, skroba ili masti, a proteine u mesu, profesionalna hemija enzimima razbija u manje molekule, pa ga je lakše žvakati.
Etimologija i historija
urediDo kraja 17. i početkom 18. vijeka, bila je poznata probava mesa u želudačnoj tečnosti i djelovanje biljnih ekstrakata i pljuvačke pri pretvaranju škroba u šećere, ali mehanizmi pomoću kojih se to događa nisu još otkriveni.
Francuski hemičar Anselme Payen je bio prvi koji je otkrio enzim, dijastazu, 1833. Nekoliko desetljeća kasnije, kada je proučavao fermentaciju šećera u alkohol pomoću kvasca, Louis Pasteur je zaključio da je ova fermentacija uzrokovana vitalnom silom koja se nalazi u ćelijama kvasca, pod nazivom "fermenti", za koje se mislilo da djeluju samo unutar živih organizama. On je napisao da je "alkoholna fermentacija čin međuodnosa sa životom i organizacije ćelije kvasca, a ne sa smrću ili truljenjem ćelija.[11][12]
U 1877., njemački fiziolog Wilhelm Kühne (1837.-1900.) prvi je koristio termin enzim, koji dolazi iz grčkog νζυμον = kvasac, koji opisuje ovaj proces. Riječ enzim je kasnije koristi i kada se tiče neživih materija, kao što su pepsin , a riječ fermentacija ili previranje se koristi kada se odnosi na hemijske aktivnosti u produkciji živih organizama.
Eduard Buchner je 1897. objavio prvi rad na proučavanju kvaščevih ekstrakata. U nizu eksperimenata na Univerzitetu u Berlinu, otkrio je da je šećer fermentira je čak i kad nije bilo svakodnevnog prisustva ćelija kvasca u u smjesi. Enzim koji je izazvao fermentaciju saharoze označio je kao "zimaza". Godine 1907., dobio je Nobelovu nagradu za hemiju za "njegovo otkriće fermentacije bez ćelija". Nakon Buchnerovog primjera, enzimi se obično nazvaju prema reakciji koju obavljaju, uz sufiks –aza, u kombinaciji s imenom podloge (npr. laktaza je enzim koji cijepa laktozu) ili na vrstu reakcije (npr. DNK polimeraza katalizira sintezu DNK polimera). U ranim 1900-im, biohemijski identitet enzima je i dalje nepoznat. Mnogi naučnici su primijetili da je enzimska aktivnost bila povezana sa proteinima, ali drugi (kao što je dobitnik Nobelove nagrade Richard Willstätter) su tvrdili da su proteini samo nosioci za prave enzime i da proteini po sebi nisu bili sposobni za katalizu. Godine 1926., James B. Sumner je pokazao da je enzim ureaza bila čisti protein i kristalizirao ga, a isto je učinio i za enzimom katalaz, 1937. Da čisti proteini mogu biti enzimi pokazali su John Howard Northrop i Wendell Meredith Stanley, koji su radili na probavnim enzimima: pepsinu (1930.), tripsinu i himotripsinu. Ova tri naučnika 1946. godine dobili su Nobelovu nagradu za hemiju.[13][14] He named the enzyme that brought about the fermentation of sucrose "zymase".[15][16]
Otkriće da enzimi mogu biti kristalizirani omogučilo je da se struktura eventualno može upoznati pomoću kristalografije X-zrakama. Ovo je prvi put učinjeno sa lizozimom, enzimom koji se nalazi u suzama, pljuvački i bjelancetu koji razlaže bris nekih bakterija. Strukturu je riješila istraživačka grupa koju je predvodio David Chilton Phillips, a objavljena je 1965. Ova struktura visoke rezolucije lizozima označila je početak područja strukturne biologije i napora da se shvati kako enzimi djeluju na razini atomskih detalja.
Struktura
urediPrimjer organizacije strukture enzima i lizozima.
Vezivanja su u plavoj, crvenoj boji, a katalitsko mjesto na peptidoglikanskoj podlozi su u crnoj boji. (PDB 9LYZ 9LYZ)
S heksozakinaza ima veliko inducirano prilagodbeno mjesto koje zatvara preko podloge adenozintrifosfata i ksiloze.
Vezivanja su u plavoj, podloge u crnoj a Mg2+ kofaktor u žutoj boji (PDB 2E2N)
Enzimi su uglavnom globuloliki (loptasti) proteini, a djeluju samostalno ili u većim jedinjenjima. Kao i svi proteini, enzimi su linearni lanci aminokiselina koji presavijanjem dobijaju trodimenzionalnu strukturu. Sekvenca aminokiselina određuje strukturu koja zauzvrat određuje katalitsku aktivnost enzima. Iako struktura određuje ulogu enzima, a njegova aktivnost se još ne može predvidjeti samo iz njegova strukture. Pri zagrijavanju ili izlaganju djelovanja hemijskih agenasa, enzimske strukture su podložne denaturaciji i taj poremećaj strukture obično dovodi do gubitka aktivnosti. Denaturacija enzima je normalno povezana sa temperaturama iznad normalne razine vrsta. Kao rezultat toga, enzimi iz bakterija koje žive u vulkanskim sredinama, kao što su vruća vrela su cijenjeni od strane industrijskih korisnika, zbog njihove sposobnosti da djeluju na visokim temperaturama. To omogućava ovako kataliziranim reakcijama da se odvijaju po vrlo visokoj stopi.
Molekule enzima su obično mnogo veća od molekula njihove podloge. Veličine se kreću u rasponu od samo 62 ostatka aminokiselina, za monomer 4-oksalokrotonat tautomerazu, do više od 2,500 ostataka u sintezi životinjskih masnih kiselina. Samo mali dio njihove strukture (oko 2-4 aminokiseline) su direktno uključene u katalizu: katalitsko mjesto, koje se nalazi pored jednog ili više mjesta vezivanja, gdje ostaci orijentiraju podlogu. Katalitsko mjesto i obavezujuće mjesto zajedno čine aktivno mjesto enzima. Preostali veći dio strukture enzima služi za održavanje precizne orijentacije i dinamike djelovanja aktivnog mjesta.
Neki enzimi poput neaminokiselina su direktno uključene u katalizator. Umjesto toga, enzim sadrži mjesta vezivanja i orijentacije katalitskog kofaktora. Struktura enzima može sadržavati alosterne lokacije, gdje vezivanje male molekule izaziva konformacijsku promjenu, koja povećava ili smanjuje aktivnost. Postoji mali broj molekula RNK, koje se na osnovu sposobnosti biološke katalize nazivaju ribozimi, koji mogu djelovati samostalno ili zajedno sa proteinima. Najčešći od njih je ribosom, koji je jedinjenje proteina i katalitske komponente RNK.
Mehanizam
urediVezivanje podloge
urediPrije nego što počnu katalizirati bilo koju hemijsku reakciju, enzimi se moraju vezivati za njihovu podlogu. Enzimi su obično vrlo specifični za određene podloge, za koje se vežu a zatim kataliziraju hemijske reakcije. Specifičnost se postiže obavezujućom prazninom (usjekom) koji je komplementarnog oblika, za popunjenjavanje i hidrofilnom /hidrofobnom izbočinom podloge. Enzimi stoga mogu razlikovati vrlo slične molekule materijala koji su hemoselektivne, regioselektivne i stereospecifične.[2][2][17][18][19][20][21][22][23][24][25]
Neki od enzima pokazuju najveću specifičnost i tačnost kada su uključeni u kopiranje i izgradnju novog genoma. Neki od ovih enzima se pojavljuju u mehanizmima "lekture". Tako, enzim kao što je DNK polimeraza katalizira reakciju u prvom koraku, a zatim u drugom koraku, te provjerava da li je proizvod ispravan. Ovaj proces u dva koraka dovodi do prosječne stope greške manje od 1/100 miliona reakcija kod polimeraze sisara. Slični mehanizmi popravke se također nalaze i kod RNK polimeraza, aminoacil-tRNK sintetaze i ribosoma. Nasuprot tome, neki enzimi ispoljavaju i promiskuitet enzima, koji imaju široku specifičnost i djeluju na niz različitih fiziološki relevantnih podloga. Mnogi enzimi imaju mala mjesta aktivnosti koja su nastala slučajno (tj. neutralno), što može biti polazište za evolucijski izbor nove uloge.[26][27][28][29]
Na osnovu najpodobnije podloge, enzimi mogu mijenjati oblik, da bi se vezali prilikom stvaranja kompleksa enzim-supstrat.
Model "brave i ključa"
urediDa bi objasnio dosljednost specifičnosti enzima, 1894., Emil Fischer je predložio da i enzim i supstrat posjeduju posebne komplementarne geometrijske oblike koji se međusobno uklapaju jedan u drugi. Ovo se često naziva model "ključa", gdje se ranim modelom objašnjava specifičnost enzima, ali ne i stabilizacija stanja prilikom promjena koje enzimi ostvaruju.
Model indukcije
urediGodine 1958. Daniel Koshland je predložio izmjenu modela brava-ključ: pošto su enzimi prilično prilagodljive strukture, aktivno mjesto stalno preoblikuje međudejstva s podlogom kao i podloga u međudejstvima s enzimom. Kao proizvod toga, za podlogu se aktivno mjesto ne veže čvrsto; aminokiseline su bočnim lancima (koji čine aktivna mjesta) su ukalupljene u precizna mjesta koje enzimu omogućavaju da obavlja svoju katalitsku ulogu. U nekim slučajevima, kao što je glikosidaza, molekula supstrata također neznatno mijenja oblik kako bi ušla u aktivno mjesto. Tu se nastavlja mijenjati dok se supstrat ne veže potpuno, kada se određuje konačni oblik punjača. Indukcija najpovoljnijeg oblika može povećati vjerodostojnost molekulskog prepoznavanja u prisustvu konkurencije i događaja u mehanizmu konformacijske korekture.
Kataliza
urediEnzimi mogu ubrzati reakcije na više načina, koje ograničavaju energiju aktivacije (ΔG ‡, Gibbsove energije).
1. Stabilizacija stanja tranzicije uključuje:
o Stvaranje povoljnog okruženja s prelaznim punjačem za smanjenje svoje energije.
2. Pružajući alternativni pravac reakcije:
o Privremeno reagira s podlogom, stvarajući kovalentno srednje za stvaranje nižeg energetskog stanja u tranziciji.[30]
3. Destabilizaciju stanja podloge:
o Iskrivljuju vezane podloge supstrata u njihov prelazni obrazac stanja, kako bi se smanjila energija potrebna da se postigne stanje u tranziciji.[31]
o Orijentišući podloge u produktivne aranžmana za smanjenje reakcije entropija promjena.[31] Doprinos ovog mehanizma za katalizu je relativno mali.[32]
Enzimi mogu koristiti nekoliko ovih mehanizama istovremeno. Naprimjer, proteaze kao što je tripsin obavljaju kovalentnu katalizu pomoću katalitske trijade, stabilizirajući stanja nagomilavanja u tranziciji pomoću oksianionskih rupa, kompletnu hidrolizu pomoću usmjeravanja vode na podlogu.[33]
Dinamika
urediEnzimi nisu krute, statične strukture, nego imaju složene untrašnje dinamične pokrete, tj. pokrete dijelova strukture enzima, kao što su pojedinačni aminokiselinski ostaci. To je grupa ostataka koji stvaraju proteinsku petlju ili jedinice sekundarne strukture ili čak čitavu proteinsku domenu. Ovi pokreti dovode do konformacijskih grupnih, malo drugačijih struktura koje se međusobno mijenjaju ostajući pri tom u ravnoteži. Različita stanja u okviru ove cjeline mogu biti povezana s različitim aspektima uloge enzima. Naprimjer, različite reakcije podrške enzima dihidrofolat reduktaza su povezane s vezanjem katalizirane podloge, katalizom, otpuštanjem kofaktora i koracima otpuštanje proizvoda katalitskog ciklusa.
Alosterna modulacija
urediAlosterna mjesta su džepovi (urezi) na enzimima, za razliku od aktivnog mjesta, koji se vežu za molekule u ćelijskom okruženju. Ove molekule dovode do promjena u podršci ili dinamici enzima koji se ubacuju na aktivna mjesta i na taj način utiču na brzinu reakcije enzima. Na taj način, alosterna interakcija može ili inhibirati ili aktivirati enzime. Alosterne interakcije sa metabolitima u uzvodnnim ili nizvodnim metaboličkim putevima uzrokuju povratne informacije enzima, izmjenu aktivnosti enzima prema ostatku procesa.
Kofaktori
urediZa ispoljavanje pune aktivnosti, neki enzimi ne trebaju dodatne komponente. Ostalima je za djelovanja neophodno vezanje neproteinske molekule kofaktora. Kofaktori mogu biti neorganski (npr. metalni ioni i klaster željezo-sumpor) ili organski spojevi (npr. flavin i hem). Organski kofaktori mogu biti koenzimi, koji su otpušteni iz aktivnog mjesta enzima tokom reakcije ili protetske grupe, koje su usko vezane za enzim. Organske protetske grupe mogu biti vezane kovalentno (npr. biotin u enzimima kao što je piruvat karboksilaza).
Primjer enzima koji sadrži kofaktor je karboanhidraza (što je prikazano u dijagramu gore) sa cinkovim vezanim kofaktorom, kao dijelom svog aktivnog mjesta. Ovi čvrsto vezani ioni ili molekule se obično nalaze u aktivnom mjestu i uključene su u katalizu. Naprimjer, kofaktori flavin i hem su često uključeni u redoksne reakcije.
Enzimi kojima je potreban kofaktor, ali nemaju granica nazivaju se apoenzim ili apoproteini. Enzimi zajedno sa kofaktorom, koji su potrebni za aktivnost nazivaju se holoenzimi (ili haloenzimi). Naziv holoenzimse može primijeniti na enzime koji sadrže više proteinskih podjedinica, kao što je DNK polimeraza, gdje cijelo holoenzimsko jedinjenje sadrži sve podjedinice potrebne za aktivnost.
Koenzim
urediKoenzimi su male organske molekule koje mogu biti slabo ili čvrsto vezane za enzim. Koenzimska hemijska grupa je prenosiva sa jednog enzima u drugi. Primjeri uključuju NADH, NADPH i adenozin trifosfat (ATP). Neki koenzimi, kao što su riboflavin, tiamin i folna kiselina, su vitamini ili jedinjenja koja se ne mogu sintetizirati u organizmu i moraju se unositi putem ishrane. Hemijske grupe koje uključuju hidrid ni ion (H -) nosi NAD ili NADP+, fosfate (adenozin trifosfat), a grupu acetil nose koenzimi A, formil, metenil ili metil grupe folna kiselina i metil grupa S-adenozila. Koenzimi se hemijski mijenjaju kao posljedica djelovanja enzima, a treba razmotriti koenzime za posebnu klasu podloga ili druge podloge, koje su zajedničke za više različitih enzima. Naprimjer, poznato je oko 1000 enzima koji koriste koenzime NADH.
Koenzimi se obično stalno obnavljaju i njihova koncentracija se unutar ćelije održava na stabilnoj razini. Naprimjer, NADPH se obnavlja preko pentoza fosfata i S –adenozilmetionina pomoću metionin adenozil transferaze. Ovo stalno obnavljanje znači da se male količine koenzima mogu koristiti vrlo intenzivno. Npr., ljudsko tijelo u metabolizmu ATP, dnevno obrće kompletnu vlastitu težinu.
Termodinamika
urediKao i svi katalizatori, enzimi ne mijenjaju stanje hemijske ravnotežne reakcije. U prisustvu enzima, reakcija teče u istom smjeru kao što bi i bez prisustva enzima, samo brže. Naprimjer, karboanhidraza katalizira svoju reakciju u oba smjera, ovisno o koncentraciji svojih reaktanata:
- (u tkivu; visoka koncentracijaCO2)
- (u plućima; niska koncentracija CO2).
Stopa reakcije zavisi od energije aktivacije potrebne da se stvori stanje tranzicije, koji onda razgrađuje podlogu u proizvode. Enzimi povećavaju stope reakcija smanjenjem energetskog stanja tranzicije. Prvo, vezanje stvara niskoenergetski kompleks enzim-supstrat (ES). Drugo, enzim stabilizira stanje tranzicije tako da zahtijeva manje energije u odnosu na jednokatalitsku reakciju (ES ‡). Na kraju se kompleks enzim-proizvod (EP) disocira da oslobodi proizvod.
Enzimi mogu obaviti dvije ili više reakcija, tako da se termodinamički povoljna reakcija može koristiti u "pogonu", dok je termodinamički nepovoljna u kombinaciji kada je energija proizvoda niža od one kod podloge. Naprimjer, hidroliza ATP se često koristi za pogon druge hemijske reakcije.
Kinetika
urediIstraživanja kinetike enzima su išla u pravcu odgovora na pitanje kako se vežu za podloge i pretvaraju ih u proizvode. Podaci o stopama koje se koriste u takvim analizama se obično dobijaju u enzimskim testovima. Godine 1913. Leonor Michaelis i Maud Leonora Menten su predložili kvantitativnu teoriju kinetike enzima, koja se naziva Michaelis-Menten kinetika. Najveći doprinos Michaelisa i Mentena je u tome da se enzimska reakcija odvija u dvije faze. U prvoj, podloga se veže reverzibilno za enzim, stvarajući kompleks enzim-supstrat. To se ponekad (u njihovu čast) naziva Michaelis-Menten kompleks. Enzim zatim katalizira hemijski korak u reakciji koja oslobađa proizvod. Ovaj rad su dodatno razvili George Edward Briggs i John Burdon Sanderson Haldane, od kojih potiču kinetičke jednačine koje su još uvijek i do danas u širokoj upotrebi.
Enzimske stope ovise o uslovima rastvora i koncentracije podloge. Za određivanje maksimalne brzine jedne enzimske reakcije, koncentracija supstrata se povećava po stalnoj stopi do vidljivog stvaranja proizvoda. Ovo je prikazano na krivulji zasićenja na desnoj strani. Zasićenje se događa jer, kako se povećava koncentracija supstrata, sve više i više slobodnog enzima se pretvara u ES kompleks njegovim vezanjem za podlogu. Na maksimalnu brzinu reakcije (Vmax) enzima, sva aktivna mjesta enzima su vezana za podlogu, a iznos ES kompleksa je isti kao i ukupan iznos enzima.
Vmax je samo jedan od nekoliko važnih kinetičkih parametara. Količina podloge koja je potrebna za postizanje određene stope reakcije je također važna. Michaelis-Menten konstanta (Km), predviđa koja je koncentracija supstrata potrebna za enzim do ispunjenja jedne polovine svoje maksimalne brzine reakcije. Uglavnom, svaki enzim ima poseban Km za datu podlogu. Još jedna korisna konstanta je kcat, koja se naziva i broj prometa, što je broj molekula supstrata razgrađenih po jednom aktivnom mjestu, u sekundi.
Efikasnost enzima može se izraziti u smislu kcat/Km. To se također zove specifična konstanta i uključuje stopu konstante za sve korake u reakciji do prvog ireverzibilnog koraka, uključujući i njega. Budući da specifična konstanta odražava i afinitet i katalitičke sposobnosti, korisna je za uporedno poređenje različitih enzima ili poređenje istog enzima na različitim podlogama. Teorijski maksimum za specifičnu konstantu se zove granica difuzija, koja je 108 do 109 (M−1s−1). U ovom trenutku svaki sudar enzima sa svojim supstratom će dovesti do katalize, a stopa stvaranje proizvoda nije ograničena brzinom reakcije, ali jeste stopom difuzije. Enzimi sa ove pozicije se nazivaju katalitsko savršenstvo ili kinetički savršeni. Primjer takvih enzima su: trioza-fosfat izomeraza, karboanhidraza, acetilholinesteraza, katalaza, fumaraza, β-laktamaza i superoksid dismutaza. Promet takvih enzima može doseći do nekoliko miliona reakcija u sekundi.
Michaelis-Mentenova kinetika se oslanja na zakon masovne akcije, koji je izveden iz pretpostavki o slobodnoj difuziji i termodinamičkim prelazima slučajnim sudarom. Mnogi biohemijski ili mobilni procesi značajno odstupaju od ovih uslova, zbog makromolekulske gužve i ograničenog molekulskog kretanja. Novijim pokušajima se proširuje model kompleksa za ispravku tih efekata.
Inhibicija
urediDihidrofolat reduktaza inhibira metotreksat, koji sprečava vezivanje svoje podloge, folne kiseline.
Vezivanja su prikazana u plavoj, inhibitor u zelenoj, a podloge u crnoj boji. (PDB 4QI9)
Zato je methotreksat kompeticijski inhibitor mnogih enzima koji upotrebljavaju folate
Stope enzimskih reakcija mogu biti smanjene različitim vrstama inhibitora enzima.
Načini inhibicije
urediKonkurentna
urediKompetitivni inhibitori i podloge se ne mogu vezati na enzim u isto vrijeme. Često konkurentni inhibitori jako podsjećaju na pravi supstrat enzima. Naprimjer, lijek metotreksat je kompetitivni inhibitor enzima dihidrofolat reduktaza, koji katalizira redukciju dihidrofolata u tetrahidrofolat. Sličnost između strukture dihidrofolata i ovog lijeka su prikazane na priloženoj slici. Ova vrsta inhibicije može se prevazići visokom koncentracijom podloge. U nekim slučajevima inhibitor se može vezati na neko drugo mjesto, nego na uobičajenom mjestu podloge i izazvati alosterni efekt promjenom oblika uobičajenih vezivanja na licu mjesta.
Nekompetitivna
urediNekompetitivni inhibitor se veže i na drugo, osim za supstratno mjesto. Podloga i dalje obavezuje svojim uobičajenim afinitetom i stoga Km ostaje isti. Međutim, inhibitor smanjuje katalitsku efikasnost enzima, tako da je Vmax smanjen. Za razliku od konkurentske inhibicije, nekonkurentna se ne može prevazići visokom koncentracijom podloge.
Nekonkurentna
urediJedan nekonkurentni inhibitor se ne može vezati na slobodni enzim, samo da stvori kompleks enzim-supstrat; ova vrsta inhibitora je najefikasnija u visokoj koncentraciji supstrata. U prisustvu inhibitora, kompleks enzim-supstrat je neaktivan. Ovakva inhibicija je relativno rijetka
Mješovita
urediMješoviti inhibitor veže alosterna mjesta, a vezivanja supstrata i inhibitora utiču jedni na druge. Uloga enzima se smanjuje, ali ne izostaje kad su vezani za inhibitor. Ova vrsta inhibitora ne prati Michaelis-Menten jednadžbu.
Nepovratna
urediNepovratan inhibitor trajno inaktivira enzim, obično stvaranjem kovalentne veze u proteinu. Penicilin i aspirin su uobičajeni lijekovi koji djeluju na ovaj način.
Uloge inhibitora
urediU mnogim organizmima, inhibitori mogu djelovati kao dio povratnih mehanizama. Ako enzim proizvodi prevelike količine jedne supstance u organizmu, a ta supstanca može djelovati kao inhibitor enzima na početak puta stvaranja proizvoda. Time uzrokuje sporiju proizvodnju supstance ili njen prekid kada postoji dovoljna količina proizvoda. Ovo je oblik negativne povratne informacije. Glavni metabolički putevi, kao što je ciklus limunske kiseline koriste ovaj mehanizam. Pošto inhibitori mijenjaju uloge enzima, često se koriste kao lijekovi. Mnogi od njih su dvojaki konkurentni inhibitori koji nalikuju izvornom supstratu za enzim, slično metotreksatu. Drugi dobro poznati primjeri uključuju statine, koji se koriste za liječenje visoke masnoće (holesterola), a tu su i inhibitor proteaze koje se koriste za liječenje retrovirusnih infekcija kao što je HIV. Čest primjer nepovratnog inhibitora koji se koristi kao lijek je aspirin, koji inhibira COX-1 i COX-2 enzime koji proizvode upale glasnika prostaglandina.
Drugi inhibitori enzima su otrovi. Naprimjer, otrov cijanid je nepovratni inhibitor enzima koji se kombinira sa bakrom i željezom u aktivnom mjestu enzima citohrom C oksidaze i blokiraju ćelijsko disanje.
Biološka funkcija
urediEnzimi imaju širok spektar funkcija unutar živih organizama. Oni su neophodni za signalnu regulacijuj u ćeliji, često preko kinaza i fosfataza. Oni također stvaraju pokret, miozina hidrolizirajući ATP i uzrokujući mišićna skupljanja, a također su opterećeni i oko ćelije, kao dijela citoskeleta. Druge ATPaze u ćelijskoj membrani su ionske pumpe uključene u aktivni transport. Enzimi su također učestvuju i u više egzotičnih uloga, kao što je fluciferaza koja dovodi do stvaranja svjetlosti kod (insekata) svitaca. Virusi također mogu sadržavati enzime za inficiranje ćelija, kao što su aHIV integraze i reverzna transkriptaza ili za oslobađanje ćelija od virusa, kao što je virus gripa – neuraminidaza.
Važna uloga enzima je u probavnom traktu životinja. Enzimi kao što su amilaza i proteaza razbijaju velike molekule (skrob ili proteine) na manje. Na taj način se u crijevima mogu apsorbirati. Škrobne molekule su prevelike da bi se apsorbirale direktno iz crijeva, ali enzimi hidrolizuju njihove lance u manje molekule, kao što su maltoza i na kraju glukoza, koja se može upijati. Različiti enzimi vare različite supstance iz hrane. Preživari, koji uzimaju biljojednu hranu, preko mikroorganizama u crijevima proizvode enzim, koji razlaže celulozu ćelijskih zidova biljnih vlakana.
Metabolizam
urediMetabolički put glikolize oslobađa energiju pretvaranjem glukoze u piruvat, preko niza prelaznih metabolita. Svaku hemijsku promjenu (crvena kutija na slici) obavlja drugi enzim. Nekoliko enzima u određenom redoslijedu mogu djelovati zajedno, stvarajući tako metaboličkie puteve. U metaboličkom putu jedan enzim uzima proizvod drugog, prethodnog enzima kao supstrat. Nakon katalitske reakcije, proizvod se zatim prenosi za djelovanje narednog enzima. Ponekad više od jednog enzima može katalizirati istu reakciju paralelno, što može dovesti do složenijeg toka. Tako naprimjer, stalno niska aktivnost jednog enzima dovodi do indukcijske visoke aktivnosti drugog enzima.[34][35][36][37][38][39] Bez enzima nemoguće je govoriti o metabolizmu, kao ni napretku kroz njegove korake i ne može biti uređenosti sistema za potrebe ćelije. Veći dio središnjeg metabolizma podešen je na nekoliko ključnih koraka, obično putem enzima, čija djelatnost uključuje hidrolizu ATP-a. Zbog toga što ova reakcija proizvodi toliko energije, druge reakcije koje su termodinamički nepovoljne mogu biti spojene sa hidrolizom ATP i ukupnim nizom povezanih metaboličkih reakcija.[40]
Kontrola aktivnosti
urediPostoje najčešće upotrebljavani načini kontrole aktivnosti enzima u ćeliji.
Uređivanje
urediEnzimi mogu pomoću drugih molekula biti ili aktivirani ili inhibirani. Naprimjer, krajnji proizvodi metaboličkih puteva su često inhibitori jednog od prvih enzima u njemu. Obično je prvi korak nepovratan, a naziva se "sveti korak"). Time se podešava količina krajnjeg proizvoda odgovarajućeg puta. Takav mehanizam podešavanja se naziva negativni mehanizam povratne informacije, jer je iznos krajnjeg proizvoda proizveden podešavanjem prema vlastitim koncentracijama. Negativni mehanizam povratne informacije može učinkovito prilagoditi brzinu sinteze povezujućih metabolita, prema zahtjevima ćelijskih potreba. Ovo pomaže efikasnom izdvajanju materijala u ekonomiji energije, a to sprečava višak proizvodnje gotovih proizvoda kao i drugih homeostaznih podešavanja. Kontrola enzimskih akcija pomaže održavanju stabilnog unutrašnjeg okruženja u živim organizmima.
Posttranslacijske promjene
urediU primjere posttranslacijskih promjena spadaju: fosforilacija, miristilacija i glikolizacija.[41] Naprimjer, u odgovoru na insulin prilikom fosforilacije učestvuje više enzima, među kojima je i glikogenska sintaza, koja pomaže u kontroli sinteze ili raspadu glikogena. Također, omogućuje i ćelijski odgovor na promjene količine šećera u krvi.[42] Još jedan primjer posttranslacijskih promjena je razgradnja polipeptidnih lanaca himotripsinom, probavnom proteazom, koja se proizvodi u neaktivnom obliku kao himotripsinogen u gušterači i prelazi u želudac gdje ee aktivira. Ovo zaustavlja enzim iz pankreasa ili drugih tkiva prije nego što uđe u probavu. Ova vrsta neaktivnih prethodnica enzima je poznata kao zimogeni ili proenzimi.
Količina
urediProizvodnju enzima (transkripcija) i translacija odgovarajućih gena ćelija može se povećati ili umanjiti, kao odgovor na promjene u njenom okruženju. Ovaj oblik regulacije gena se zove indukcija enzima. Naprimjer, bakterije mogu postati otporne na antibiotike kao što je penicilin, jer enzim pod nazivom beta-laktamaza izazva hidrolizu ključnog beta-laktamskog prstena unutar molekule penicilina.[43] Drugi primjer dolazi od enzima u jetri koji se naziva citohrom P450 oksidaza, koji su važni u metabolizmu lijekova. Unošenje ili inhibicija ovih enzima može izazvati međudejstva kod lijekova. Razina enzima može biti podešena promjenom stope raspada enzima.[44]
Subćelijska raspodjela
urediEnzimi mogu djelovati u procesima diobe u cijeloj ćeliji ili u različitim putevima metabolizma koji se javljaju u različitim ćelijskim dijelovima i strukturama. Naprimjer, masne kiseline sintetiziraju jednu grupu enzima u citosolu, endoplazmatskom retikulumu i Golgijevom aparatu. Pri tom koriste različite skupove enzima kao izvore energije u mitohondrijama, putem β-oksidacije.[45] Kod ljudi, različitih enzimi mogu promijeniti stepen protonacije (u citoplazmi bivaju neutralni, a u lizosomima kiseli) ili oksidativne upotrebe. Dobar primjer je njihova oksidacija u periplazmi ili njihovo ograničavanje u citoplazmi, što opet utiče na aktivnost enzima.
Specijalizirani organi
urediKod višećelijskih eukariota, ćelije u različitim organima i tkivima imaju različite obrasce ekspresije gena. Zbog toga imaju različite skupove enzima (poznate kao izoenzimi), koji su na raspolaganju prilikom metaboličkih reakcija. Ovo daje mehanizam za podešavanje ukupnog metabolizma u organizmu. Naprimjer, heksozakinaza koja je prvi enzim u glikoliznom putu, ima posebni oblik koji se zove glukokinaza, izražena u jetri i gušterači, a ima i niži afinitet za glukozu.[46] Međutim, još uvijek je osjetljiviji na količinu glukoze. Ovaj enzim je uključen u kontrolu šećera u krvi i podešavanje prilikom proizvodnje insulina.[47]
Dejstvo kod liječenja raznih bolesti
urediFenilalanin hidroksilaza ima preko 300 različitih vrsta mutacija u cijeloj strukturi, a uzrok je fenilketonurije.
Fenilalaninske podloge i tetrahidrobiopterinski koenzim (crno) i Fe2+ kofaktor (žuto)
Pošto su enzimi od suštinske važnosti za strogu kontrolu aktivnosti za održavanje homeostaze, bilo koji kvar (mutacija, hiperprodukcija, nedovoljna ili delecija) jednog kritičnog enzima može dovesti do nasljednih bolesti. Kvar samo jedne vrste enzima, od hiljada vrsta koje su prisutne u ljudskom tijelu, može biti fatalan. Primjer fatalne genetski uslovljene bolesti zbog enzimskog kvara je Tay-Sachsova bolest, u kojoj pacijenti nemaju enzim heksosaminidazu.
Nedostatak enzima je najćešći kod fenilketonurije. Mnoge različite mutacije jedne aminokiseline u enzimu fenilalanin hidroksilaza, koji katalizira prvi korak u degradaciji fenilalanina, dovodi do nagomilavanja fenilalanin ai srodnih proizvoda. Neke mutacije u aktivnom mjestu neposredno ometaju vezivanje i katalizu, ali mnoge su daleko od aktivnog mjesta i smanjuju aktivnost i destabilizaciju strukture proteina ili utiču na pravilnu oligomerizaciju. To može izazvati intelektualnu invalidnost, ako se bolest pravovremeno ne liječi. Drugi primjer je nedostatak pseudoholinesteraze, pri kojem je umanjena sposobnost organizma da razgrađuje holin esterske lijekove. Oralna primjena enzima može da se koristi za liječenje nekih funkcijskih nedostataka enzima, kao što je insuficijencija pankreasa i netolerancija laktoze.[48][49]
Drugi način poremećaja uloge enzima može uzrokovati bolesti koje su posljedica geminativnih mutacija gena koji kodiraju enzime prilikom reparacije DNK. Nedostatak ovih enzima izazva rak, jer ćelije su manje sposobne da poprave mutacije u njihovom genomu. To uzrokuje sporo akumuliranje mutacija, a rezultat ovoga je razvoj raka. Jedan primjer nasljednog sindroma je Xeroderma pigmetosum, što dovodi do razvoja raka kože, u odgovoru čak i na najmanje izlaganje ultraljubičastom svjetlu.
Konvencijsko imenovanje
urediImenovanje enzima standardno potiče iz naziva podloge ili katalizirane hemijske reakcije uz sufiks –aza. Primjeri su: laktaza, alkohol dehidrogenaza i DNK polimeraza. Različiti enzimi koji kataliziraju iste hemijske reakcije nazivaju se izoenzimi. Međunarodna unija za biohemiju i molekularnu biologiju je razvila nomenklaturu za enzime, po EC brojevima. Svaki enzim je opisan nizom od četiri broja kojima prethodi "EC". Prvi broj dijeli enzime na osnovu njihovog mehanizma djelovanja. Podjela na najvišem nivou je:
- EC 1, Oksidoreduktaze: kataliziraju reakcije oksidacije/redukcije;
- EC 2, Transferaze: premještaju funkcijske grupe (npr. metil ili fosfatnu grupu);
- EC 3, Hidrolaze: kataliziraju hidrolize različitih veza;
- EC 4, Lijaze: Cijepaju razne veze, osim hidrolize i oksidacije;
- EC 5, Izomeraze: kataliziraju izomerizacijske promjene u okviru jedne molekule;
- EC 6, Ligaze: Kataliziraju spajanje dvije molekule s kovalentnim vezama.
Ove sekcije su podijeljene po drugim karakteristikama, kao što su: podloge, proizvodi i hemijski mehanizmi. Enzim u potpunosti određuju četiri numeričke oznake. Naprimjer, heksozakinaza (EC 2.7.1.1) je transferaza (EC 2) koja dodaje fosfatnu grupu (EC 2.7) na heksozni šećer, molekulu koja sadrži alkoholnu grupu (EC 2.7.1).
Industrijska primjena
urediEnzimi se koriste u hemijskoj industriji kao i u drugim industrijskim granama, kada su potrebni posebni katalizatori. Enzimi su općenito ograničeni po broju reakcija koje su evoluirale za katalizu, kao i nedostatku stabilnosti u organskim otapalima i na visokim temperaturama. Kao posljedica toga, proteinsko inženjerstvo je aktivno područje istraživanja i objedinjuje pokušaje stvaranja novih enzima sa širokim svojstvima, bilo po racionalnom dizajnu ili evoluciji in vitro.[50][51] Ti napori su sve uspješniji, a nekoliko enzima sada su dizajnirani "od nule" da kataliziraji reakcije koje se ne javljaju u prirodi.[52]
- Uobičajene oblasti primjene enzima u industriji i domaćinstvu
| Primjena | Enzim | Korist |
|---|---|---|
| Industrija biogoriva | Celulaze | Razlaganje celuloze u šećere koji mogu fermentirati za proizvodnu celuloznog etanola[53] |
| Ligninaze | Pred-tretman biomase za proizvodnju biogoriva.[53] | |
| Biološki deterdžeenti | Proteaze, amilaze, lipaze | Otklanjanje proteina, škroba i masti ili uljnih boja sa odjeće i posuđa[54] |
| Mananaze | Otklanjanje boja hrane od uobičajenih aditiva[54] | |
| Pivarska industrija | Amilaza, glukanaze, proteaze | Dijeljenje polisaharida i proteina u slad[55] |
| β Glukanaze | Poboljšanje izražaja i karakteristika filtracije piva | |
| Amiloglukozidaze i pululanaze | Proizvodnja bezalkoholnog piva i prilagođavanje fermentabilnosti[55] | |
| Acetolaktat dekarboksilaza (ALDC) | Povećanje uspješnosti fermentacije, redukcijom formacija diacetiila[56] | |
| Kulinarstvo | Papain | Smekšavanje mesa za kuhanje[57] |
| Prehrambena industrija | Renin | Hidroliza proteina u proizvodnji sira[58] |
| Lipaze | Proizvodnja sira Camembert i plavih sireva, kao što je Roquefort[59] | |
| Proizvodnja hrane | Amilaze | Proizvodnje šećera od škroba u pravljenju visoko fruktoznog kukuruznog sirupa[60] |
| Proteaze | Smanjenje razine proteinskog floura, kao u pravljenju biskvita[61] | |
| Tripsin | Proizvodnja hipoalergijske hrane za bebe[61] | |
| Celulaze, pektinaze | Izbistravanje voćnih sokova [62] | |
| Molekularna biologija | Nukleaze, DNK ligaza i polimeraze | Upotreba restrikcijske digestije i reakcija PCR (polimerazna lančana reakcija) za kreiranje rekombinantne DNK[2] |
| Industrija papira | Ksilinaze, hemicelulaze i lignin peroksidaze | Otklanjanje lignina iz natronske pulpe[63] |
| Lična njega | Proteaze | Otklanjanje proteina sa kontaktnih sočiva u sprečavanju infekcija[64] |
| Industrija škrobnih proizvoda | Amilaze | Pretvaranje škroba u glukozu i različite izmijenjene šećerne sirupe[65] |
Također pogledajte
urediReference
uredi- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London, ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ a b c d Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th izd.). San Francisco: W.H. Freeman. ISBN 0-7167-4955-6.CS1 održavanje: više imena: authors list (link)
- ^ Schomburg I. et al. (2013): BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA. Nucleic Acids Research, 41: Database issue: D764-72.
- ^ Radzicka A., Wolfenden R. (1995): A proficient enzyme. Science, 267 (5194): 90–931.
- ^ Callahan B. P., Miller B- G. (2007): OMP decarboxylase — An enigma persists. Bioorganic Chemistry, 35 (6): 465–469.
- ^ Bugg T. (1997): An introduction to enzyme and coenzyme chemistry. Blackwell Science, Oxford, ISBN 0-86542-793-3.
- ^ Alberts B. (2002)ː Molecular biology of the cell Garland Science, New York, ISBN 0-8153-3218-1.
- ^ Lindhorst T. (2007): Essentials of carbohydrate chemistry and biochemistry. Wiley-VCH, 3527315284}}
- ^ Robyt F. (1997): Essentials of carbohydrate chemistry. Springer, ISBN 0387949518.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ de Réaumur R. A. (1752): Observations sur la digestion des oiseaux. Histoire de l'academie royale des sciences, 1752: 266, 461.
- ^ http://etext.lib.virginia.edu/toc/modeng/public/Wil4Sci.html: Williams H. S. (1904): A history of science: in five volumes, IV: Modern Development of the Chemical and Biological Sciences, Harper and Brothers.
- ^ Holmes, Frederic Lawrence (2003). "Enzymes". u Heilbron, John L. (ured.). The Oxford Companion to the History of Modern Science. Oxford: Oxford University Press. str. 270. Upotreblja se zastarjeli parametar
|chapterurl=(pomoć); Nepoznati parametar|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ "Eduard Buchner". Nobel Laureate Biography. Nobelprize.org. Pristupljeno 23. 2. 2015.
- ^ "Eduard Buchner – Nobel Lecture: Cell-Free Fermentation". Nobelprize.org. 1907. Pristupljeno 23. 2. 2015.
- ^ Duclaux E (1899). Traité de microbiologie: Diastases, toxines et venins [Microbiology Treatise: diastases , toxins and venoms] (jezik: French). Paris, France: Masson and Co.CS1 održavanje: nepoznati jezik (link) See Chapter 1, especially page 9.
- ^ Jaeger KE, Eggert T (august 2004). "Enantioselective biocatalysis optimized by directed evolution". Current Opinion in Biotechnology. 15 (4): 305–13. doi:10.1016/j.copbio.2004.06.007. PMID 15358000.
- ^ Shevelev IV, Hübscher U (maj 2002). "The 3' 5' exonucleases". Nature Reviews Molecular Cell Biology. 3 (5): 364–76. doi:10.1038/nrm804. PMID 11988770.
- ^ Zenkin N, Yuzenkova Y, Severinov K (juli 2006). "Transcript-assisted transcriptional proofreading". Science. 313 (5786): 518–20. doi:10.1126/science.1127422. PMID 16873663.
- ^ Ibba M, Soll D. "Aminoacyl-tRNA synthesis". Annual Review of Biochemistry. 69: 617–50. doi:10.1146/annurev.biochem.69.1.617. PMID 10966471.
- ^ Rodnina MV, Wintermeyer W. "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms". Annual Review of Biochemistry. 70: 415–35. doi:10.1146/annurev.biochem.70.1.415. PMID 11395413.
- ^ Khersonsky O, Tawfik DS. "Enzyme promiscuity: a mechanistic and evolutionary perspective". Annual Review of Biochemistry. 79: 471–505. doi:10.1146/annurev-biochem-030409-143718. PMID 20235827.
- ^ O'Brien PJ, Herschlag D (april 1999). "Catalytic promiscuity and the evolution of new enzymatic activities". Chemistry & Biology. 6 (4): R91–R105. doi:10.1016/S1074-5521(99)80033-7. PMID 10099128.
- ^ Fischer E (1894). "Einfluss der Configuration auf die Wirkung der Enzyme" [Influence of configuration on the action of enzymes]. Berichte der Deutschen chemischen Gesellschaft zu Berlin (jezik: German). 27 (3): 2985–93. doi:10.1002/cber.18940270364.CS1 održavanje: nepoznati jezik (link))
- ^ Cooper GM (2000). "Chapter 2.2: The Central Role of Enzymes as Biological Catalysts". The Cell: a Molecular Approach (2nd izd.). Washington (DC ): ASM Press. ISBN 0-87893-106-6. Upotreblja se zastarjeli parametar
|chapterurl=(pomoć) - ^ Koshland DE (februar 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proceedings of the National Academy of Sciences of the United States of America. 44 (2): 98–104. doi:10.1073/pnas.44.2.98. PMC 335371. PMID 16590179.
- ^ Vasella A, Davies GJ, Böhm M (oktobar 2002). "Glycosidase mechanisms". Current Opinion in Chemical Biology. 6 (5): 619–29. doi:10.1016/S1367-5931(02)00380-0. PMID 12413546.
- ^ Boyer, Rodney (2002). "Chapter 6: Enzymes I, Reactions, Kinetics, and Inhibition". Concepts in Biochemistry (2nd izd.). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. str. 137–8. ISBN 0-470-00379-0. OCLC 51720783. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ Savir Y, Tlusty T (2007). Scalas E (ured.). "Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition" (PDF). PLOS ONE. 2 (5): e468. doi:10.1371/journal.pone.0000468. PMC 1868595. PMID 17520027. Arhivirano s originala (PDF), 14. 5. 2011. Pristupljeno 26. 1. 2016. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ Cox, Michael M.; Nelson, David L. (2013). "Chapter 6.2: How enzymes work". Lehninger Principles of Biochemistry (6th izd.). New York, N.Y.: W.H. Freeman. str. 195. ISBN 978-1464109621. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ a b Benkovic SJ, Hammes-Schiffer S (august 2003). "A perspective on enzyme catalysis". Science. 301 (5637): 1196–202. Bibcode:2003Sci...301.1196B. doi:10.1126/science.1085515. PMID 12947189.
- ^ Villa J, Strajbl M, Glennon TM, Sham YY, Chu ZT, Warshel A (oktobar 2000). "How important are entropic contributions to enzyme catalysis?". Proceedings of the National Academy of Sciences of the United States of America. 97 (22): 11899–904. Bibcode:2000PNAS...9711899V. doi:10.1073/pnas.97.22.11899. PMC 17266. PMID 11050223.
- ^ Polgár, L. (7. 7. 2005). "The catalytic triad of serine peptidases". Cellular and Molecular Life Sciences (jezik: engleski). 62 (19–20): 2161–2172. doi:10.1007/s00018-005-5160-x. ISSN 1420-682X. PMID 16003488.
- ^ Voet D., Voet J. (1995): Biochemistry, 2nd Ed. Wiley, http://www.wiley.com/college/math/chem/cg/sales/voet.html.
- ^ Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger principles of biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
- ^ "Chapter 8: Control of Enzyme Activity". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. 2015. str. 141–69. ISBN 978-981-4463-92-8. Zanemaren tekst "Suzuki H" (pomoć)
- ^ "GSK-3: tricks of the trade for a multi-tasking kinase". Journal of Cell Science. 116 (Pt 7): 1175–86. april 2003. doi:10.1242/jcs.00384. PMC 3006448. PMID 12615961. Zanemaren tekst "Doble BW, Woodgett JR" (pomoć)
- ^ "Molecular basis of beta-lactamase induction in bacteria". Antimicrob. Agents Chemother. 37 (2): 153–8. 1993. doi:10.1128/aac.37.2.153. PMC 187630. PMID 8452343. Zanemaren tekst "Bennett PM, Chopra I" (pomoć)
- ^ "Chapter 3: Induction and Inhibition of Drug Metabolism". Introduction to Drug Metabolism (3 izd.). Cheltenham, UK: Nelson Thornes Publishers. 2001. str. 87–118. ISBN 978-0748760114. Zanemaren tekst "Skett P, Gibson GG" (pomoć)
- ^ "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". The Biochemical Journal. 323 (Pt 1): 1–12. april 1997. doi:10.1042/bj3230001. PMC 1218279. PMID 9173866. Zanemaren tekst "Faergeman NJ, Knudsen J" (pomoć)
- ^ "Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase". Structure. 12 (3): 429–38. mart 2004. doi:10.1016/j.str.2004.02.005. PMID 15016359. Zanemaren tekst "Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y" (pomoć)
- ^ "Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus". The New England Journal of Medicine. 328 (10): 697–702. mart 1993. doi:10.1056/NEJM199303113281005. PMID 8433729. Zanemaren tekst "Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, Lesage S, Stoffel M, Takeda J, Passa P" (pomoć)
- ^ "Enzyme replacement therapy for pancreatic insufficiency: present and future". Clinical and Experimental Gastroenterology. 4: 55–73. 2011. doi:10.2147/CEG.S17634. PMC 3132852. PMID 21753892. Zanemaren tekst "Fieker A, Philpott J, Armand M" (pomoć)
- ^ "Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment". United European Gastroenterology Journal. 1 (3): 151–9. juni 2013. doi:10.1177/2050640613484463. PMC 4040760. PMID 24917953. Zanemaren tekst "Misselwitz B, Pohl D, Frühauf H, Fried M, Vavricka SR, Fox M" (pomoć)
- ^ "Rational design of thermally stable proteins: relevance to bionanotechnology". Journal of Nanoscience and Nanotechnology. 5 (11): 1759–1767. novembar 2005. doi:10.1166/jnn.2005.441. PMID 16433409. Zanemaren tekst "Renugopalakrishnan V, Garduño-Juárez R, Narasimhan G, Verma CS, Wei X, Li P" (pomoć)
- ^ Hult K, Berglund P (august 2003). "Engineered enzymes for improved organic synthesis". Current Opinion in Biotechnology. 14 (4): 395–400. doi:10.1016/S0958-1669(03)00095-8. PMID 12943848.
- ^ "De novo computational design of retro-aldol enzymes". Science. 319 (5868): 1387–91. mart 2008. Bibcode:2008Sci...319.1387J. doi:10.1126/science.1152692. PMC 3431203. PMID 18323453. Zanemaren tekst "Jiang L, Althoff EA, Clemente FR, Doyle L, Röthlisberger D, Zanghellini A, Gallaher JL, Betker JL, Tanaka F, Barbas CF, Hilvert D, Houk KN, Stoddard BL, Baker D" (pomoć)
- ^ a b "Hydrolysis of lignocellulosic materials for ethanol production: a review". Bioresource Technology. 83 (1): 1–11. maj 2002. doi:10.1016/S0960-8524(01)00212-7. PMID 12058826. Zanemaren tekst "Sun Y, Cheng J" (pomoć)
- ^ a b "Industrial enzyme applications". Current Opinion in Biotechnology. 13 (4): 345–351. august 2002. doi:10.1016/S0958-1669(02)00328-2. Zanemaren tekst "Kirk O, Borchert TV, Fuglsang CC" (pomoć)
- ^ a b Briggs, Dennis E. (1998). Malts and Malting (1st izd.). London: Blackie Academic. ISBN 978-0412298004. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ "Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling". Biotechnology Progress. 16 (6): 958–65. doi:10.1021/bp000128k. PMID 11101321. Zanemaren tekst "Dulieu C, Moll M, Boudrant J, Poncelet D" (pomoć)
- ^ Tarté, Rodrigo (2008). Ingredients in Meat Products Properties, Functionality and Applications. New York: Springer. str. 177. ISBN 978-0-387-71327-4. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^ "Chymosin - GMO Database". web.archive.org. 4. 12. 2016. Arhivirano s originala 4. 12. 2016. Pristupljeno 3. 8. 2023.CS1 održavanje: bot: nepoznat status originalnog URL-a (link)
- ^ "Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties". Journal of Dairy Science. 79 (2): 169–184. februar 1996. doi:10.3168/jds.S0022-0302(96)76348-8. Zanemaren tekst "Molimard P, Spinnler HE" (pomoć)
- ^ "Amylolytic enzymes and products derived from starch: a review". Critical Reviews in Food Science and Nutrition. 35 (5): 373–403. septembar 1995. doi:10.1080/10408399509527706. Provjerite vrijednost parametra
|doi=(pomoć). PMID 8573280. Zanemaren tekst "Guzmán-Maldonado H, Paredes-López O" (pomoć) - ^ a b "Protease – GMO Database". GMO Compass. European Union. 10. 7. 2010. Arhivirano s originala, 24. 2. 2015. Pristupljeno 28. 2. 2015. Referenca sadrži prazan nepoznati parametar:
|coauthors=(pomoć)CS1 održavanje: nepreporučeni parametar (link) - ^ "Industrial applications of pectic enzymes: a review". Process Biochemistry. 33 (1): 21–28. januar 1998. doi:10.1016/S0032-9592(97)00046-0. Zanemaren tekst "Alkorta I, Garbisu C, Llama MJ, Serra JL" (pomoć)
- ^ "Application of enzymes in the pulp and paper industry". Biotechnology Progress. 15 (2): 147–157. mart 1999. doi:10.1021/bp990013k. PMID 10194388. Zanemaren tekst "Bajpai P" (pomoć)
- ^ "An analysis of contact lens enzyme cleaners". Journal of the American Optometric Association. 61 (3): 190–4. mart 1990. PMID 2186082. Zanemaren tekst "Begley CG, Paragina S, Sporn A" (pomoć)
- ^ Farris, Paul L. (2009). "Economic Growth and Organization of the U.S. Starch Industry". u BeMiller, James N.; Whistler, Roy L. (ured.). Starch Chemistry and Technology (3rd izd.). London: Academic. ISBN 9780080926551. Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć)
Vanjski linkovi
uredi- http://www.chem.qmul.ac.uk/iubmb/ IUBMB – Verzeichnis und Nomenklatur der Enzyme]
- http://www.brenda-enzymes.org/ BRENDA] umfangreiche Enzymdatenbank
- http://www.enzyme-database.org/index.php ExploreEnz – The Enzyme Database]
- http://www.expasy.org/enzyme/ Enzymdatenbank mit Suchmaschine]
- http://www.genome.ad.jp/kegg/pathway.html#amino KEGG Metabolic Pathway Database (graphische Darstellungen der biochemischen Reaktionen mit den dazugehörigen, systematisch identifizierten Enzymen)]