MPZ
Mijelinski nulti protein (P0, MPZ) jest jednostruki membranski glikoprotein koji je kod ljudi kodiran genom MPZsa hromosoma 1.[5] . P0 je glavna strukturna komponenta mijelinske ovojnice u perifernom nervnom sistemu (PNS).[6] Nulti mijelinski protein eksprimiraju Schwannove ćelije i čini više od 50% svih proteina u perifernom nervnom sistemu, što ga čini najčešćim proteinom eksprimiranim u PNS-u.[6] Mutacije u ovom proteinu mogu uzrokovati nedostatak mijelina i povezan je sa neuropatijama kao što so Charcot–Marie–Toothova bolest i Dejerine–Sottasova bolest.[7]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 248 aminokiselina, a molekulska težina 27.555 Da.[8]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAPGAPSSSP | SPILAVLLFS | SLVLSPAQAI | VVYTDREVHG | AVGSRVTLHC | ||||
| SFWSSEWVSD | DISFTWRYQP | EGGRDAISIF | HYAKGQPYID | EVGTFKERIQ | ||||
| WVGDPRWKDG | SIVIHNLDYS | DNGTFTCDVK | NPPDIVGKTS | QVTLYVFEKV | ||||
| PTRYGVVLGA | VIGGVLGVVL | LLLLLFYVVR | YCWLRRQAAL | QRRLSAMEKG | ||||
| KLHKPGKDAS | KRGRQTPVLY | AMLDHSRSTK | AVSEKKAKGL | GESRKDKK |
Struktura
uredi| Mijelin-P0 C | |
|---|---|
| Identifikatori | |
| Simbol | P0 |
Kod ljudi, gen koji kodira nulti mijelinski protein nalazi se na hromosomu 1 blizu Duffy lokusa ili Duffyjevog antigen/hemokinskog receptora. Gen je dug oko 7.000 baza i podijeljen je na šest egzona. Ukupno, nulti mijelinski protein ima 219 aminokiselina[6] i ima mnogo baznih aminokiselinskih ostataka.[9]
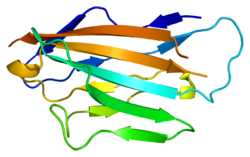
Nulti mijelinski protein sastoji se od vanćelijskogog N-terminalnog domena (aminokiseline 1–124), jedne transmembranske regije (125–150) i manje pozitivno nabijene unutarćelijske regije (151-219).[6][10][11] Njegov citoplazmatski domen je visoko pozitivno nabijen, ali se vjerovatno ne savija u globularnu strukturu.[12] Vanćelijski domen je strukturno sličan imunoglobulinskom domenu [9] i stoga se smatra da protein pripada natporodici imunoglobulina[13]
Osim što postoji kao monomer, poznato je da formira dimere i tetramere s drugim molekulama nultog mijelinskog proteina u kičmenjacima.[14]
Funkcija
urediMijelinska ovojnica je višeslojna membrana, jedinstvena za nervni sistem, koja funkcioniše kao izolator za značajno povećanje brzine provođenja aksonskih impulsa. Mijelinski nulti protein, odsutan u centralnom nervnom sistemu,[15] glavna je komponenta mijelinske ovojnice u živcima perifernog nervnog sistema. Mutacije koje remete funkciju funkcije nultog mijelinskog proteina mogu dovesti do manje ekspresije mijelina i degeneracije mijelinske ovojnice u perifernom nervnom sistemu.[16] Pretpostavlja se da se ekspresija nultog mijelinskog proteina proizvodi signalima iz aksona. Međutim, više detalja o regulaciji nultog mijelinskog proteina nije poznato.
Pretpostavlja se da je nulti protein mijelina strukturni element u formiranju i stabilizaciji mijelina perifernih živaca.[10] Pretpostavlja se također i da nulti mijelinski protein služi kao molekula ćelijske adhezije, držeći više slojeva mijelina zajedno.[11] Kada mijelinizirajuća ćelijaa obavija svoju membranu oko aksona više puta, stvarajući više slojeva mijelina, nulti mijelinski protein pomaže da oni budu kompaktni, služeći kao "ljepilo" koje drži slojeve mijelina zajedno.[12] To čini tako što svoju karakterističnu zavojnicčku strukturu drži zajedno elektrostatičkim interakcijama[9] svog pozitivno nabijenog unutarćelijskog domena sa kiselim lipidima u citoplazmaskoj stani suprotnog dvosloja.[15] i interakcijom između hidrofobnih globulastih 'glava' susjednih vanćelijskih domena.[15] Funkcija nultog mijelinskog proteina slična je funkciji drugih proteina sa imunoglobulinskim domenima,kao što su poliimunoglobin i T4 protein. Ovi proteini funkcionišu kao vezujuće i adhezivne molekule i učestvuju u homotipskim interakcijama ili interakcijama koje uključuju dva slična proteina.[10] Nulti mijelinski protein drži zajedno mijelinsku ovojnicu, učestvujući u homotipskim interakcijama sa drugim proteinima nulton mijelinskim proteinima. Vanćelijski domen ćelijskog nultog mijelina vezuje se za mijelinsku sfingolipidnu membranu i drži zajedno mijelinske slojeve, koristeći homotipske interakcije sa drugim vanćelijskim domenima nultog mijelinskog proteina,[7] i sa ostacima vanćelijske triptofanske membrane u interakciji sa membranom.[9]
Mijelinski nulti protein je također dokazano interaktivan s drugim proteinima kao što je periferni mijelinski protein 22.[17] Međutim, u tom smislu ove interakcije još uvijek nisu određene.[17]
Klinički značaj
urediPoznato je da mutacije u nultom mijelinskom proteinu uzrokuju degeneraciju mijelina i neuropatiju.[7] Za mutacije koje smanjuju adhezijsku funkciju ovog mijelinskog proteina ili njegovu sposobnost da učestvuje u homeotipskim interakcijama s drugim mijelinskim proteinima smatra se da uzrokuju neuropatiju.[18] Mjegove mutacije mogu dovesti do problema s razvojem mijelina u ranoj fazi života ili degeneracije mijelina na aksonima kasnije u životu.[13] Neke mutacije mogu uzrokovati neuropatiju u djetinjstvu poput Dejerine–Sottasove bolesti dok druge mutacije mogu uzrokovati neuropatiju u prve dvije decenije života kao što je Charcot–Marie –Toothova bolest.[7] Dodavanje nabijene aminokiseline ili promjena cisteinskog ostatka u vanćelijskoj membrani može dovesti do ranog početka neuropatije. Skraćivanje citoplazmatskog domena ili promjena tercijarne strukture nultog mijelinskog proteina također može dovesti do neuropatije[7] jer je dokazano da je citoplazmatski domen neophodan za homotipske interakcije.[13]
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000158887 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000056569 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Magnaghi V, Cavarretta I, Galbiati M, Martini L, Melcangi RC (novembar 2001). "Neuroactive steroids and peripheral myelin proteins". Brain Research. Brain Research Reviews. 37 (1–3): 360–71. doi:10.1016/s0165-0173(01)00140-0. PMID 11744100. S2CID 8004545.
- ^ a b c d Shy ME (mart 2006). "Peripheral neuropathies caused by mutations in the myelin protein zero". Journal of the Neurological Sciences. 242 (1–2): 55–66. doi:10.1016/j.jns.2005.11.015. PMID 16414078. S2CID 32802793.
- ^ a b c d e Shy ME, Jáni A, Krajewski K, Grandis M, Lewis RA, Li J, Shy RR, Balsamo J, Lilien J, Garbern JY, Kamholz J (februar 2004). "Phenotypic clustering in MPZ mutations". Brain. 127 (Pt 2): 371–84. doi:10.1093/brain/awh048. PMID 14711881.
- ^ "UniProt, P25189" (jezik: engleski). Pristupljeno 14. 12. 2021.
- ^ a b c d Shapiro L, Doyle JP, Hensley P, Colman DR, Hendrickson WA (septembar 1996). "Crystal structure of the extracellular domain from P0, the major structural protein of peripheral nerve myelin". Neuron. 17 (3): 435–49. doi:10.1016/s0896-6273(00)80176-2. PMID 8816707. S2CID 1719833.
- ^ a b c Lemke G, Axel R (mart 1985). "Isolation and sequence of a cDNA encoding the major structural protein of peripheral myelin". Cell. 40 (3): 501–8. doi:10.1016/0092-8674(85)90198-9. PMID 2578885. S2CID 1230708.
- ^ a b Lemke G, Lamar E, Patterson J (mart 1988). "Isolation and analysis of the gene encoding peripheral myelin protein zero". Neuron. 1 (1): 73–83. doi:10.1016/0896-6273(88)90211-5. PMID 2483091. S2CID 51695021.
- ^ a b Han H, Myllykoski M, Ruskamo S, Wang C, Kursula P (januar 2013). "Myelin-specific proteins: a structurally diverse group of membrane-interacting molecules". BioFactors. 39 (3): 233–41. doi:10.1002/biof.1076. PMID 23780694. S2CID 21111930.
- ^ a b c Kamholz JA, Brucal M, Li J, Shy M (2007), "Myelin Protein Zero and CMT1B: A Tale of Two Phenotypes", Molecular Neurology, Elsevier, str. 463–474, doi:10.1016/b978-012369509-3.50031-7, ISBN 9780123695093
- ^ Thompson AJ, Cronin MS, Kirschner DA (mart 2002). "Myelin protein zero exists as dimers and tetramers in native membranes of Xenopus laevis peripheral nerve". Journal of Neuroscience Research. 67 (6): 766–71. doi:10.1002/jnr.10167. PMID 11891790. S2CID 36556147.
- ^ a b c Sakamoto Y, Kitamura K, Yoshimura K, Nishijima T, Uyemura K (mart 1987). "Complete amino acid sequence of PO protein in bovine peripheral nerve myelin". The Journal of Biological Chemistry. 262 (9): 4208–14. doi:10.1016/S0021-9258(18)61334-1. PMID 2435734.
- ^ Kirschner DA, Inouye H, Saavedra RA (novembar 1996). "Membrane adhesion in peripheral myelin: good and bad wraps with protein P0". Structure. 4 (11): 1239–44. doi:10.1016/s0969-2126(96)00132-3. PMID 8939762.
- ^ a b D'Urso D, Ehrhardt P, Müller HW (maj 1999). "Peripheral myelin protein 22 and protein zero: a novel association in peripheral nervous system myelin". The Journal of Neuroscience. 19 (9): 3396–403. doi:10.1523/JNEUROSCI.19-09-03396.1999. PMC 6782240. PMID 10212299.
- ^ Pareyson, Davide; Marchesi, Chiara; Salsano, Ettore (2013), "Dominant Charcot–Marie–Tooth syndrome and cognate disorders", Handbook of Clinical Neurology, Elsevier, 115: 817–845, doi:10.1016/b978-0-444-52902-2.00047-3, ISBN 9780444529022, PMID 23931817
Dopunska literarura
uredi- Patel PI, Lupski JR (april 1994). "Charcot-Marie-Tooth disease: a new paradigm for the mechanism of inherited disease". Trends in Genetics. 10 (4): 128–33. doi:10.1016/0168-9525(94)90214-3. PMID 7518101.
- Nelis E, Haites N, Van Broeckhoven C (1999). "Mutations in the peripheral myelin genes and associated genes in inherited peripheral neuropathies". Human Mutation. 13 (1): 11–28. doi:10.1002/(SICI)1098-1004(1999)13:1<11::AID-HUMU2>3.0.CO;2-A. PMID 9888385.
- Watanabe M, Yamamoto N, Ohkoshi N, Nagata H, Kohno Y, Hayashi A, Tamaoka A, Shoji S (septembar 2002). "Corticosteroid- responsive asymmetric neuropathy with a myelin protein zero gene mutation". Neurology. 59 (5): 767–9. doi:10.1212/wnl.59.5.767. PMID 12221176.
- Hattori N, Yamamoto M, Yoshihara T, Koike H, Nakagawa M, Yoshikawa H, Ohnishi A, Hayasaka K, Onodera O, Baba M, Yasuda H, Saito T, Nakashima K, Kira J, Kaji R, Oka N, Sobue G (januar 2003). "Demyelinating and axonal features of Charcot-Marie-Tooth disease with mutations of myelin-related proteins (PMP22, MPZ and Cx32): a clinicopathological study of 205 Japanese patients". Brain. 126 (Pt 1): 134–51. doi:10.1093/brain/awg012. PMID 12477701.
- Shy ME (mart 2006). "Peripheral neuropathies caused by mutations in the myelin protein zero". Journal of the Neurological Sciences. 242 (1–2): 55–66. doi:10.1016/j.jns.2005.11.015. PMID 16414078. S2CID 32802793.
- Hayasaka K, Nanao K, Tahara M, Sato W, Takada G, Miura M, Uyemura K (oktobar 1991). "Isolation and sequence determination of cDNA encoding the major structural protein of human peripheral myelin". Biochemical and Biophysical Research Communications. 180 (2): 515–8. doi:10.1016/S0006-291X(05)81094-0. PMID 1719967.
- Ouvrier RA, McLeod JG, Conchin TE (februar 1987). "The hypertrophic forms of hereditary motor and sensory neuropathy. A study of hypertrophic Charcot-Marie-Tooth disease (HMSN type I) and Dejerine-Sottas disease (HMSN type III) in childhood". Brain. 110 ( Pt 1) (1): 121–48. doi:10.1093/brain/110.1.121. PMID 3467805.
- Tachi N, Ishikawa Y, Minami R (1985). "Two cases of congenital hypomyelination neuropathy". Brain & Development. 6 (6): 560–5. doi:10.1016/s0387-7604(84)80101-1. PMID 6099985. S2CID 4767216.
- Hayasaka K, Himoro M, Wang Y, Takata M, Minoshima S, Shimizu N, Miura M, Uyemura K, Takada G (septembar 1993). "Structure and chromosomal localization of the gene encoding the human myelin protein zero (MPZ)". Genomics. 17 (3): 755–8. doi:10.1006/geno.1993.1400. PMID 7503936.
- Su Y, Brooks DG, Li L, Lepercq J, Trofatter JA, Ravetch JV, Lebo RV (novembar 1993). "Myelin protein zero gene mutated in Charcot-Marie-tooth type 1B patients". Proceedings of the National Academy of Sciences of the United States of America. 90 (22): 10856–60. Bibcode:1993PNAS...9010856S. doi:10.1073/pnas.90.22.10856. PMC 47877. PMID 7504284.
- Himoro M, Yoshikawa H, Matsui T, Mitsui Y, Takahashi M, Kaido M, Nishimura T, Sawaishi Y, Takada G, Hayasaka K (septembar 1993). "New mutation of the myelin P0 gene in a pedigree of Charcot-Marie-Tooth neuropathy 1". Biochemistry and Molecular Biology International. 31 (1): 169–73. PMID 7505151.
- Hayasaka K, Himoro M, Sawaishi Y, Nanao K, Takahashi T, Takada G, Nicholson GA, Ouvrier RA, Tachi N (novembar 1993). "De novo mutation of the myelin P0 gene in Dejerine-Sottas disease (hereditary motor and sensory neuropathy type III)". Nature Genetics. 5 (3): 266–8. doi:10.1038/ng1193-266. PMID 7506095. S2CID 2512684.
- Pham-Dinh D, Fourbil Y, Blanquet F, Mattéi MG, Roeckel N, Latour P, Chazot G, Vandenberghe A, Dautigny A (decembar 1993). "The major peripheral myelin protein zero gene: structure and localization in the cluster of Fc gamma receptor genes on human chromosome 1q21.3-q23". Human Molecular Genetics. 2 (12): 2051–4. doi:10.1093/hmg/2.12.2051. PMID 7509228.
- Thomas FP, Lebo RV, Rosoklija G, Ding XS, Lovelace RE, Latov N, Hays AP (1994). "Tomaculous neuropathy in chromosome 1 Charcot-Marie-Tooth syndrome". Acta Neuropathologica. 87 (1): 91–7. doi:10.1007/BF00386259. PMID 7511317. S2CID 19827120.
- Nelis E, Timmerman V, De Jonghe P, Vandenberghe A, Pham-Dinh D, Dautigny A, Martin JJ, Van Broeckhoven C (decembar 1994). "Rapid screening of myelin genes in CMT1 patients by SSCP analysis: identification of new mutations and polymorphisms in the P0 gene". Human Genetics. 94 (6): 653–7. doi:10.1007/bf00206959. PMID 7527371. S2CID 5750189.
- Hilmi S, Fournier M, Valeins H, Gandar JC, Bonnet J (februar 1995). "Myelin P0 glycoprotein: identification of the site phosphorylated in vitro and in vivo by endogenous protein kinases". Journal of Neurochemistry. 64 (2): 902–7. doi:10.1046/j.1471-4159.1995.64020902.x. PMID 7530295. S2CID 32511382.
- Rautenstrauss B, Nelis E, Grehl H, Pfeiffer RA, Van Broeckhoven C (septembar 1994). "Identification of a de novo insertional mutation in P0 in a patient with a Déjérine-Sottas syndrome (DSS) phenotype". Human Molecular Genetics. 3 (9): 1701–2. doi:10.1093/hmg/3.9.1701. PMID 7530550.
- Latour P, Blanquet F, Nelis E, Bonnebouche C, Chapon F, Diraison P, Ollagnon E, Dautigny A, Pham-Dinh D, Chazot G (1995). "Mutations in the myelin protein zero gene associated with Charcot-Marie-Tooth disease type 1B". Human Mutation. 6 (1): 50–4. doi:10.1002/humu.1380060110. PMID 7550231. S2CID 20852048.
Vanjski linkovi
uredi- GeneReviews/NCBI/NIH/UW entry on Charcot-Marie-Tooth Neuropathy Type 1
- GeneReviews/NCBI/NIH/UW entry on Charcot-Marie-Tooth Neuropathy Type 2
- Myelin protein zero na US National Library of Medicine Medical Subject Headings (MeSH)
- P25189
Glikoproteini su složene bjelančevine koje, uz proteinsku komponentu, sadrže i oligosaharidne lance (glikane). Šećerna komponenta se kovalentno veže za bočne polipeptidne lance. Ta veza se ostvaruje tokom kotranslacijskih ili posttranslacijskih modifikacija. Ovaj proces se označava terminom glikozilacija, kroz koju često prolaze izlučevinski ekstracelularni proteini. Vanjski segmenti proteina čiji su segmenti u ekstracelularnom prostoru su također glikozirani.
N-glikolizacija i O-glikolizacija
urediPostoje dva tipa glikolizacije:
- U N-glizaciji, dodavanje šećera se može desiti na amidnom azotu bočnog lanca asparagina.
- U O-glikolizaciji, dodavanje šećera se dešava na hidroksil kisiku na bočnom lancu hidroksilizina, hidroksiprolina, serina ili treonina.
Monosaharidi
urediMonosaharidi koji se obično nalaze u eukariotskim glikoproteinima:[1]
| Šećer | Tip | Skraćenica |
|---|---|---|
| β-D-Glukoza | Heksoza | Glc |
| β-D-Galaktoza | Heksoza | Gal |
| β-D-Manoza | Heksoza | Man |
| α-L-Fukoza | Deoksiheksoza | Fuc |
| N-Acetilgalaktozamin | Aminoheksoza | GalNAc |
| N-Acetilglukozamin | Aminoheksoza | GlcNAc |
| N-Acetilneuraminska kiselina | Aminononulosonska kiselina (Sijalinska kiselina) |
NeuNAc |
| Ksiloza | Pentoza | Xyl |
Šećerna grupa ili grupe pomažu savijanje ili održavanje stabilnosti proteina.
Glikoproteini su široko rasprostranjeni u žjezdanim tkivima životinja koja sintetiziraju sekrete i ekskrete.[3] Osobito značajne integracijske membranski komponente, koje učestvuju u međućelijskim interakcijama. Formiraju se i u citosolu, ali su njihove funkcije i način formiraja, kao i moguće modifikacije manje poznati. Komponente su mnogih tkivnih antigen]a ((krvnih grupa, npr.)
Reference
uredi- ^ Murray R. K., Granner D. K., Rodwell V. W. (2006): Harper's Illustrated Biochemistry 27th Ed. McGraw–Hill, New York.
- ^ Glycan classification Arhivirano 27. 10. 2012. na Wayback Machine SIGMA
- ^ Sofradžija A., Šoljan D., Hadžiselimović R. (1996): Biologija 1, Svjetlost, Sarajevo, ISBN 9958-10-686-8.