Faktor V
Faktor V (faktor pet) jest protein sistema koagulacije, koji je kod ljudi kodiran genom FV sa hromosoma 1, regija1q24. Rijetko se naziva proakcelerin ili labilni faktor. Za razliku od većine drugih faktora koagulacije, nije enzimski aktivan, ali funkcioniše kao kofaktor. Nedostatak dovodi do predispozicije za hemoragiju, dok neke mutacije (najčešće faktor V Leiden) predisponiraju za trombozu.
Genomski je srodan familiji multibakar-oksidaza i homologan je koagulacijskom faktoru VIII. Gen se prostire na 70 kb, sastoji se od 25 egzona, a rezultirajući protein ima relativnu molekulsku masu od približno 330 kDa.
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 2 224 aminokiseline, a molekulska težina 251.703 Da.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MFPGCPRLWV | LVVLGTSWVG | WGSQGTEAAQ | LRQFYVAAQG | ISWSYRPEPT | ||||
| NSSLNLSVTS | FKKIVYREYE | PYFKKEKPQS | TISGLLGPTL | YAEVGDIIKV | ||||
| HFKNKADKPL | SIHPQGIRYS | KLSEGASYLD | HTFPAEKMDD | AVAPGREYTY | ||||
| EWSISEDSGP | THDDPPCLTH | IYYSHENLIE | DFNSGLIGPL | LICKKGTLTE | ||||
| GGTQKTFDKQ | IVLLFAVFDE | SKSWSQSSSL | MYTVNGYVNG | TMPDITVCAH | ||||
| DHISWHLLGM | SSGPELFSIH | FNGQVLEQNH | HKVSAITLVS | ATSTTANMTV | ||||
| GPEGKWIISS | LTPKHLQAGM | QAYIDIKNCP | KKTRNLKKIT | REQRRHMKRW | ||||
| EYFIAAEEVI | WDYAPVIPAN | MDKKYRSQHL | DNFSNQIGKH | YKKVMYTQYE | ||||
| DESFTKHTVN | PNMKEDGILG | PIIRAQVRDT | LKIVFKNMAS | RPYSIYPHGV | ||||
| TFSPYEDEVN | SSFTSGRNNT | MIRAVQPGET | YTYKWNILEF | DEPTENDAQC | ||||
| LTRPYYSDVD | IMRDIASGLI | GLLLICKSRS | LDRRGIQRAA | DIEQQAVFAV | ||||
| FDENKSWYLE | DNINKFCENP | DEVKRDDPKF | YESNIMSTIN | GYVPESITTL | ||||
| GFCFDDTVQW | HFCSVGTQNE | ILTIHFTGHS | FIYGKRHEDT | LTLFPMRGES | ||||
| VTVTMDNVGT | WMLTSMNSSP | RSKKLRLKFR | DVKCIPDDDE | DSYEIFEPPE | ||||
| STVMATRKMH | DRLEPEDEES | DADYDYQNRL | AAALGIRSFR | NSSLNQEEEE | ||||
| FNLTALALEN | GTEFVSSNTD | IIVGSNYSSP | SNISKFTVNN | LAEPQKAPSH | ||||
| QQATTAGSPL | RHLIGKNSVL | NSSTAEHSSP | YSEDPIEDPL | QPDVTGIRLL | ||||
| SLGAGEFKSQ | EHAKHKGPKV | ERDQAAKHRF | SWMKLLAHKV | GRHLSQDTGS | ||||
| PSGMRPWEDL | PSQDTGSPSR | MRPWKDPPSD | LLLLKQSNSS | KILVGRWHLA | ||||
| SEKGSYEIIQ | DTDEDTAVNN | WLISPQNASR | AWGESTPLAN | KPGKQSGHPK | ||||
| FPRVRHKSLQ | VRQDGGKSRL | KKSQFLIKTR | KKKKEKHTHH | APLSPRTFHP | ||||
| LRSEAYNTFS | ERRLKHSLVL | HKSNETSLPT | DLNQTLPSMD | FGWIASLPDH | ||||
| NQNSSNDTGQ | ASCPPGLYQT | VPPEEHYQTF | PIQDPDQMHS | TSDPSHRSSS | ||||
| PELSEMLEYD | RSHKSFPTDI | SQMSPSSEHE | VWQTVISPDL | SQVTLSPELS | ||||
| QTNLSPDLSH | TTLSPELIQR | NLSPALGQMP | ISPDLSHTTL | SPDLSHTTLS | ||||
| LDLSQTNLSP | ELSQTNLSPA | LGQMPLSPDL | SHTTLSLDFS | QTNLSPELSH | ||||
| MTLSPELSQT | NLSPALGQMP | ISPDLSHTTL | SLDFSQTNLS | PELSQTNLSP | ||||
| ALGQMPLSPD | PSHTTLSLDL | SQTNLSPELS | QTNLSPDLSE | MPLFADLSQI | ||||
| PLTPDLDQMT | LSPDLGETDL | SPNFGQMSLS | PDLSQVTLSP | DISDTTLLPD | ||||
| LSQISPPPDL | DQIFYPSESS | QSLLLQEFNE | SFPYPDLGQM | PSPSSPTLND | ||||
| TFLSKEFNPL | VIVGLSKDGT | DYIEIIPKEE | VQSSEDDYAE | IDYVPYDDPY | ||||
| KTDVRTNINS | SRDPDNIAAW | YLRSNNGNRR | NYYIAAEEIS | WDYSEFVQRE | ||||
| TDIEDSDDIP | EDTTYKKVVF | RKYLDSTFTK | RDPRGEYEEH | LGILGPIIRA | ||||
| EVDDVIQVRF | KNLASRPYSL | HAHGLSYEKS | SEGKTYEDDS | PEWFKEDNAV | ||||
| QPNSSYTYVW | HATERSGPES | PGSACRAWAY | YSAVNPEKDI | HSGLIGPLLI | ||||
| CQKGILHKDS | NMPMDMREFV | LLFMTFDEKK | SWYYEKKSRS | SWRLTSSEMK | ||||
| KSHEFHAING | MIYSLPGLKM | YEQEWVRLHL | LNIGGSQDIH | VVHFHGQTLL | ||||
| ENGNKQHQLG | VWPLLPGSFK | TLEMKASKPG | WWLLNTEVGE | NQRAGMQTPF | ||||
| LIMDRDCRMP | MGLSTGIISD | SQIKASEFLG | YWEPRLARLN | NGGSYNAWSV | ||||
| EKLAAEFASK | PWIQVDMQKE | VIITGIQTQG | AKHYLKSCYT | TEFYVAYSSN | ||||
| QINWQIFKGN | STRNVMYFNG | NSDASTIKEN | QFDPPIVARY | IRISPTRAYN | ||||
| RPTLRLELQG | CEVNGCSTPL | GMENGKIENK | QITASSFKKS | WWGDYWEPFR | ||||
| ARLNAQGRVN | AWQAKANNNK | QWLEIDLLKI | KKITAIITQG | CKSLSSEMYV | ||||
| KSYTIHYSEQ | GVEWKPYRLK | SSMVDKIFEG | NTNTKGHVKN | FFNPPIISRF | ||||
| IRVIPKTWNQ | SIALRLELFG | CDIY |
Struktura
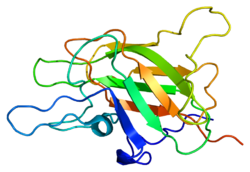
urediProtein faktora V sastoji se od šest domena: A1-A2-B-A3-C1-C2.
A domeni su homologni sa A domenima proteina koji vezuje bakar ni ceruloplazmin i formiraju trouglastu strukturu kao u tom proteinu. Ion bakra je vezan na interfejsu A1-A3, a A3 je u interakciji sa plazmom.[5]
C-domeni pripadaju porodici fosfolipid-vezujućih diskoidinskih domena (nije u vezi sa C2-domenom), a C2-domen posreduje u vezivanju membrane. B-domen C-terminala deluje kao kofaktor za antikoagulansni protein C aktivirajući protein S.[6][7]
Aktivacija faktora V u faktor Va vrši se cijepanjem i oslobađanjem B-domena, nakon čega protein više ne pomaže u aktivaciji proteina C. Protein je sada podijeljen na teški lanac koji se sastoji od A1-A2 domena i lahki lanac, koji se sastoji od A3-C1-C2 domena. Oba nekovalentno formiraju kompleks na način ovisan o kalciju. Ovaj kompleks je prokoagulantni faktor Va.[6]
Fiziologija
urediSinteza faktora V se uglavnom odvija u jetri. U jetri ga prvenstveno proizvode megakariociti, koji proizvode trombocite i faktor V koji potiče od trombocita, i hepatociti, koji proizvode faktor V iz plazme.[8] Molekula cirkuliše u plazmi kao jednolančana molekula sa poluživotom u plazmi od 12-36 sati.[9]
Faktor V je u stanju da se veže za aktivirane trombocite i aktivira ga trombin. Prilikom aktivacije, faktor V se spaja u dva lanca (teški i lahki lanac sa molekulskom masom od 110000 i 73000) koji su nekovalentno vezani jedan za drugi pomoću kalcija. Time aktivirani faktor V (sada zvani FVa) je kofaktor kompleksa protrombinaza: Aktivirani enzimski faktor X (FXa) zahtijeva kalcij i aktivirani faktor V (FVa) za pretvaranje protrombina u trombin na površine ćelijske membrane.
Faktor Va razgrađuje aktivirani protein C, jedan od glavnih fizioloških inhibitora koagulacije. U prisustvu trombomodulina, trombin djeluje na smanjenje zgrušavanja tako što aktivira protein C; stoga su koncentracija i djelovanje proteina C važne determinante u negativnoj povratnoj sprezi kroz koju trombin ograničava vlastitu aktivaciju.
Klinički značaj
urediPoznati su različiti nasljedni poremećaji faktora V. Nedostatak je povezan s rijetkim blagim oblikom hemofilije (koji se naziva parahemofilija ili Owrenova parahemofilija), čija je incidencija oko 1:1.000.000. Nasljeđuje se na autosomno recesivno način.
Postoji tendencija krvarenja povezana s genetičkom regulacijom skraćenog FV, manje izoforme FV za preradu. Ova abnormalna tendencija krvarenja javlja se kod poremećaja krvarenja u istočnom Teksasu, poremećaja krvarenja u Amsterdamu i trećeg i ekstremnijeg primjera koji su opisali Karen L. Zimowski et al., 2021.[10]
Ostale mutacije faktora V povezane su sa venskom trombozom. Oni su najčešći nasljedni uzroci trombofilije (sklonost stvaranju krvnih ugrušaka). Najčešći od njih, faktor V Leiden, nastaje zbog zamjene argininskog ostatka sa glutaminom na aminokiselinskoj poziciji 506 (R506Q). Sve protrombotske mutacije faktora V (faktor V Leiden, faktor V Cambridge, faktor V Hong Kong) čine ga otpornim na cijepanje aktiviranim proteinom C („APC rezistencija“). Stoga ostaje aktivan i povećava brzinu stvaranja trombina.
Interakcije
urediPokazalo se da faktor V reaguje sa proteinom S.[11][12]
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000198734 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000026579 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Villoutreix BO, Björn Dahlbäck (juni 1998). "Structural investigation of the A domains of human blood coagulation factor V by molecular modeling". Protein Science. 7 (6): 1317–25. doi:10.1002/pro.5560070607. PMC 2144041. PMID 9655335. Greška u vankuverskom stilu: name u nazivu 2 (pomoć)
- ^ a b Thorelli E, Kaufman RJ, Dahlbäck B (juni 1998). "The C-terminal region of the factor V B-domain is crucial for the anticoagulant activity of factor V". The Journal of Biological Chemistry. 273 (26): 16140–45. doi:10.1074/jbc.273.26.16140. PMID 9632668.
- ^ Macedo-Ribeiro S, Bode W, Huber R, Quinn-Allen MA, Kim SW, Ortel TL, Bourenkov GP, Bartunik HD, Stubbs MT, Kane WH, Fuentes-Prior P (novembar 1999). "Crystal structures of the membrane-binding C2 domain of human coagulation factor V". Nature. 402 (6760): 434–39. Bibcode:1999Natur.402..434M. doi:10.1038/46594. PMID 10586886. S2CID 4393638.
- ^ Lam W, Moosavi L (18. 7. 2022). "Physiology, Factor V". StatPearls. StatPearls Publishing. Pristupljeno 7. 2. 2022.
- ^ Huang JN, Koerper MA (novembar 2008). "Factor V deficiency: a concise review". Haemophilia. 14 (6): 1164–69. doi:10.1111/j.1365-2516.2008.01785.x. PMID 19141156.
- ^ Castoldi E (juli 2021). "F5-Atlanta: Factor V-short strikes again". Journal of Thrombosis and Haemostasis. 19 (7): 1638–1640. doi:10.1111/jth.15351. PMC 8362210 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34176223 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Heeb MJ, Kojima Y, Rosing J, Tans G, Griffin JH (decembar 1999). "C-terminal residues 621–635 of protein S are essential for binding to factor Va". The Journal of Biological Chemistry. 274 (51): 36187–92. doi:10.1074/jbc.274.51.36187. PMID 10593904.
- ^ Heeb MJ, Mesters RM, Tans G, Rosing J, Griffin JH (februar 1993). "Binding of protein S to factor Va associated with inhibition of prothrombinase that is independent of activated protein C". The Journal of Biological Chemistry. 268 (4): 2872–77. doi:10.1016/S0021-9258(18)53854-0. PMID 8428962.
Dopunska literatura
uredi- Nicolaes GA, Dahlbäck B (april 2002). "Factor V and thrombotic disease: description of a janus-faced protein". Arteriosclerosis, Thrombosis, and Vascular Biology. 22 (4): 530–38. doi:10.1161/01.ATV.0000012665.51263.B7. PMID 11950687.
- Segers K, Dahlbäck B, Nicolaes GA (septembar 2007). "Coagulation factor V and thrombophilia: background and mechanisms". Thrombosis and Haemostasis. 98 (3): 530–42. doi:10.1160/th07-02-0150. PMID 17849041.
- Hooper WC, De Staercke C (2006). "The relationship between FV Leiden and pulmonary embolism". Respiratory Research. 3 (1): 8. doi:10.1186/rr180. PMC 64819. PMID 11806843.
- Schrijver I, Houissa-Kastally R, Jones CD, Garcia KC, Zehnder JL (februar 2002). "Novel factor V C2-domain mutation (R2074H) in two families with factor V deficiency and bleeding" (PDF). Thrombosis and Haemostasis. 87 (2): 294–99. doi:10.1055/s-0037-1612988. PMID 11858490. S2CID 4818866. Arhivirano s originala (PDF), 7. 3. 2019.
- Mann KG, Kalafatis M (januar 2003). "Factor V: a combination of Dr Jekyll and Mr Hyde" (PDF). Blood. 101 (1): 20–30. doi:10.1182/blood-2002-01-0290. PMID 12393635. S2CID 8885302.
- Duga S, Asselta R, Tenchini ML (august 2004). "Coagulation factor V". The International Journal of Biochemistry & Cell Biology. 36 (8): 1393–99. doi:10.1016/j.biocel.2003.08.002. PMID 15147718. S2CID 27193482.
- Andreassi MG, Botto N, Maffei S (2006). "Factor V Leiden, prothrombin G20210A substitution and hormone therapy: indications for molecular screening". Clinical Chemistry and Laboratory Medicine. 44 (5): 514–21. doi:10.1515/CCLM.2006.103. PMID 16681418. S2CID 34399027.
- Du X (maj 2007). "Signaling and regulation of the platelet glycoprotein Ib-IX-V complex". Current Opinion in Hematology. 14 (3): 262–69. doi:10.1097/MOH.0b013e3280dce51a. PMID 17414217. S2CID 39904506.