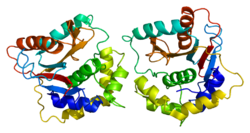
Ubikvitin karboksil-terminalna esteraza L1
Ubikvitinska karboksi-terminalna hidrolaza L1 (EC: 3.1.2.15) ili ubikvitin C-terminalna hidrolaza jest deubikvitizinirajući enzim koji je kod ljudi kodiran genom UCH-L1 sa hromosoma 3.
| Ubikvitinska karboksi-terminalna hidrolaza L1L1 (UCH-L1) | |
|---|---|
 Neuroni iz moždanog tkiva pacova obojenog u zeleno antitijelom na ubikvitin C-terminalnu hidrolazu L1 (UCH-L1) koja jače ističe tijelo ćelije i slabije ćelijske procese. Astrociti su obojeni crvenom bojom antitijela na GFAP protein koji se nalazi u citoplazmatskim filamentima. Jedra svih tipova ćelija obojena su u plavo bojom koja vezuje DNK. Antitijela, priprema ćelija i slika koju generira EnCor Biotechnology Inc. | |
| Anatomska terminologija |
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 223 aminokiseline, a molekulska težina 24.824 Da.[5]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MQLKPMEINP | EMLNKVLSRL | GVAGQWRFVD | VLGLEEESLG | SVPAPACALL | ||||
| LLFPLTAQHE | NFRKKQIEEL | KGQEVSPKVY | FMKQTIGNSC | GTIGLIHAVA | ||||
| NNQDKLGFED | GSVLKQFLSE | TEKMSPEDRA | KCFEKNEAIQ | AAHDAVAQEG | ||||
| QCRVDDKVNF | HFILFNNVDG | HLYELDGRMP | FPVNHGASSE | DTLLKDAAKV | ||||
| CREFTEREQG | EVRFSAVALC | KAA |
Struktura proteina
urediLjudski UCH-L1 i blisko srodni protein UCHL3 imaju jednu od najkomplikovanijih struktura do sada otkrivenih za protein, sa pet ukrštanja čvorova. Nagađa se da struktura čvorova može povećati otpornost proteina na razgradnju u proteasomu.[6][7]
Konformacija UCH-L1 proteina također može biti važan pokazatelj neuroprotekcije ili patologije. Naprimjer, pokazalo se da dimer UCH-L1 pokazuje potencijalno patogenu aktivnost ligaza i može dovesti do gore spomenutog povećanja agregacije α-sinukleina.[8] S18Y polimorfizam UCH-L1 je pokazalo se da su manje skloni dimerizaciji.[9]
Funkcija
urediUCH-L1 je član porodice gena čiji proizvodi hidroliziraju male C-terminalne adukte ubikvitina, kako bi se generirao ubikvitinski monomer. Ekspresija UCH-L1 je visoko specifična za neurone i ćelije difuznog neuroendokrinog sistema i njihove tumore. Obilno je prisutan u svim neuronima (zahvata 1–2% ukupnih proteina mozga), posebno eksprimiran u neuronima i sjemeniciima/jajnicima.[5][10]
Katalitska trijada UCH-L1 sadrži cistein na poziciji 90, aspartat[] na poziciji 176 i histidin na poziciji 161 koji su odgovorni za njegovu hidrolaznu aktivnost.[11]
Ektopijska ekspresija
urediIako je ekspresija proteina UCH-L1 specifična za neurone, otkriveno je da ga i tkivo testisa/jajnika eksprimira u određenim ćelijskim linijama tumora pluća.[12] Ova abnormalna ekspresija UCH-L1 je implicirana u raku i dovela je do označavanja UCH-L1 kao onkogena.[13]
Nadalje, postoje dokazi da bi UCH-L1 mogao imati ulogu u patogenezi membranskog glomerulonefritisa, jer je de novo ekspresija UCH-L1 u podocitima nađena u PHN, pacovskom modelu ljudskog mGN.[14] Smatra se da ova ekspresija UCH-L1 barem djelomično izaziva hipertrofiju podocita.[15]
Klinički značaj
urediTačkasta mutacija (I93M) u genu koji kodira ovaj protein implicirana je kao uzrok Parkinsonove bolesti u jednoj njemačkoj porodici, iako je ovaj nalaz kontroverzan, jer ni kod jednog drugog pacijenta s Parkinsonovom bolešću ova mutacija nije pronađena.[16][17]
Nadalje, otkriveno je da je polimorfizam (S18Y) u ovom genu povezan sa smanjenim rizikom od Parkinsonove bolesti.[18] Posebno se pokazalo da ovaj polimorfizam ima antioksidativno djelovanje.[19]
Još jedna potencijalno zaštitna funkcija UCH-L1 je njegova prijavljena sposobnost da stabilizuje monoubikvitin, važnu komponentu ubikvitin proteasomskog sistema. Smatra se da stabilizacijom monomera ubikvitina i na taj način sprečavajući njihovu degradaciju, UCH-L1 povećava raspoloživi skup ubikvitina koji će biti označen na proteinima koji su predodređeni da budu razgrađeni proteasomom.[9]
Gen je također povezan sa Alzheimerovom bolešću i potreban je za normalnu sinapsnu i kognitivnu funkciju.[20] Gubitak Uchl1 povećava osjetljivost beta-ćelija gušterače na programiranu ćelijsku smrt, što ukazuje da ovaj protein ima zaštitnu ulogu u neuroendokrinim ćelijama i ilustruje vezu između dijabetesa i neurodegenerativnih bolesti.[21]
Pacijenti s ranom neurodegeneracijom u kojoj je uzročna mutacija bila u genu UCHL1 (konkretno, domen za vezivanje ubikvitina, E7A) pokazuju sljepilo, cerebelumsku ataksiju, nistagmus, disfunkciju dorzalnog stuba i disfunkciju gornjih motornih neurona.[22]
Interakcije
urediPokazalo se da ubikvitin karboksi-terminalna hidrolaza L1 ima reakcije sa podjedinica 5 homologa konstitutivnog fotomorfogena COP9.[23]
Također se pokazalo da UCH-L1 stupa u interakciju sa alfa-sinukleinom, drugim proteinom koji je uključen u patološke promjene Parkinsonove bolesti. Izvještava se da je ova aktivnost rezultat njene aktivnosti ubikvitil-ligaze koja može biti povezana s I93M patogenom mutacijom u genu.[8]
Nedavno je pokazano da UCH-L1 stupa u interakciju sa E3 ligazom, parkin. Pokazalo se da se parkin vezuje i ubikvitiniluje UCH-L1, kako bi promovirao lizosomsku degradaciju UCH-L1.[24]
Također pogledajte
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000154277 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000029223 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Entrez Gene: UCHL1 ubiquitin carboxyl-terminal esterase L1 (ubiquitin thiolesterase)".
- ^ Peterson, Ivars (14. 10. 2006). "Knots in proteins". Science News. Arhivirano s originala, 21. 4. 2008. Pristupljeno 11. 9. 2008.
- ^ Virnau P, Mirny LA, Kardar M (Sep 2006). "Intricate knots in proteins: Function and evolution". PLOS Computational Biology. 2 (9): e122. Bibcode:2006PLSCB...2..122V. doi:10.1371/journal.pcbi.0020122. PMC 1570178. PMID 16978047.
- ^ a b Liu Y, Fallon L, Lashuel HA, Liu Z, Lansbury PT (Oct 2002). "The UCH-L1 gene encodes two opposing enzymatic activities that affect alpha-synuclein degradation and Parkinson's disease susceptibility". Cell. 111 (2): 209–18. doi:10.1016/s0092-8674(02)01012-7. PMID 12408865. S2CID 6849108.
- ^ a b Osaka H, Wang YL, Takada K, Takizawa S, Setsuie R, Li H, Sato Y, Nishikawa K, Sun YJ, Sakurai M, Harada T, Hara Y, Kimura I, Chiba S, Namikawa K, Kiyama H, Noda M, Aoki S, Wada K (Aug 2003). "Ubiquitin carboxy-terminal hydrolase L1 binds to and stabilizes monoubiquitin in neuron". Human Molecular Genetics. 12 (16): 1945–58. doi:10.1093/hmg/ddg211. PMID 12913066.
- ^ Doran JF, Jackson P, Kynoch PA, Thompson RJ (Jun 1983). "Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis". Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- ^ Das C, Hoang QQ, Kreinbring CA, Luchansky SJ, Meray RK, Ray SS, Lansbury PT, Ringe D, Petsko GA (Mar 2006). "Structural basis for conformational plasticity of the Parkinson's disease-associated ubiquitin hydrolase UCH-L1". Proceedings of the National Academy of Sciences of the United States of America. 103 (12): 4675–80. Bibcode:2006PNAS..103.4675D. doi:10.1073/pnas.0510403103. PMC 1450230. PMID 16537382.
- ^ Liu Y, Lashuel HA, Choi S, Xing X, Case A, Ni J, Yeh LA, Cuny GD, Stein RL, Lansbury PT (Sep 2003). "Discovery of inhibitors that elucidate the role of UCH-L1 activity in the H1299 lung cancer cell line". Chemistry & Biology. 10 (9): 837–46. doi:10.1016/j.chembiol.2003.08.010. PMID 14522054.
- ^ Hussain S, Foreman O, Perkins SL, Witzig TE, Miles RR, van Deursen J, Galardy PJ (Sep 2010). "The de-ubiquitinase UCH-L1 is an oncogene that drives the development of lymphoma in vivo by deregulating PHLPP1 and Akt signaling". Leukemia. 24 (9): 1641–55. doi:10.1038/leu.2010.138. PMC 3236611. PMID 20574456.
- ^ Meyer-Schwesinger C, Meyer TN, Münster S, Klug P, Saleem M, Helmchen U, Stahl RA (Feb 2009). "A new role for the neuronal ubiquitin C-terminal hydrolase-L1 (UCH-L1) in podocyte process formation and podocyte injury in human glomerulopathies". The Journal of Pathology. 217 (3): 452–64. doi:10.1002/path.2446. PMID 18985619. S2CID 23851206.
- ^ Lohmann F, Sachs M, Meyer TN, Sievert H, Lindenmeyer MT, Wiech T, Cohen CD, Balabanov S, Stahl RA, Meyer-Schwesinger C (Jul 2014). "UCH-L1 induces podocyte hypertrophy in membranous nephropathy by protein accumulation". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1842 (7): 945–58. doi:10.1016/j.bbadis.2014.02.011. PMID 24583340.
- ^ Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (Oct 1998). "The ubiquitin pathway in Parkinson's disease". Nature. 395 (6701): 451–2. Bibcode:1998Natur.395..451L. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- ^ Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (Jul 1999). "The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease". Neuroscience Letters. 270 (1): 1–4. doi:10.1016/s0304-3940(99)00465-6. PMID 10454131. S2CID 26352360.
- ^ Wang J, Zhao CY, Si YM, Liu ZL, Chen B, Yu L (Jul 2002). "ACT and UCH-L1 polymorphisms in Parkinson's disease and age of onset". Movement Disorders. 17 (4): 767–71. doi:10.1002/mds.10179. PMID 12210873. S2CID 23026015.
- ^ Kyratzi E, Pavlaki M, Stefanis L (Jul 2008). "The S18Y polymorphic variant of UCH-L1 confers an antioxidant function to neuronal cells". Human Molecular Genetics. 17 (14): 2160–71. doi:10.1093/hmg/ddn115. PMID 18411255.
- ^ Gong B, Cao Z, Zheng P, Vitolo OV, Liu S, Staniszewski A, Moolman D, Zhang H, Shelanski M, Arancio O (Aug 2006). "Ubiquitin hydrolase Uch-L1 rescues beta-amyloid-induced decreases in synaptic function and contextual memory". Cell. 126 (4): 775–88. doi:10.1016/j.cell.2006.06.046. PMID 16923396. S2CID 10916274.
- ^ Chu KY, Li H, Wada K, Johnson JD (Jan 2012). "Ubiquitin C-terminal hydrolase L1 is required for pancreatic beta cell survival and function in lipotoxic conditions". Diabetologia. 55 (1): 128–40. doi:10.1007/s00125-011-2323-1. PMID 22038515.
- ^ Bilguvar K, Tyagi NK, Ozkara C, Tuysuz B, Bakircioglu M, Choi M, Delil S, Caglayan AO, Baranoski JF, Erturk O, Yalcinkaya C, Karacorlu M, Dincer A, Johnson MH, Mane S, Chandra SS, Louvi A, Boggon TJ, Lifton RP, Horwich AL, Gunel M (Feb 2013). "Recessive loss of function of the neuronal ubiquitin hydrolase UCHL1 leads to early-onset progressive neurodegeneration". Proceedings of the National Academy of Sciences of the United States of America. 110 (9): 3489–94. Bibcode:2013PNAS..110.3489B. doi:10.1073/pnas.1222732110. PMC 3587195. PMID 23359680.
- ^ Caballero OL, Resto V, Patturajan M, Meerzaman D, Guo MZ, Engles J, Yochem R, Ratovitski E, Sidransky D, Jen J (maj 2002). "Interaction and colocalization of PGP9.5 with JAB1 and p27(Kip1)". Oncogene. 21 (19): 3003–10. doi:10.1038/sj.onc.1205390. PMID 12082530.
- ^ McKeon JE, Sha D, Li L, Chin LS (maj 2015). "Parkin-mediated K63-polyubiquitination targets ubiquitin C-terminal hydrolase L1 for degradation by the autophagy-lysosome system". Cellular and Molecular Life Sciences. 72 (9): 1811–24. doi:10.1007/s00018-014-1781-2. PMC 4395523. PMID 25403879.
Dopunska literatura
uredi- Healy DG, Abou-Sleiman PM, Wood NW (Oct 2004). "Genetic causes of Parkinson's disease: UCHL-1". Cell and Tissue Research. 318 (1): 189–94. doi:10.1007/s00441-004-0917-3. PMID 15221445. S2CID 22530636.
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (Dec 1992). "Microsequences of 145 proteins recorded in the two-dimensional gel protein database of normal human epidermal keratinocytes". Electrophoresis. 13 (12): 960–9. doi:10.1002/elps.11501301199. PMID 1286667. S2CID 41855774.
- Edwards YH, Fox MF, Povey S, Hinks LJ, Thompson RJ, Day IN (Oct 1991). "The gene for human neurone specific ubiquitin C-terminal hydrolase (UCHL1, PGP9.5) maps to chromosome 4p14". Annals of Human Genetics. 55 (Pt 4): 273–8. doi:10.1111/j.1469-1809.1991.tb00853.x. PMID 1840236. S2CID 25763146.
- Honoré B, Rasmussen HH, Vandekerckhove J, Celis JE (Mar 1991). "Neuronal protein gene product 9.5 (IEF SSP 6104) is expressed in cultured human MRC-5 fibroblasts of normal origin and is strongly down-regulated in their SV40 transformed counterparts". FEBS Letters. 280 (2): 235–40. doi:10.1016/0014-5793(91)80300-R. PMID 1849484. S2CID 40473683.
- Day IN, Hinks LJ, Thompson RJ (Jun 1990). "The structure of the human gene encoding protein gene product 9.5 (PGP9.5), a neuron-specific ubiquitin C-terminal hydrolase". The Biochemical Journal. 268 (2): 521–4. doi:10.1042/bj2680521. PMC 1131465. PMID 2163617.
- Day IN, Thompson RJ (Jan 1987). "Molecular cloning of cDNA coding for human PGP 9.5 protein. A novel cytoplasmic marker for neurones and neuroendocrine cells". FEBS Letters. 210 (2): 157–60. doi:10.1016/0014-5793(87)81327-3. PMID 2947814. S2CID 39218297.
- Doran JF, Jackson P, Kynoch PA, Thompson RJ (Jun 1983). "Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis". Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- Onno M, Nakamura T, Mariage-Samson R, Hillova J, Hill M (Mar 1993). "Human TRE17 oncogene is generated from a family of homologous polymorphic sequences by single-base changes". DNA and Cell Biology. 12 (2): 107–18. doi:10.1089/dna.1993.12.107. PMID 8471161.
- Larsen CN, Price JS, Wilkinson KD (maj 1996). "Substrate binding and catalysis by ubiquitin C-terminal hydrolases: identification of two active site residues". Biochemistry. 35 (21): 6735–44. doi:10.1021/bi960099f. PMID 8639624.
- Best CL, Pudney J, Welch WR, Burger N, Hill JA (Apr 1996). "Localization and characterization of white blood cell populations within the human ovary throughout the menstrual cycle and menopause". Human Reproduction. 11 (4): 790–7. doi:10.1093/oxfordjournals.humrep.a019256. PMID 8671330.
- D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, Corbellini L, Falvo L, Santoni F, Spyrou M, De Antoni E (Oct 1997). "The immunolocalization of PGP 9.5 in normal human kidney and renal cell carcinoma". Il Giornale di Chirurgia. 18 (10): 521–4. PMID 9435142.
- Larsen CN, Krantz BA, Wilkinson KD (Mar 1998). "Substrate specificity of deubiquitinating enzymes: ubiquitin C-terminal hydrolases". Biochemistry. 37 (10): 3358–68. doi:10.1021/bi972274d. PMID 9521656.
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (Oct 1998). "The ubiquitin pathway in Parkinson's disease". Nature. 395 (6701): 451–2. Bibcode:1998Natur.395..451L. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- Wada H, Kito K, Caskey LS, Yeh ET, Kamitani T (Oct 1998). "Cleavage of the C-terminus of NEDD8 by UCH-L3". Biochemical and Biophysical Research Communications. 251 (3): 688–92. doi:10.1006/bbrc.1998.9532. PMID 9790970.
- Leroy E, Boyer R, Polymeropoulos MH (Dec 1998). "Intron-exon structure of ubiquitin c-terminal hydrolase-L1". DNA Research. 5 (6): 397–400. doi:10.1093/dnares/5.6.397. PMID 10048490.
- Lincoln S, Vaughan J, Wood N, Baker M, Adamson J, Gwinn-Hardy K, Lynch T, Hardy J, Farrer M (Feb 1999). "Low frequency of pathogenic mutations in the ubiquitin carboxy-terminal hydrolase gene in familial Parkinson's disease". NeuroReport. 10 (2): 427–9. doi:10.1097/00001756-199902050-00040. PMID 10203348.
- Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (Jul 1999). "The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease". Neuroscience Letters. 270 (1): 1–4. doi:10.1016/S0304-3940(99)00465-6. PMID 10454131. S2CID 26352360.
- Saigoh K, Wang YL, Suh JG, Yamanishi T, Sakai Y, Kiyosawa H, Harada T, Ichihara N, Wakana S, Kikuchi T, Wada K (Sep 1999). "Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice". Nature Genetics. 23 (1): 47–51. doi:10.1038/12647. PMID 10471497. S2CID 34253163.
- Mellick GD, Silburn PA (Oct 2000). "The ubiquitin carboxy-terminal hydrolase-L1 gene S18Y polymorphism does not confer protection against idiopathic Parkinson's disease". Neuroscience Letters. 293 (2): 127–30. doi:10.1016/S0304-3940(00)01510-X. PMID 11027850. S2CID 25234210.
- Sharma N, McLean PJ, Kawamata H, Irizarry MC, Hyman BT (Oct 2001). "Alpha-synuclein has an altered conformation and shows a tight intermolecular interaction with ubiquitin in Lewy bodies". Acta Neuropathologica. 102 (4): 329–34. doi:10.1007/s004010100369. PMID 11603807. S2CID 33892290.
Vanjski linkovi
uredi- Ubiquitin Carboxy-Terminal Hydrolase na US National Library of Medicine Medical Subject Headings (MeSH)
- P09936