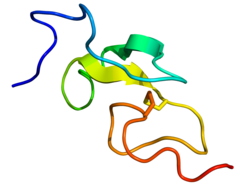
EGF
Epidermni faktor rasta (EGF) jest protein koji je kod ljudi kodiran genom sa hromosoma 4. Stimulira ćelijski rast i diferencijaciju vezivanjem za svoj receptor, EGFR[5] i ima 53 aminokiselinska ostatka i tri unutarmolekulske disulfidne veze.[6]
EGF je prvobitno opisan kao izlučeni peptid koji se nalazi u submaksilskim žlijezdama miševa i u ljudskom urinu. EGF je od tada pronađen u mnogim ljudskim tkivima, uključujući submandibulsku žlijezdu (submaksillska žlijezda),[7] i paratidnim žlijezdama.[7] U početku, ljudski EGF bio poznat kao urogastron.[8]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 1.207 aminokiselina, а molekulska težina 133.994 Da.[9]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MLLTLIILLP | VVSKFSFVSL | SAPQHWSCPE | GTLAGNGNST | CVGPAPFLIF | ||||
| SHGNSIFRID | TEGTNYEQLV | VDAGVSVIMD | FHYNEKRIYW | VDLERQLLQR | ||||
| VFLNGSRQER | VCNIEKNVSG | MAINWINEEV | IWSNQQEGII | TVTDMKGNNS | ||||
| HILLSALKYP | ANVAVDPVER | FIFWSSEVAG | SLYRADLDGV | GVKALLETSE | ||||
| KITAVSLDVL | DKRLFWIQYN | REGSNSLICS | CDYDGGSVHI | SKHPTQHNLF | ||||
| AMSLFGDRIF | YSTWKMKTIW | IANKHTGKDM | VRINLHSSFV | PLGELKVVHP | ||||
| LAQPKAEDDT | WEPEQKLCKL | RKGNCSSTVC | GQDLQSHLCM | CAEGYALSRD | ||||
| RKYCEDVNEC | AFWNHGCTLG | CKNTPGSYYC | TCPVGFVLLP | DGKRCHQLVS | ||||
| CPRNVSECSH | DCVLTSEGPL | CFCPEGSVLE | RDGKTCSGCS | SPDNGGCSQL | ||||
| CVPLSPVSWE | CDCFPGYDLQ | LDEKSCAASG | PQPFLLFANS | QDIRHMHFDG | ||||
| TDYGTLLSQQ | MGMVYALDHD | PVENKIYFAH | TALKWIERAN | MDGSQRERLI | ||||
| EEGVDVPEGL | AVDWIGRRFY | WTDRGKSLIG | RSDLNGKRSK | IITKENISQP | ||||
| RGIAVHPMAK | RLFWTDTGIN | PRIESSSLQG | LGRLVIASSD | LIWPSGITID | ||||
| FLTDKLYWCD | AKQSVIEMAN | LDGSKRRRLT | QNDVGHPFAV | AVFEDYVWFS | ||||
| DWAMPSVMRV | NKRTGKDRVR | LQGSMLKPSS | LVVVHPLAKP | GADPCLYQNG | ||||
| GCEHICKKRL | GTAWCSCREG | FMKASDGKTC | LALDGHQLLA | GGEVDLKNQV | ||||
| TPLDILSKTR | VSEDNITESQ | HMLVAEIMVS | DQDDCAPVGC | SMYARCISEG | ||||
| EDATCQCLKG | FAGDGKLCSD | IDECEMGVPV | CPPASSKCIN | TEGGYVCRCS | ||||
| EGYQGDGIHC | LDIDECQLGE | HSCGENASCT | NTEGGYTCMC | AGRLSEPGLI | ||||
| CPDSTPPPHL | REDDHHYSVR | NSDSECPLSH | DGYCLHDGVC | MYIEALDKYA | ||||
| CNCVVGYIGE | RCQYRDLKWW | ELRHAGHGQQ | QKVIVVAVCV | VVLVMLLLLS | ||||
| LWGAHYYRTQ | KLLSKNPKNP | YEESSRDVRS | RRPADTEDGM | SSCPQPWFVV | ||||
| IKEHQDLKNG | GQPVAGEDGQ | AADGSMQPTS | WRQEPQLCGM | GTEQGCWIPV | ||||
| SSDKGSCPQV | MERSFHMPSY | GTQTLEGGVE | KPHSLLSANP | LWQQRALDPP | ||||
| HQMELTQ |
Struktura
urediKod ljudi, EGF ima 53 aminokiseline (sekvenca NSDSECPLSHDGYCLHDGVCMYIEALDKYACNCVVGYIGERCQYRDLKWWELR),[6] i molekulsku masu od oko 6 kDa.[5] Sadrži tri disulfidna mosta (Cys6-Cys20, Cys14-Cys31, Cys33-Cys42).[6]
Funkcija
urediEGF, putem vezivanja za njegovih srodnih receptora, rezultira ćelijskom proliferacijom, diferencijacijom i preživljavanjem.[10]
EGF pljuvačke, za koji se čini da se regulira neorganski jod u ishrani, također ima važnu fiziološku ulogu u održavanju integriteta oro-ezofagnog i želudačnog tkiva. Biološki efekti EGF-a pljuvačke uključuju zacjeljivanje usnih i gastrojednjačkih ulkusa, inhibiciju lučenja želučane kiseline, stimulaciju sinteze DNK, kao i zaštitu sluznica od unutarlumenskih štetnih faktora kao što su želučana kiselina, žučne kiseline, pepsin i tripsin te fizičkih, kemijskih i bakterijskih agenasa.[7]
Biološki izvori
urediFaktor epidermnog rasta može se naći u urinu, pljuvački, mlijeku, suzama i krvnoj plazmi.[11] Može se naći poddonjevuličnoj žlijezdi,[7][12] i parotidnoj žlijezdi.[7][12] Utvrđeno je da je proizvodnja EGF-a stimulirana testosteronomom.
Polipeptidni faktori rasta
urediPolipeptidni faktori rasta uključuju:[13]
| Broj sekretora | Faktor rasta | Izvor | Glavna funkcija |
|---|---|---|---|
| 1 | Epidermnifaktor tasta (EGF) | Pjuvačne žlijezde | Stimulira rast epidermnih i epitelnih ćelija |
| 2 | Trombocitni faktor rasta | Trombociti | Stimulira rast mezenhimskih ćelija, pospešuje zarastanje rana |
| 3 | Transformirajući faktor rasta alfa | Epitelne ćelije | Sličan EGF-u |
| 4 | Transformirajući faktor rasta beta | Trombociti, bubrezi, placenta | Inhibitorni efekt na kulture tumorskih ćelija |
| 5 | Eritropoetin | Bubrezi | Stimulira razvoj eritropoetskih ćelija |
| 6 | Nervni faktor rasta (NGF) | Pljuvačne žlijezde | Stimulira rast senzornih nerava |
| 7 | Insulinoliki faktor rasta growth | Serum | Stimulira ugradnju sulfata u hrskavicu, na određene ćelije djeluje slično insulinu |
| 8 | Faktor tumorske nekroze | Monociti | Nekroza tumorskih ćelija |
| 9 | Interleukin-1 | Monociti, Leukociti | Stimulira sintezu interleukina IL-2 |
| 10 | Interleukin-2 | Limfociti | Stimulira rast i sazrijevanje T-ćelija |
Mehanizam
urediEGF djeluje tako što se vezuje sa visokim afinitetom za receptor epidermnog faktora rasta (EGFR) na površini ćelije. Ovo stimulira dimerizaciju izazvanu ligandom,[14] pokrećući unutrašnje aktivnosti receptora protein-tirozin kinaze (vidi drugi dijagram). Aktivnost tirozin-kinaza, zauzvrat, pokreće transdukciju signala, kaskadu koja rezultira raznim biohemijskim promjenama unutar ćelije – porastom unutarćelijskih nivoa kalcija, glikolize, sinteze proteina i povećanjem ekspresije određenih gena, uključujući gen za EGFR – što na kraju dovodi do sinteze DNK i proliferacije ćelija.[15]
EGF-porodica/EGF-liki domen
urediEGF je osnivač EGF-porodice proteina. Članovi ove porodice proteina imaju vrlo slične strukturne i funkcionalne karakteristike. Osim samog EGF-a, tu su i drugi članovi porodice:[16]
- Faktor rasta sličan EGF-u koji veže heparin (HB-EGF)
- Transformirajući faktor rasta-α (TGF-α)
- Amfiregulin (AR)
- Epiregulin (EPR)
- Epigen
- Betacelulin (BTC)
- Neuregulin-1 (NRG1)
- Neuregulin-2 (NRG2)
- Neuregulin-3 (NRG3)
- Neuregulin-4 (NRG4).
Svi članovi porodice sadrže po jedno ili više ponavljanja konzervirane aminokiselinske sekvence: CX7CX4-5CX10-13CXCX8GXRC
- C – cistein, G – glicin, R – arginin i X – bilo koja aminokiselina.[16]
Ova sekvenca sadrži šest cisteinskih ostataka koji formiraju tri intramolekulske disulfidne veze. Formiranje disulfidne veze stvara tri strukturne petlje koje su neophodne za vezivanje visokog afiniteta između članova porodice EGF i njihovih površinskih receptora.[5]
Interakcije
urediPokazalo se da epidermni faktor rasta ima interakcije sa svojim receptorom.[17][18]
Medicinska upotreba
urediRekombinantni ljudski epidermni faktor rasta, koji se prodaje pod robnom markom Heberprot-P, koristi se za liječenje čireva na dijabetičkom stopalu. Može se dati injekcijom u mjesto rane,[19] ili se može koristiti lokalno.[20] Probni dokazi pokazuju poboljšano zacjeljivanje rana.[21] Sigurnost je slabo proučena.[21]
EGF se koristi za modifikaciju sintetskih skela za proizvodnju bioinženjerstvenih transplantata emulzijskomom elektroporaciom ili metodima modifikacije površine.[22][23]
Regeneracija kostiju
urediEGF ima pojačanu ulogu u osteogenoj diferencijaciji matičnim ćelijama zubne pulpe (DPSC) jer je sposoban povećati mineralizaciju vanćelijskog matriksa. Niska koncentracija EGF-a (10 ng/ml) dovoljna je da izazove morfološke i druge fenotipske promjene. Ovi podaci sugeriraju da bi DPSC u kombinaciji sa EGF-om mogli biti efikasna terapija zasnovana na matičnim ćelijama za koštano tkivo i inženjerskoj primjeni u parodentologiji i oralnoj implantologiji.[24]
Historija
urediEGF je bio drugi faktor rasta koji je identificiran.[25] Initially, human EGF was known as urogastrone.[8] Stanly Cohen je otkrio EGF dok je radio sa Ritom Levi-Montalcini na Washington University in St. Louis, tokom eksperimenata istraživanja nervnog faktora rastafaktora rasta (NGF). Za ova otkrića Levi-Montalcini i Cohen su 1986. dobili Nobelovu nagradu za fiziologiju ili medicinu.
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000138798 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000028017 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c Harris RC, Chung E, Coffey RJ (mart 2003). "EGF receptor ligands". Experimental Cell Research. 284 (1): 2–13. doi:10.1016/S0014-4827(02)00105-2. PMID 12648462.
- ^ a b c Carpenter G, Cohen S (maj 1990). "Epidermal growth factor". The Journal of Biological Chemistry. 265 (14): 7709–12. doi:10.1016/S0021-9258(19)38983-5. PMID 2186024. Arhivirano s originala, 5. 11. 2008. Pristupljeno 28. 10. 2021.
- ^ a b c d e Venturi S, Venturi M (2009). "Iodine in evolution of salivary glands and in oral health". Nutrition and Health. 20 (2): 119–34. doi:10.1177/026010600902000204. PMID 19835108. S2CID 25710052.
- ^ a b Hollenberg MD, Gregory H (maj 1980). "Epidermal growth factor-urogastrone: biological activity and receptor binding of derivatives". Molecular Pharmacology. 17 (3): 314–20. PMID 6248761.
- ^ "UniProt, P01133" (jezik: engleski). Pristupljeno 28. 10. 2021.
- ^ Herbst RS (2004). "Review of epidermal growth factor receptor biology". International Journal of Radiation Oncology, Biology, Physics. 59 (2 Suppl): 21–6. doi:10.1016/j.ijrobp.2003.11.041. PMID 15142631.
- ^ Kumar V, Abbas AK, Fausto N, Robbins SL, Cotran RS (2005). Robbins and Cotran pathologic basis of disease (7th izd.). St. Louis, Mo: Elsevier Saunders. ISBN 978-0-7216-0187-8.
- ^ a b Chao J (1. 1. 2013), Rawlings ND, Salvesen G (ured.), "Chapter 624 - Mouse Kallikrein 9, Epidermal Growth Factor-binding Protein", Handbook of Proteolytic Enzymes (Third izd.), Academic Press, str. 2830–2831, doi:10.1016/b978-0-12-382219-2.00624-4, ISBN 978-0-12-382219-2
- ^ Satyanarayana U (2002). Biochemistry (2nd izd.). Kolkata, India: Books and Allied. ISBN 8187134801. OCLC 71209231.
- ^ Dawson JP, Berger MB, Lin CC, Schlessinger J, Lemmon MA, Ferguson KM (septembar 2005). "Epidermal growth factor receptor dimerization and activation require ligand-induced conformational changes in the dimer interface". Molecular and Cellular Biology. 25 (17): 7734–42. doi:10.1128/MCB.25.17.7734-7742.2005. PMC 1190273. PMID 16107719.
- ^ Fallon JH, Seroogy KB, Loughlin SE, Morrison RS, Bradshaw RA, Knaver DJ, Cunningham DD (juni 1984). "Epidermal growth factor immunoreactive material in the central nervous system: location and development". Science. 224 (4653): 1107–9. doi:10.1126/science.6144184. PMID 6144184.
- ^ a b Dreux AC, Lamb DJ, Modjtahedi H, Ferns GA (maj 2006). "The epidermal growth factor receptors and their family of ligands: their putative role in atherogenesis". Atherosclerosis. 186 (1): 38–53. doi:10.1016/j.atherosclerosis.2005.06.038. PMID 16076471.
- ^ Stortelers C, Souriau C, van Liempt E, van de Poll ML, van Zoelen EJ (juli 2002). "Role of the N-terminus of epidermal growth factor in ErbB-2/ErbB-3 binding studied by phage display". Biochemistry. 41 (27): 8732–41. doi:10.1021/bi025878c. PMID 12093292.
- ^ Wong L, Deb TB, Thompson SA, Wells A, Johnson GR (mart 1999). "A differential requirement for the COOH-terminal region of the epidermal growth factor (EGF) receptor in amphiregulin and EGF mitogenic signaling". The Journal of Biological Chemistry. 274 (13): 8900–9. doi:10.1074/jbc.274.13.8900. PMID 10085134.
- ^ Berlanga J, Fernández JI, López E, López PA, del Río A, Valenzuela C, Baldomero J, Muzio V, Raíces M, Silva R, Acevedo BE, Herrera L (januar 2013). "Heberprot-P: a novel product for treating advanced diabetic foot ulcer". MEDICC Review. 15 (1): 11–5. doi:10.1590/s1555-79602013000100004. PMID 23396236.
- ^ Yang S, Geng Z, Ma K, Sun X, Fu X (juni 2016). "Efficacy of Topical Recombinant Human Epidermal Growth Factor for Treatment of Diabetic Foot Ulcer: A Systematic Review and Meta-Analysis". The International Journal of Lower Extremity Wounds. 15 (2): 120–5. doi:10.1177/1534734616645444. PMID 27151755. S2CID 43897291.
- ^ a b Martí-Carvajal AJ, Gluud C, Nicola S, Simancas-Racines D, Reveiz L, Oliva P, Cedeño-Taborda J (oktobar 2015). "Growth factors for treating diabetic foot ulcers". The Cochrane Database of Systematic Reviews. 10 (10): CD008548. doi:10.1002/14651858.CD008548.pub2. PMID 26509249.
- ^ Haddad T, Noel S, Liberelle B, El Ayoubi R, Ajji A, De Crescenzo G (januar 2016). "Fabrication and surface modification of poly lactic acid (PLA) scaffolds with epidermal growth factor for neural tissue engineering". Biomatter. 6 (1): e1231276. doi:10.1080/21592535.2016.1231276. PMC 5098722. PMID 27740881.
- ^ Tenchurin T, Lyundup A, Demchenko A, Krasheninnikov M, Balyasin M, Klabukov I, Shepelev AD, Mamagulashvili VG, Orehov AS (2017). "Modification of biodegradable fibrous scaffolds with Epidermal Growth Factor by emulsion electrospinning for promotion of epithelial cells proliferation". Гены и клетки (jezik: ruski). 12 (4): 47–52. doi:10.23868/201707029.
- ^ Del Angel-Mosqueda C, Gutiérrez-Puente Y, López-Lozano AP, Romero-Zavaleta RE, Mendiola-Jiménez A, Medina-De la Garza CE, Márquez-M M, De la Garza-Ramos MA (septembar 2015). "Epidermal growth factor enhances osteogenic differentiation of dental pulp stem cells in vitro". Head & Face Medicine. 11: 29. doi:10.1186/s13005-015-0086-5. PMC 4558932. PMID 26334535.
- ^ JC (1. 1. 2006). "Epidermal growth factors". u Laurent GJ, Shapiro SD (ured.). Encyclopedia of Respiratory Medicine (jezik: engleski). Oxford: Academic Press. str. 129–133. doi:10.1016/b0-12-370879-6/00138-1. ISBN 978-0-12-370879-3. Pristupljeno 30. 11. 2020. Parametar
|title=nedostaje ili je prazan (pomoć)
Dopunska literatura
uredi- Boonstra J, Rijken P, Humbel B, Cremers F, Verkleij A, van Bergen en Henegouwen P (maj 1995). "The epidermal growth factor". Cell Biology International. 19 (5): 413–30. doi:10.1006/cbir.1995.1086. PMID 7640657. S2CID 20186286.
- Dvorak B (mart 2004). "Epidermal growth factor and necrotizing enterocolitis". Clinics in Perinatology. 31 (1): 183–92. doi:10.1016/j.clp.2004.03.015. PMID 15183666.
- Howell WM (oktobar 2004). "Epidermal growth factor gene polymorphism and development of cutaneous melanoma". The Journal of Investigative Dermatology. 123 (4): xx–xxi. doi:10.1111/j.0022-202X.2004.23308.x. PMID 15373802.
Vanjski linkovi
uredi- Shaanxi Zhongbang Pharma-Tech Co., Ltd.-Supply of Epidermal Growth Factor
- EGF at the Human Protein Reference Database Arhivirano 3. 5. 2005. na Wayback Machine.
- Epidermal growth factor na US National Library of Medicine Medical Subject Headings (MeSH)
- EGF model in BioModels database