Hromatidno nerazdvajanje
Nerazdvajanje, poznto i kao nedisjunkcija, je neuspjeh homolognih hromosoma ili sestrinskih hromatida da se pravilno razdvoje tokom ćelijske diobe. Postoje tri oblika nedisjunkcije: neuspjeh odvajanja para homolognih hromozomau mejozi I, neuspjeh odvajanja sestrinskih hromatida tokom mejoze II i odvajanje sestrinskih hromatida tokom mitoze.[1][2][3] Nedisjunkcija rezultira kćerkama sa abnormalnim brojem hromozoma (aneuploidijama).
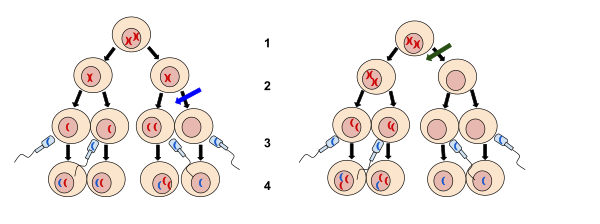
2. Mejoza II
3. Oplodnja
4. Zigot
Lijeva slika na plavoj strelici nema razdvajanja tokom mejoze II. Desna slika kod zelene strelice je nedisjunkcija koja se odvija tokom mejoze I. Nedisunkcija je kada se hromosomi ne uspiju normalno odvojiti što rezultira dobitkom ili gubitkom hromosoma.
Calvin Bridges i Thomas Hunt Morgan zaslužni su za otkrivanje nedisunkcije u Drosophila melanogaster na spolnim hromosomima u proljeće 1910., dok su radili u zoološkoj laboratoriji Univerziteta Columbia.[4]
Tipovi
urediOpćenito, nedisunkcija se može dogoditi u bilo kojem obliku diobe ćelija koji uključuje uređenu raspodjelu hromosomskog materijala. Više životinje imaju tri različita oblika takvih ćelijskih dioba: Mejoza I i mejoza II su specijalizirani oblici ćelijske diobe koji se javljaju tokom stvaranja gameta (jaja i sperme) za spolnu reprodukciju, mitoza je oblik ćelijske diobe u svim ostalim tjelesnim ćelijama.
Mejoza II
urediOvulirana jajašca zastaju u metafazi II sve dok oplodnja ne pokrene drugu mejotsku diobu.[5] Slično događajima separacije u mitozi, parovi sestrinskih hromatida koji nastaju razdvajanjem bivalenata u mejozi I dalje su odvojeni u anafazi mejoze II . U oocitima je jedna sestrinska hromatida odvojena u drugo polarno tijelo, dok druga ostaje unutar jajašca. Tokom spermatogeneze, svaka mejotska podjela je simetrična tako da svaki primarni spermatocit daje dva sekundarna spermatocita nakon mejoze I, a na kraju četiri spermatide nakon mejoze II.
Nedisjunkcija mejoze II može također rezultirati sindromima aneuploidije, ali samo u mnogo manjoj mjeri od neuspjeha segregacija u mejozi I.[6]
Lijevo: Metafaza mitoze: hromosomi se nižu u srednjoj (ekvatorskoj) ravni, formira se mitotsko vreteno i kinetohori sestrinskih hromatida pričvršćuju na mikrotubule.
Desno: Anafaza mitoze, gdje se sestrinske hromatide odvajaju, a mikrotubule vuku u suprotnim smjerovima.
Hromosom prikazan u crvenoj boji ne uspijeva se pravilno odvojiti, njegove sestrinske hromatide se lijepe i povlače na istu stranu, što rezultira mitotskom nedisunkcijom ovog hromosoma.
Mitoza
urediPodjeli somatskih ćelija mitozom prethodi replikacija genetičkog materijala u S-fazi. Kao rezultat toga, svaki se hromosom sastoji od dvije sestrinske hromatide koje se drže zajedno u centromeri. U anafazi mitoze, sestrinske hromatide se odvajaju i migriraju na suprotne polove ćelija prije nego što se ćelija podijeli. Nedisjunkcija tokom mitoze dovodi do toga da jedna kćerka ćelija dobije obje sestrinske hromatide zahvaćenog hromosoma, dok druga ne dobije nijednu. To je poznato kao hromatinski most ili anafazni most.
Mitotska nedisjunkcija rezultira somatskim mozaicizmom, jer će samo ćerke ćelije poreklom iz ćelije u kojoj se dogodila nedisjunkcije imati abnormalan broj hromosoma.[3] Nedisjunkcija tokom mitoze može doprinijeti razvoju nekih oblika karcinoma, npr retinoblastoma (vidi dolje) Hromosomska nedisunkcija u mitozi može se pripisati inaktivaciji topoizomeraze II, kondenzina ili separaza.[7]
Mejotska nedisunkcija dobro je proučavana u Saccharomyces cerevisiae. Ovaj kvasac prolazi kroz mitozu slično kao I ostali eukarioti. Hromosomski mostovi nastaju kada se sestrinske hromatide drže zajedno nakon replikacije DNK-DNK topološkim zapetljavanjem i kohezijom kompleksa.[8] Tokom anafaze, kohezin se cijepa separazom.[9] Topoizomeraza II i kondenzin odgovorni su za uklanjanje katenacija .[10]
Molekulski mehanizmi
urediCentralna uloga kontrolne tačke vretenskog sklopa
urediKontrolna tačka vretenskog sklopa (SAC) je molekulski zaštitni mehanizam koji upravlja ispravnom segregacijom hromozoma u eukariotskim ćelijama.[11] SAC inhibira napredovanje u anafazu, sve dok se svi homologni hromosomi (bivalenti ili tetrade) ne poravnaju pravilno sa vretenski aparat. Tek tada, SAC prekida inhibiciju kompleksa za promociju anafaze (APC), što zauzvrat nepovratno pokreće napredovanje kroz anafazu.
Spolno specifične razlike u mejozi
urediIspitivanja slučajeva sindroma aneuploidije kod ljudi pokazala su da većina njih potiče od majke.[5] To postavlja pitanje: zašto je mejoza u žena sklonija greškama? Najočitija razlika između oogeneze i spermatogeneze je dugotrajno zaustavljanje oocita u kasnim fazama profaze I tokom mnogih godina do nekoliko decenija. Muške spolne ćelije, s druge strane, brzo prolaze kroz sve faze mejoze I i II. Druga važna razlika između mejoze muškaraca i žena odnosi se na učestalost rekombinacije homolognih hromosoma: u mužjaka se gotovo svim parovima hromosoma pridružuje barem jedan hromosomski krosingover, dok više od 10% oocita sadrži najmanje jedan bivalent bez ikakvog unakrsnog događaja. Neuspjesi rekombinacije ili neprimjereno locirani krosingoveri dobro su dokumentirani kao doprinos nastanku nedisunkcije kod ljudi.[5]
Starosni gubitak kohezinskih veza
urediZbog dugotrajnog zaustavljanja ljudskih oocita, slabljenje kohezivnih veza koje drže hromosome i smanjena aktivnost SAC-a mogu doprinijeti majčinskim greškama u kontroli u segregacija.[12] Kompleks kohezina odgovoran je za održavanje sestrinskih kromatida zajedno i pruža mjesta vezanja za pričvršćivanje vretena. Kohezin se učitava na novoreplicirane hromosome u oogoniji tokom fetusog razvoja. Zreli oociti imaju samo ograničeni kapacitet za ponovno punjenje kohezina nakon završetka S-faza. Produženo zaustaljanje ljudskih oocita prije završetka mejoze I može s vremenom rezultirati značajnim gubitkom kohezina. Pretpostavlja se da gubitak kohezina doprinosi pogrešnom vezanju mikrotubula – kinetohora i greškama segregacije hromosoma tokom mejotskih dioba.
Posljedice
urediPosljedica ove greške je ćelija sa neravnotežom hromosoma. Za takvu ćeliju se kaže da je aneuploid. Gubitak jednog hromosoma (2n-1), u kojem će ćerki (kćerkama) s defektom nedostajati jedan hromosom u jednom od njegovih parova, naziva se monosomija. Dobijanje jednog hromosoma, u kojem će ćerka/e sa defektom, pored parova, imati i jedan hromosom viška, naziva se trisomija.[3] U slučaju da se aneuploidni gamet oplodi, mogu nastati brojni sindromi.
Monosomija
urediJedina poznata preživjela monosomija kod ljudi je Turnerov sindrom, gdje je pogođena osoba monosomna za hromosom X (vidi dolje). Ostale monosomije su obično smrtonosne, već tokom ranog razvoja fetusa, a preživljavanje je moguće samo ako nisu pogođene sve tijesne ćelije u slučaju mozaicizama (vidi dolje) ili ako se dupliranjem obnovi normalan broj hromosoma pojedinačnog monosomskog hromosoma ("spašavanje hromosoma").[2]
Turnerov sindrom (monosomija X) (45, X0)
urediOvo stanje karakterizira prisustvo samo jednog X hromozoma i bez hromosoma Y (vidi donji desni ugao).
Potpuni gubitak čitavog X hromosoma čini oko polovine slučajeva Turnerovog sindroma. Važnost oba hromosoma X tokom embrionskog razvoja podvlači se zapažanjem da je ogromna većina (> 99%) fetusa sa samo jednim X hromosomom (kariotip 45, X0) spontano pobačena.[13]
Trisomija autosoma
urediTermin trisomija autosoma znači da je u tri kopije prisutan hromosom koji nije spolni hromosom X i Y, umjesto u normalnom broju od dva u diploidnim ćelijama.
Downov sindrom (trisomija 21)
urediIUočiti da je hromosom 21 prisutan u tri kopije, dok svi ostali imaju normalno diploidno stanje sa dvije kopije. Većina slučajeva hromozoma uzrokovane trisomije 21. je događaj koji nije povezan sa mejozom I (vidi tekst).
Downov sindrom, trisomija 21. hromosoma, najčešća je anomalija broja hromosoma kod ljudi.[2] Većina slučajeva proizilazi iz nedisunkcije tokom majčine mejoze I.[13] Trisomy occurs in at least 0.3% of newborns and in nearly 25% of spontaneous abortions. It is the leading cause of pregnancy wastage and is the most common known cause of mental retardation.[14] It is well documented that advanced maternal age is associated with greater risk of meiotic nondisjunction leading to Down syndrome. This may be associated with the prolonged meiotic arrest of human oocytes potentially lasting for more than four decades.[12]
Edwardsov sindrom (trisomija 18) i Patauov sindrom (trisomija 13)
urediLjudske trisomije kompatibilne sa živorođenim djetetom, osim Downovog sindroma (trisomija 21), su Edwardsov sindrom (trisomija 18) i Patauov sindrom (trisomija 13).[1][2] Kompletne trisomije drugih hromosoma obično nisu održive i predstavljaju relativno čest uzrok pobačaja. Samo u rijetkim slučajevima mozaicizama, prisustvo normalne ćelijske linije, pored trisomne , može podržati razvoj održive trisomije ostalih hromosoma.[2]
Aneuploidija spolnih hromosoma
urediTermin "aneuploidija spolnih hromosoma" sažima stanja s abnormalnim brojem spolnih hromosoma, tj. koji nisu u paru XX (ženski) ili XY (muški). Formalno, monosomija X hromosoma (Turnerov sindrom, vidi gore) također se može klasificirati kao oblik aneuploidije spolnih hromozoma.
Klinefelterov sindrom (47, XXY)
urediKlinefelterov sindrom najčešća je aneuploidija spolnih hromosoma kod ljudi. Predstavlja najčešći uzrok hipogonadizma i neplodnostI muškaraca. Većina slučajeva su uzrokovani nedisjunkcijskim greškama u očinskoj mejozi I.[2] Otprilike osamdeset posto osoba s ovim sindromom ima višak jednog X hromosoma, što rezultira kariotipom XXY. Preostali slučajevi imaju ili više dodatnih spolnih hromozoma (48, XXXY; 48, XXYY; 49, XXXXY), mozaicizam (46, XY / 47, XXY) ili strukturne abnormalnosti hromosoma.[2]
Muškarac XYY 47, XYY)
urediIncidencija XYY sindroma je približno 1/800-1.000 muških poroda. Mnogi slučajevi ostaju nedijagnosticirani zbog normalnog izgleda i plodnosti te odsustva ozbiljnih simptoma. Dodatni Y hromosom obično je posljedica nedisunkcije tokom očinske mejoze II.[2]
Trisomija X (47,XXX)
urediTrisomija X je oblik aneuploidije spolnih hromosoma, gdje žene imaju tri umjesto dva hromosoma X. Većina pacijenata su samo blago pogođeni neuropsihološkim i fizičkim simptomima. Studije koje su ispitivale porijeklo dodatnog X hromosoma primijetile su da je oko 58-63% slučajeva uzrokovano nedisjunkcijom u majčinoj mejozi I, 16-18% nedisjunkcijom u majčinoj mejozi II, a preostali slučajevi postzigotskom, tj. mitotskom, nedisunkcijom.[15]
Jednoroditeljska disomija
urediJednoroditeljska disomija označava situaciju kada se oba hromosoma datog para hromozoma nasljeđuju od istog roditelja i stoga su identična. Ovaj fenomen je najvjerojatnije posljedica trudnoće koja je započela kao trisomija uslijed nedisunkcije. Budući da je većina trisomija smrtonosna, fetus preživljava samo zato što gubi jedan od tri hromosoma i postaje disoman. Jednoroditeljska disomija hromosoma 15 se, naprimjer, vidi u nekim slučajevima Prader-Willijevog i Angelmanovog sindroma.[13]
Sindromi mozaicizma
urediSindromi mozaicizama mogu biti uzrokovani mitotskom nedisunkcijom u ranom razvoju fetusa. Kao posljedica toga, organizam se razvija kao mješavina ćelijskih linija s različitim ploidijama (brojem hromosoma). Mozaicizam može biti prisutan u nekim tkivima, ali u drugima ne. Pogođene osobe mogu imati neujednačen ili asimetričan izgled. Primjeri sindroma mozaicizma uključuju Pallister-Killianov sindrom i Itoovu hipomelanozu.
Mozaicizam u malignoj transformaciji
urediU prvom slučaju, na supresiju gena tumora na jednom od dva hromosoma utiče mutacija koja genetički proizvod čini nefunkcionalnim. Ona može nastati spontano, kao greška replikacije DNK ili je može izazvati sredstvo koje oštećuje DNK. Drugi sluičajuklanja preostali hromosom divljeg tipa, na primjer putem mitotska nedisunkcije. Postoji nekoliko drugih potencijalnih mehanizama za svaki od dva koraka, naprimjer dodatna mutacija, neuravnotežena translokacija ili delecija gena rekombinacijom. Kao rezultat dvostruke lezije, ćelija može postati zloćudna, jer više nije u stanju eksprimirati proteinski supresor tumora.
Razvoj karcinoma često uključuje višestruke promjene ćelijskog genoma (Knudsonova hipoteza). Ljudski retinoblastom dobro je proučavan primer karcinoma kod kojeg mitotska nedisunkcija može doprinijeti malignoj transformaciji: mogu se mutacije gena RB1 koji se nalazi na hromozomu 13 i kodirati supresor tumora protein retinoblastoma, otkriven citogenetičkom analizom u mnogim slučajevima retinoblastoma. Mutacije lokusa RB1 u jednoj kopiji hromosoma 13 ponekad su praćene gubitkom drugog hromosoma 13divljeg tipa, mitotskom nedisunkcijom. Ovom kombinacijom lezijom zahvaćene čelije potpuno gube ekspresiju funkcionalnog proteina supresora tumora.
Dijagnoza
urediPredimplantacijska genetička dijagnoza
urediPredimplantacijska genetička dijagnoza (PGD ili PIGD) je tehnika koja se koristi za identifikaciju genetički normalnih embriona i korisna je za parove koji imaju porodičnu historiju genetičkih poremećaja. Ovo je opcija za ljude koji se odluče za razmnožavanje putem IVF. PGD se smatra teškim, jer je i dugotrajan i ima stope uspjeha koje se mogu usporediti samo s rutinskom IVF.[16]
Analiza kariotipa
uredianaliza kariotipa, pogrešno zvana i kariotipizacija (kariotip se ne može tipizirati!), uključuje izvođenje amniocenteza radi proučavanja ćelija nerođenog fetusa tokom metafaze 1. Svjetlosna mikroskopija može se koristiti za vizuelno utvrđivanje da li je problem u aneuploidijama.[17]
Dijagnoza polarnog tijela
uredi[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2696746/Dijagnoza polarnog tijela (PBD) može se koristiti za otkrivanje hromosomskih aneuploidija koje potiču od majke, kao i translokacija u oocitima. Prednost PBD-a u odnosu na PGD-a je u tome što se to može postići za kratko vrijeme. To se postiže bušenjem zona ili laserskim bušenjem.[18]
Biopsija blastomera
urediBiopsija blastomera je tehnika kojom se blastomere uklanjaju iz zona pellucida. Obično se koristi za otkrivanje aneuploidije.[19] Genetic analysis is conducted once the procedure is complete. Additional studies are needed to assess the risk associated with the procedure.[20]
Rizici za životnog stila/okoliša
urediIzloženost spermatozoida određenom životnom stilu, životnoj sredini i / ili profesionalnoj opasnosti može povećati rizik od aneuploidije. Dim cigareta poznat je aneugen (inductor aneuploidija). Povezan je s porastom aneuploidije u rasponu od 1,5 do 3,0 puta.[21][22] Ostale studije ukazuju na faktore kao što je konzumacija alkohola,[23] profesionalna izloženost benzenu,[24] i izloženost insekticidima fenvaleratu[25] i karbarilu,[26] koji također povećavaju rizik od aneuploidije.
Reference
uredi- ^ a b Simmons, D. Peter Snustad, Michael J. (2006). Principles of genetics (4th izd.). New York, NY [u.a.]: Wiley. ISBN 9780471699392.
- ^ a b c d e f g h Bacino, C.A.; Lee, B. (2011). "Chapter 76: Cytogenetics". u Kliegman, R.M.; Stanton, B.F.; St. Geme, J.W.; Schor, N.F.; Behrman, R.E. (ured.). Nelson Textbook of Pediatrics, 19th Edition (19th izd.). Philadelphia: Saunders. str. 394–413. ISBN 9781437707557.
- ^ a b c Strachan, Tom; Read, Andrew (2011). Human molecular genetics (4th izd.). New York: Garland Science. ISBN 9780815341499.
- ^ Thomas Hunt Morgan (31. 8. 2012). Sex-Linked Inheritance in Drosophila. Ulan Press. str. 10–11.
- ^ a b c Nagaoka, SI; Hassold, TJ; Hunt, PA (Jun 18, 2012). "Human aneuploidy: mechanisms and new insights into an age-old problem". Nature Reviews Genetics. 13 (7): 493–504. doi:10.1038/nrg3245. PMC 3551553. PMID 22705668.
- ^ Jones, K. T.; Lane, S. I. R. (27. 8. 2013). "Molecular causes of aneuploidy in mammalian eggs". Development. 140 (18): 3719–3730. doi:10.1242/dev.090589. PMID 23981655.
- ^ Quevedo, O; García-Luis, J; Matos-Perdomo, E; Aragón, L; Machín, F (2012). "Nondisjunction of a single chromosome leads to breakage and activation of DNA damage checkpoint in G2". PLOS Genetics. 8 (2): e1002509. doi:10.1371/journal.pgen.1002509. PMC 3280967. PMID 22363215.
- ^ Vaahtokari, A; Aberg, T; Thesleff, I (Jan 1996). "Apoptosis in the developing tooth: association with an embryonic signaling center and suppression by EGF and FGF-4". Development. 122 (1): 121–9. PMID 8565823.
- ^ Banks, P (Feb 1977). "Pulp changes after anterior mandibular subapical osteotomy in a primate model". Journal of Maxillofacial Surgery. 5 (1): 39–48. doi:10.1016/s0301-0503(77)80074-x. PMID 0403247.
- ^ Holm, C; Goto, T; Wang, JC; Botstein, D (Jun 1985). "DNA topoisomerase II is required at the time of mitosis in yeast". Cell. 41 (2): 553–63. doi:10.1016/s0092-8674(85)80028-3. PMID 2985283.
- ^ Sun, S.-C.; Kim, N.-H. (14. 11. 2011). "Spindle assembly checkpoint and its regulators in meiosis". Human Reproduction Update. 18 (1): 60–72. doi:10.1093/humupd/dmr044. PMID 22086113.
- ^ a b Eichenlaub-Ritter, Ursula (2012). "Oocyte ageing and its cellular basis". The International Journal of Developmental Biology. 56 (10–11–12): 841–852. doi:10.1387/ijdb.120141ue. PMID 23417406.
- ^ a b c Gleason, H. William; Taeusch, Roberta A.; Ballard, Christine A., ured. (2005). Avery's diseases of the newborn (8th izd.). Philadelphia, Pa.: W.B. Saunders. ISBN 978-0721693477.
- ^ Koehler, KE; Hawley, RS; Sherman, S; Hassold, T (1996). "Recombination and nondisjunction in humans and flies". Human Molecular Genetics. 5 Spec No: 1495–504. doi:10.1093/hmg/5.Supplement_1.1495. PMID 8875256.
- ^ Tartaglia, NR; Howell, S; Sutherland, A; Wilson, R; Wilson, L (11. 5. 2010). "A review of trisomy X (47,XXX)". Orphanet Journal of Rare Diseases. 5: 8. doi:10.1186/1750-1172-5-8. PMC 2883963. PMID 20459843.
- ^ Harper, JC; Harton G (2010). "The use of arrays in preimplantation genetic diagnosis and screening". Fertil Steril. 94 (4): 1173–1177. doi:10.1016/j.fertnstert.2010.04.064. PMID 20579641.
- ^ "Karyotyping". National Institute of Health. Pristupljeno 7. 5. 2014.
- ^ Montag, M; van der Ven, K; Rösing, B; van der Ven, H (2009). "Polar body biopsy: a viable alternative to preimplantation genetic diagnosis and screening". Reproductive Biomedicine Online. 18 Suppl 1: 6–11. doi:10.1016/s1472-6483(10)60109-5. PMID 19281658.
- ^ Parnes, YM (Mar–Apr 1989). "RCT controversy". Journal of Obstetric, Gynecologic, & Neonatal Nursing. 18 (2): 90. doi:10.1111/j.1552-6909.1989.tb00470.x. PMID 2709181.
- ^ Yu, Y; Zhao, Y; Li, R; Li, L; Zhao, H; Li, M; Sha, J; Zhou, Q; Qiao, J (Dec 6, 2013). "Assessment of the risk of blastomere biopsy during preimplantation genetic diagnosis in a mouse model: reducing female ovary function with an increase in age by proteomics method". Journal of Proteome Research. 12 (12): 5475–86. doi:10.1021/pr400366j. PMID 24156634.
- ^ Shi Q, Ko E, Barclay L, Hoang T, Rademaker A, Martin R (2001). "Cigarette smoking and aneuploidy in human sperm". Mol. Reprod. Dev. 59 (4): 417–21. doi:10.1002/mrd.1048. PMID 11468778.
- ^ Rubes J, Lowe X, Moore D, Perreault S, Slott V, Evenson D, Selevan SG, Wyrobek AJ (1998). "Smoking cigarettes is associated with increased sperm disomy in teenage men". Fertil. Steril. 70 (4): 715–23. doi:10.1016/S0015-0282(98)00261-1. PMID 9797104.
- ^ Benassi-Evans B, Fenech M (2011). "Chronic alcohol exposure induces genome damage measured using the cytokinesis-block micronucleus cytome assay and aneuploidy in human B lymphoblastoid cell lines". Mutagenesis. 26 (3): 421–9. doi:10.1093/mutage/geq110. PMID 21273273.
- ^ McHale CM, Smith MT, Zhang L (2014). "Application of toxicogenomic profiling to evaluate effects of benzene and formaldehyde: from yeast to human". Ann. N. Y. Acad. Sci. 1310: 74–83. doi:10.1111/nyas.12382. PMC 3978411. PMID 24571325.
- ^ Xia Y, Bian Q, Xu L, Cheng S, Song L, Liu J, Wu W, Wang S, Wang X (2004). "Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate". Toxicology. 203 (1–3): 49–60. doi:10.1016/j.tox.2004.05.018. PMID 15363581.
- ^ Xia Y, Cheng S, Bian Q, Xu L, Collins MD, Chang HC, Song L, Liu J, Wang S, Wang X (2005). "Genotoxic effects on spermatozoa of carbaryl-exposed workers". Toxicol. Sci. 85 (1): 615–23. doi:10.1093/toxsci/kfi066. PMID 15615886.