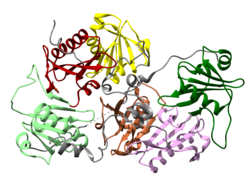
Gelsolin
Gelsolin je aktin-vezujući protein koji je ključni regulator sastavljanja i rastavljanja aktinskih niti. Gelsolin je jedan od najmoćnijih članova superporodice gelsolin/vilin koja razdvaja aktin, jer ga odvaja sa gotovo 100% efikasnošću.[4][5] Ćelijski gelsolin, nađen u citosolu i mitohondrijama[6] ima blisko povezan izlučeni oblik, plazmatski gelsolin, koji sadrži dodatnih 24 AA N-terminalnih nastavaka.]][7][8] Sposobnost gelsolina u plazmi da razreže aktinske filamente pomaže tijelu da se oporavi od bolesti i ozljeda koje propuštaju ćelijski aktin u krv. Osim toga, ima važnu ulogu u urođenoj imunosti, domaćina, aktivirajući makrofage i lokalizirajući upalu.
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 782 aminokiseline, а molekulska težina 85.698 Da.[9]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAPHRPAPAL | LCALSLALCA | LSLPVRAATA | SRGASQAGAP | QGRVPEARPN | ||||
| SMVVEHPEFL | KAGKEPGLQI | WRVEKFDLVP | VPTNLYGDFF | TGDAYVILKT | ||||
| VQLRNGNLQY | DLHYWLGNEC | SQDESGAAAI | FTVQLDDYLN | GRAVQHREVQ | ||||
| GFESATFLGY | FKSGLKYKKG | GVASGFKHVV | PNEVVVQRLF | QVKGRRVVRA | ||||
| TEVPVSWESF | NNGDCFILDL | GNNIHQWCGS | NSNRYERLKA | TQVSKGIRDN | ||||
| ERSGRARVHV | SEEGTEPEAM | LQVLGPKPAL | PAGTEDTAKE | DAANRKLAKL | ||||
| YKVSNGAGTM | SVSLVADENP | FAQGALKSED | CFILDHGKDG | KIFVWKGKQA | ||||
| NTEERKAALK | TASDFITKMD | YPKQTQVSVL | PEGGETPLFK | QFFKNWRDPD | ||||
| QTDGLGLSYL | SSHIANVERV | PFDAATLHTS | TAMAAQHGMD | DDGTGQKQIW | ||||
| RIEGSNKVPV | DPATYGQFYG | GDSYIILYNY | RHGGRQGQII | YNWQGAQSTQ | ||||
| DEVAASAILT | AQLDEELGGT | PVQSRVVQGK | EPAHLMSLFG | GKPMIIYKGG | ||||
| TSREGGQTAP | ASTRLFQVRA | NSAGATRAVE | VLPKAGALNS | NDAFVLKTPS | ||||
| AAYLWVGTGA | SEAEKTGAQE | LLRVLRAQPV | QVAEGSEPDG | FWEALGGKAA | ||||
| YRTSPRLKDK | KMDAHPPRLF | ACSNKIGRFV | IEEVPGELMQ | EDLATDDVML | ||||
| LDTWDQVFVW | VGKDSQEEEK | TEALTSAKRY | IETDPANRDR | RTPITVVKQG | ||||
| FEPPSFVGWF | LGWDDDYWSV | DPLDRAMAEL | AA |
Struktura
urediGelsolin je protein od 82 kD sa šest homolognih poddomena, koji se nazivaju S1-S6. Svaki poddomen se sastoji od petolančanog β-lista, okruženog sa po dva α-heliksa, jednim postavljenom okomito u odnosu na niti, a drugim paralelno. Βeta-listovi tri N-terminalna poddomena (S1-S3) spajaju se kako bi formirali prošireni β-list, kao i β-listovi C-terminalnalnog poddomena (S4-S6).[10]
Regulacija
urediMeđu lipid-vezujućim aktin-regulatornim proteinima, gelsolin (poput kofilina) prvenstveno veže polifosfoinozitid (PPI).[11] Vezivne sekvence u gelsolinu jako liče motivima u drugim proteinima koji vežu PPI.[11]
Gelsolinovu aktivnost stimuliraju ioni kalcija (Ca2+).[5] Iako protein zadržava svoj ukupni strukturni integritet i u aktiviranom i u deaktiviranom stanju, spiralni rep S6 kreće se poput zasuna, u zavisnosti od koncentracije kalcijevih iona.[12] C-terminalni kraj detektira koncentraciju kalcija unutar ćelije. Kad nema Ca2+, rep S6 štiti mjesta koja se vezuju za aktin na jednoj od spirala S2.[10] Kada se ion kalcija veže za rep S6 , međutim, ispravlja se, izlažući mjesta vezanja aktina S2.[12] N-terminal je direktno uključen u presijecanje aktina. S2 i S3 se vezuju za aktin prije nego što se S1 prekine s vezama aktin-aktin i zatvori bodljikavi kraj.[11]
Gelsolin se može inhibirati lokalnim porastom koncentracije fosfatidilinositol (4,5)-bisfosfata (PIP2 ), PPI. Ovo je proces u dva koraka. Prvo, (PIP2) veže se za S2 i S3, inhibirajući vezanje gelsolina na strani aktina. Zatim se (PIP2) veže za gelsolin S1, sprječavajući ga da prekine djelovanje aktina, iako se (PIP2) ne veže izravno na mjesto vezanja gelsolina za aktin.[11]
Gelsolinovo presecanje aktina, za razliku od presecanja mikrotubula po kataninu, ne zahtijeva nikakav dodatni unos energije.
Ćelijska funkcija
urediKao važan regulator aktina, gelsolin ima ulogu u stvaranju podosoma (zajedno s Arp3, kortaktinom i Rho GTPazama).[13]
Gelsolin također inhibira apoptozu, stabilizacijom mitohondrija.[6] Prije ćelijske smrti, mitohondrija normalno gube membranski potencijal i postaju propusnije. Gelsolin može spriječiti oslobađanje citohroma C, ometajući pojačavanje signala koje bi dovelo do apoptoze.[14]
Aktin se može umrežiti u gel, pomoću proteina umrežavanja aktina. Gelsolin može pretvoriti ovaj gel u sol, otuda i naziv gelsolin.
Studije na životinjama
urediIstraživanja na miševima sugeriraju da se gelsolin, kao i drugi proteini koji razdvajaju aktin, ne eksprimira u značajnoj mjeri tek nakon ranog embrionskog stadija – otprilike dvije sedmice u mišjim embrijima.[15] U odraslih primjeraka, međutim, gelsolin je posebno važan u pokretnim ćelijama, poput krvnih trombocita. Miševi s nultom oznakom gena koji kodiraju gelsolin prolaze normalan embrionski razvoj, ali je deformacija njihovih krvnih pločica smanjila njihovu pokretljivost, što je rezultiralo sporijim odgovorom na zacjeljivanje rana.[15]
Pokazalo se da nedostatak gelsolina kod miševa uzrokuje povećanu propusnost vaskularne plućne barijere, što ukazuje da je gelsolin važan u odgovoru na ozljedu pluća.[16]
Srodni proteini
uredi| Gelsolinoliki domen | |
|---|---|
| Identifikatori | |
| Simbol | ? |
Sekvenca poređenja ukazuju na avolucijski odnos između gelsolina, vilina, fragmina i severina.[18] Šest velikih ponavljajućih segmenata javlja se u gelsolinu i villinu, a tri slična segmenta u severinu i fragminu. Višestruka ponavljanja su u strukturi (ali jedva u sekvenci) povezani sa ADF-H domenom, tvoreći natporodicu (IPR029006). Čini se da je porodica evoluirala iz predačke sekvence od 120 do 130 aminokiselinskih ostataka.[4][18]
Interakcije
urediGelsolin je citoplazmatski protein, reguliran kalcijem, aktivno modulirajući protein koji se veže na bodljikave krajeve aktinskih niti, sprječavajući izmjenu monomera (blokiranje kraja ili zatvaranje).[20] Može promovirati nukleaciju (sastavljanje monomera u filamente), kao i raskidanje postojećih filamenata. Osim toga, ovaj protein veže sa visokim afinitetom za fibronektin. Plazmatski i citoplazmatski gelsolin su izvedeni iz jednog gena s alternativnim mjestima inicijacije i diferencijalnom preradom.[7]
Pokazalo se da gelsolin stupa u interakciju sa:
Također pogledajte
urediReference
uredi- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000026879 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Ghoshdastider U, Popp D, Burtnick LD, Robinson RC (novembar 2013). "The expanding superfamily of gelsolin homology domain proteins". Cytoskeleton. 70 (11): 775–95. doi:10.1002/cm.21149. PMID 24155256. S2CID 205643538.
- ^ a b Sun HQ, Yamamoto M, Mejillano M, Yin HL (novembar 1999). "Gelsolin, a multifunctional actin regulatory protein". The Journal of Biological Chemistry. 274 (47): 33179–82. doi:10.1074/jbc.274.47.33179. PMID 10559185.
- ^ a b Koya RC, Fujita H, Shimizu S, Ohtsu M, Takimoto M, Tsujimoto Y, Kuzumaki N (maj 2000). "Gelsolin inhibits apoptosis by blocking mitochondrial membrane potential loss and cytochrome c release". The Journal of Biological Chemistry. 275 (20): 15343–9. doi:10.1074/jbc.275.20.15343. PMID 10809769.
- ^ a b Kwiatkowski DJ, Stossel TP, Orkin SH, Mole JE, Colten HR, Yin HL (2. 10. 1986). "Plasma and cytoplasmic gelsolins are encoded by a single gene and contain a duplicated actin-binding domain". Nature. 323 (6087): 455–8. Bibcode:1986Natur.323..455K. doi:10.1038/323455a0. PMID 3020431. S2CID 4356162.
- ^ Nag S, Larsson M, Robinson RC, Burtnick LD (juli 2013). "Gelsolin: the tail of a molecular gymnast". Cytoskeleton. 70 (7): 360–84. doi:10.1002/cm.21117. PMID 23749648. S2CID 23646422.
- ^ "UniProt, P06396". Pristupljeno 9. 9. 2921. Provjerite vrijednost datuma u parametru:
|access-date=(pomoć) - ^ a b Kiselar JG, Janmey PA, Almo SC, Chance MR (april 2003). "Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3942–7. Bibcode:2003PNAS..100.3942K. doi:10.1073/pnas.0736004100. PMC 153027. PMID 12655044.
- ^ a b c d Yu FX, Sun HQ, Janmey PA, Yin HL (juli 1992). "Identification of a polyphosphoinositide-binding sequence in an actin monomer-binding domain of gelsolin". The Journal of Biological Chemistry. 267 (21): 14616–21. doi:10.1016/S0021-9258(18)42086-8. PMID 1321812.
- ^ a b Burtnick LD, Urosev D, Irobi E, Narayan K, Robinson RC (juli 2004). "Structure of the N-terminal half of gelsolin bound to actin: roles in severing, apoptosis and FAF". The EMBO Journal. 23 (14): 2713–22. doi:10.1038/sj.emboj.7600280. PMC 514944. PMID 15215896.
- ^ Varon C, Tatin F, Moreau V, Van Obberghen-Schilling E, Fernandez-Sauze S, Reuzeau E, et al. (maj 2006). "Transforming growth factor beta induces rosettes of podosomes in primary aortic endothelial cells". Molecular and Cellular Biology. 26 (9): 3582–94. doi:10.1128/MCB.26.9.3582-3594.2006. PMC 1447430. PMID 16611998.
- ^ a b Kusano H, Shimizu S, Koya RC, Fujita H, Kamada S, Kuzumaki N, Tsujimoto Y (oktobar 2000). "Human gelsolin prevents apoptosis by inhibiting apoptotic mitochondrial changes via closing VDAC". Oncogene. 19 (42): 4807–14. doi:10.1038/sj.onc.1203868. PMID 11039896.
- ^ a b Witke W, Sharpe AH, Hartwig JH, Azuma T, Stossel TP, Kwiatkowski DJ (april 1995). "Hemostatic, inflammatory, and fibroblast responses are blunted in mice lacking gelsolin". Cell. 81 (1): 41–51. doi:10.1016/0092-8674(95)90369-0. PMID 7720072.
- ^ Becker PM, Kazi AA, Wadgaonkar R, Pearse DB, Kwiatkowski D, Garcia JG (april 2003). "Pulmonary vascular permeability and ischemic injury in gelsolin-deficient mice". American Journal of Respiratory Cell and Molecular Biology. 28 (4): 478–84. doi:10.1165/rcmb.2002-0024OC. PMID 12654637.
- ^ Wang H, Chumnarnsilpa S, Loonchanta A, Li Q, Kuan YM, Robine S, et al. (august 2009). "Helix straightening as an activation mechanism in the gelsolin superfamily of actin regulatory proteins". The Journal of Biological Chemistry. 284 (32): 21265–9. doi:10.1074/jbc.M109.019760. PMC 2755850. PMID 19491107.
- ^ a b Way M, Weeds A (oktobar 1988). "Nucleotide sequence of pig plasma gelsolin. Comparison of protein sequence with human gelsolin and other actin-severing proteins shows strong homologies and evidence for large internal repeats". Journal of Molecular< Biology. 203 (4): 1127–33. doi:10.1016/0022-2836(88)90132-5. PMID 2850369.
- ^ Akıl C, Tran LT, Orhant-Prioux M, Baskaran Y, Manser E, Blanchoin L, Robinson RC (august 2020). "Insights into the evolution of regulated actin dynamics via characterization of primitive gelsolin/cofilin proteins from Asgard archaea". Proceedings of the National Academy of Sciences of the United States of America. 117 (33): 19904–19913. doi:10.1073/pnas.2009167117. PMC 7444086. PMID 32747565.
- ^ Weeds AG, Gooch J, Pope B, Harris HE (novembar 1986). "Preparation and characterization of pig plasma and platelet gelsolins". European Journal of Biochemistry. 161 (1): 69–76. doi:10.1111/j.1432-1033.1986.tb10125.x. PMID 3023087.
- ^ Chauhan VP, Ray I, Chauhan A, Wisniewski HM (maj 1999). "Binding of gelsolin, a secretory protein, to amyloid beta-protein". Biochemical and Biophysical Research Communications. 258 (2): 241–6. doi:10.1006/bbrc.1999.0623. PMID 10329371.
- ^ Nishimura K, Ting HJ, Harada Y, Tokizane T, Nonomura N, Kang HY, et al. (august 2003). "Modulation of androgen receptor transactivation by gelsolin: a newly identified androgen receptor coregulator". Cancer Research. 63 (16): 4888–94. PMID 12941811.
- ^ Wang Q, Xie Y, Du QS, Wu XJ, Feng X, Mei L, et al. (februar 2003). "Regulation of the formation of osteoclastic actin rings by proline-rich tyrosine kinase 2 interacting with gelsolin". The Journal of Cell Biology. 160 (4): 565–75. doi:10.1083/jcb.200207036. PMC 2173747. PMID 12578912.
Vanjski linkovi
uredi- Gelsolin na US National Library of Medicine Medical Subject Headings (MeSH)