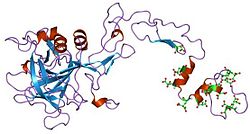
Faktor IX
Faktor IX ili Christmasov faktor (EC 3.4.21.22) je jedan od serinskih proteaza sistema koagulacije; pripada porodici peptidaza S1. Nedostatak ovog proteina uzrokuje hemofiliju B. Otkriven je 1952. godine nakon što je ustanovljeno da dječaku po imenu Stephen Christmas nedostaje pravilan ovaj faktor, što je dovelo do hemofilije.[5]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 461 aminokiselina, а molekulska masa — 51 778 Da.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MQRVNMIMAE | SPGLITICLL | GYLLSAECTV | FLDHENANKI | LNRPKRYNSG | ||||
| KLEEFVQGNL | ERECMEEKCS | FEEAREVFEN | TERTTEFWKQ | YVDGDQCESN | ||||
| PCLNGGSCKD | DINSYECWCP | FGFEGKNCEL | DVTCNIKNGR | CEQFCKNSAD | ||||
| NKVVCSCTEG | YRLAENQKSC | EPAVPFPCGR | VSVSQTSKLT | RAETVFPDVD | ||||
| YVNSTEAETI | LDNITQSTQS | FNDFTRVVGG | EDAKPGQFPW | QVVLNGKVDA | ||||
| FCGGSIVNEK | WIVTAAHCVE | TGVKITVVAG | EHNIEETEHT | EQKRNVIRII | ||||
| PHHNYNAAIN | KYNHDIALLE | LDEPLVLNSY | VTPICIADKE | YTNIFLKFGS | ||||
| GYVSGWGRVF | HKGRSALVLQ | YLRVPLVDRA | TCLRSTKFTI | YNNMFCAGFH | ||||
| EGGRDSCQGD | SGGPHVTEVE | GTSFLTGIIS | WGEECAMKGK | YGIYTKVSRY | ||||
| VNWIKEKTKL | T |
Fiziologija
urediFaktor IX se proizvodi kao zimogen, neaktivni prekursor. Obrađuje se glikoziliran, da bi se uklonio signalni peptid , a zatim se cijepa pomoću faktora XIa (kontaktnog puta) ili faktora VIIa (put tkivnog faktora) za proizvodnju dvolančane forme, gdje su lanci povezani disulfidnim mostom.[6][7] Kada se aktivira u faktor IXa, u prisustvu Ca2+, membranskih fosfolipida i kofaktora faktora VIII, hidrolizira jednu vezu arginin-izoleucin u faktoru X da formira faktor Xa.
Faktor IX inhibira antitrombin.[6]
Kod ljudi i miševa, ekspresija faktora IX povećava se sa godinama. U modelima miša, mutacije unutar promotorske regije faktora IX imaju fenotip ovisan o starosti.[8]
Arhitektura domena
urediFaktori VII, IX i X svi imaju ključne uloge u koagulaciji krvi i također dijele zajedničku arhitekturu domena.[9] Protein faktora IX sastoji se od četiri proteinska domena: Gla domen, dvije tandemske kopije EGF domen i C-terminalni tripsin peptidazni domen koji vrši katalitsko cijepanje.
Pokazalo se da je N-terminalni EGF domen barem dijelom odgovoran za vezivanje tkivnog faktora.[9] Wilkinson et al. conclude that residues 88 to 109 of the second EGF domain mediate binding to platelets and assembly of the factor X activating complex.[10]
Strukture sva četiri domena su riješene. Za svinjski protein određena je struktura dva EGF domena i tripsinolikog domena.[11] Struktura Gla domena, koji je odgovoran za vezanje fosfolipida ovisno o Ca(II), također je određena putem NMR.[12] Nekoliko struktura 'super aktivnih' mutanata također je riješeno,[13] a koje otkrivaju prirodu aktivacije faktora IX putem drugih proteina u kaskadi zgrušavanja.
Genetika
urediGen za faktor IX se nalazi na hromosomu X (Xq27.1-q27.2) i stoga je X-vezani recesivan: mutacije u ovom genu pogađaju muškarce mnogo češće nego žene. U ovom genu otkrivene su najmanje 534 mutacije koje izazivaju bolest.[14] Gen F9 su prvi klonirali Kotoku Kurachi i Earl Davie, 1982. godine.[15]
Polly, transgenu kloniranu Poll Dorset ovcu koja nosi gen za faktor IX, proizveo je dr Ian Wilmut na Roslin Institute, 1997.[16]
Klinički značaj
uredi
Nedostatak faktora IX uzrokuje Christmasovu bolest (hemofilija B).[5] Opisano je preko 3000 varijanti faktora IX, koje utiču na 73% od 461 ostatka;[17] neki ne izazivaju simptome, ali mnogi dovode do značajnog poremećaja krvarenja. Originalna mutacija Christmasove bolesti identificirana je sekvenciranjem njegove DNK, otkrivajući mutaciju koja je promijenila cistein u serin.[18] Za liječenje Christmasove bolesti koristi se rekombinantni faktor IX. Formulacije uključuju:
- nonacog alfa (marka BeneFix)[19]
- albutrepenonacog alfa (marka Idelvion)[20]
- eftrenonacog alfa (marka Alprolix)[21]
- nonacog beta pegol (marka Refixia)[22]
Neke rijetke mutacije faktora IX dovode do povišene aktivnosti zgrušavanja i mogu rezultirati bolestima zgrušavanja, kao što je duboka venska tromboza. Ova mutacija dobitka funkcije čini protein hiperfunkcionalnim i povezana je s porodičnom trombofilijom ranog početka.[23]
Nedostatak faktora IX liječi se injekcijom pročišćenog faktora IX. proizvedenog kloniranjem u različitim životinjskim vektorima ili u životinjskim ćelijama. Traneksamijska kiselina može biti od koristi kod pacijenata koji su podvrgnuti operaciji koji imaju naslijeđeni nedostatak faktora IX, kako bi se smanjio perioperativni rizik od krvarenja.[24]
Listu svih mutacija u faktoru IX sastavlja i održava EAHAD.[25]
Faktor koagulacije IX nalazi se na Listi esencijalnih lijekova Svjetske zdravstvene organizacije.
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000101981 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000031138 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Biggs R, Douglas AS, Macfarlane RG, Dacie JV, Pitney WR (Dec 1952). "Christmas disease: a condition previously mistaken for haemophilia". British Medical Journal. 2 (4799): 1378–82. doi:10.1136/bmj.2.4799.1378. PMC 2022306. PMID 12997790.
- ^ a b Di Scipio RG, Kurachi K, Davie EW (Jun 1978). "Activation of human factor IX (Christmas factor)". The Journal of Clinical Investigation. 61 (6): 1528–38. doi:10.1172/JCI109073. PMC 372679. PMID 659613.
- ^ Taran LD (Jul 1997). "Factor IX of the blood coagulation system: a review". Biochemistry. Biokhimiia. 62 (7): 685–93. PMID 9331959.
- ^ Boland EJ, Liu YC, Walter CA, Herbert DC, Weaker FJ, Odom MW, Jagadeeswaran P (Sep 1995). "Age-specific regulation of clotting factor IX gene expression in normal and transgenic mice". Blood. 86 (6): 2198–205. doi:10.1182/blood.V86.6.2198.bloodjournal8662198. PMID 7662969.
- ^ a b Zhong D, Bajaj MS, Schmidt AE, Bajaj SP (Feb 2002). "The N-terminal epidermal growth factor-like domain in factor IX and factor X represents an important recognition motif for binding to tissue factor". The Journal of Biological Chemistry. 277 (5): 3622–31. doi:10.1074/jbc.M111202200. PMID 11723140.
- ^ Wilkinson FH, Ahmad SS, Walsh PN (Feb 2002). "The factor IXa second epidermal growth factor (EGF2) domain mediates platelet binding and assembly of the factor X activating complex". The Journal of Biological Chemistry. 277 (8): 5734–41. doi:10.1074/jbc.M107753200. PMID 11714704.
- ^ Brandstetter H, Bauer M, Huber R, Lollar P, Bode W (Oct 1995). "X-ray structure of clotting factor IXa: active site and module structure related to Xase activity and hemophilia B". Proceedings of the National Academy of Sciences of the United States of America. 92 (21): 9796–800. Bibcode:1995PNAS...92.9796B. doi:10.1073/pnas.92.21.9796. PMC 40889. PMID 7568220.
- ^ Freedman SJ, Furie BC, Furie B, Baleja JD (Sep 1995). "Structure of the calcium ion-bound gamma-carboxyglutamic acid-rich domain of factor IX". Biochemistry. 34 (38): 12126–37. doi:10.1021/bi00038a005. PMID 7547952.
- ^ Zögg T, Brandstetter H (Dec 2009). "Structural basis of the cofactor- and substrate-assisted activation of human coagulation factor IXa". Structure. 17 (12): 1669–78. doi:10.1016/j.str.2009.10.011. PMID 20004170.
- ^ Šimčíková D, Heneberg P (decembar 2019). "Refinement of evolutionary medicine predictions based on clinical evidence for the manifestations of Mendelian diseases". Scientific Reports. 9 (1): 18577. Bibcode:2019NatSR...918577S. doi:10.1038/s41598-019-54976-4. PMC 6901466. PMID 31819097.
- ^ Kurachi K, Davie EW (Nov 1982). "Isolation and characterization of a cDNA coding for human factor IX". Proceedings of the National Academy of Sciences of the United States of America. 79 (21): 6461–4. Bibcode:1982PNAS...79.6461K. doi:10.1073/pnas.79.21.6461. PMC 347146. PMID 6959130.
- ^ Nicholl D. (2002). An Introduction to Genetic Engineering Second Edition. Cambridge University Press. str. 257.
- ^ Goodeve, A. C. (2015). "Hemophilia B: Molecular pathogenesis and mutation analysis". Journal of Thrombosis and Haemostasis. 13 (7): 1184–1195. doi:10.1111/jth.12958. PMC 4496316. PMID 25851415.
- ^ Taylor SA, Duffin J, Cameron C, Teitel J, Garvey B, Lillicrap DP (Jan 1992). "Characterization of the original Christmas disease mutation (cysteine 206----serine): from clinical recognition to molecular pathogenesis". Thrombosis and Haemostasis. 67 (1): 63–5. doi:10.1055/s-0038-1648381. PMID 1615485.
- ^ "BeneFIX EPAR". European Medicines Agency (EMA). Pristupljeno 17. 6. 2020.
- ^ "Idelvion EPAR". European Medicines Agency (EMA). 17. 9. 2018. Pristupljeno 17. 6. 2020.
- ^ "Alprolix EPAR". European Medicines Agency (EMA). Pristupljeno 17. 6. 2020.
- ^ "Refixia EPAR". European Medicines Agency (EMA). Pristupljeno 17. 6. 2020.
- ^ Simioni P, Tormene D, Tognin G, Gavasso S, Bulato C, Iacobelli NP, Finn JD, Spiezia L, Radu C, Arruda VR (Oct 2009). "X-linked thrombophilia with a mutant factor IX (factor IX Padua)". The New England Journal of Medicine. 361 (17): 1671–5. doi:10.1056/NEJMoa0904377. PMID 19846852.
- ^ Rossi M, Jayaram R, Sayeed R (Sep 2011). "Do patients with haemophilia undergoing cardiac surgery have good surgical outcomes?". Interactive Cardiovascular and Thoracic Surgery. 13 (3): 320–31. doi:10.1510/icvts.2011.272401. PMID 21712351.
- ^ "Home: EAHAD Factor 9 Gene Variant Database".
Dopunska literatura
uredi- Davie EW, Fujikawa K (1975). "Basic mechanisms in blood coagulation". Annual Review of Biochemistry. 44: 799–829. doi:10.1146/annurev.bi.44.070175.004055. PMID 237463.
- Sommer SS (Jul 1992). "Assessing the underlying pattern of human germline mutations: lessons from the factor IX gene". FASEB Journal. 6 (10): 2767–74. doi:10.1096/fasebj.6.10.1634040. PMID 1634040. S2CID 15211597.
- Lenting PJ, van Mourik JA, Mertens K (Dec 1998). "The life cycle of coagulation factor VIII in view of its structure and function". Blood. 92 (11): 3983–96. doi:10.1182/blood.V92.11.3983. PMID 9834200.
- Lowe GD (Dec 2001). "Factor IX and thrombosis" (PDF). British Journal of Haematology. 115 (3): 507–13. doi:10.1046/j.1365-2141.2001.03186.x. PMID 11736930. S2CID 44650866.
- O'Connell NM (Jun 2003). "Factor XI deficiency--from molecular genetics to clinical management". Blood Coagulation & Fibrinolysis. 14 Suppl 1: S59-64. doi:10.1097/00001721-200306001-00014. PMID 14567539.
- Du X (maj 2007). "Signaling and regulation of the platelet glycoprotein Ib-IX-V complex". Current Opinion in Hematology. 14 (3): 262–9. doi:10.1097/MOH.0b013e3280dce51a. PMID 17414217. S2CID 39904506.
Vanjski linkovi
uredi- "Coagulation Factor IX (Recombinant), Fc Fusion Protein". Drug Information Portal. U.S. National Library of Medicine.
- "Eftrenonacog alfa". Drug Information Portal. U.S. National Library of Medicine.
- "Nonacog alfa". Drug Information Portal. U.S. National Library of Medicine.
- "Albutrepenonacog alfa". Drug Information Portal. U.S. National Library of Medicine.
- "Nonacog beta pegol". Drug Information Portal. U.S. National Library of Medicine.
- P00740
- GeneReviews/NCBI/NIH/UW entry on Hemophilia B
- The MEROPS online database for peptidases and their inhibitors: S01.214 Arhivirano 5. 5. 2005. na Wayback Machine