CXCL12
Stromski ćelijskoizvedeni faktor 1 (SDF1), znan i kao C-X-C motivni hemokin 12 (CXCL12), jest hemokinski protein koji je kod ljudi kodiran genom CXCL12 sa hromosoma 10.[5] Sveprisutno je eksprimiran u mnogim tkivima i tipovima ćelija.[6] Faktori 1-alfa i 1-beta izvedeni iz stromskih ćelija mali su citokini koji pripadaju porodici hemokina, čiji članovi aktiviraju leukocite i često su inducirani proupalnim podražajima kao što su lipopolisaharid , TNF, ili IL1. Hemokine karakterizira prisustvo po četiri konzervirana cisteina, koji tvore dvije disulfidne veze. Mogu se klasifikovati u dvije potporodice. U potporodici CC, ostaci cisteina su susjedni. U potporodici CXC, odvojeni su posrednom aminokiselinom. Proteini SDF1 pripadaju posljednjoj grupi.[5] Signalizacija CXCL12 primijećena je u nekoliko karcinoma.[7][8] Gen CXCL12 također sadrži jedan od 27 jednonukleotidnih polimorfizama pridruženih povećanom riziku od bolesti srčanih arterija.[9]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 93 aminokiselina, а molekulska težina 10.666.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MNAKVVVVLV | LVLTALCLSD | GKPVSLSYRC | PCRFFESHVA | RANVKHLKIL | ||||
| NTPNCALQIV | ARLKNNNRQV | CIDPKLKWIQ | EYLEKALNKR | FKM |
- Simboli
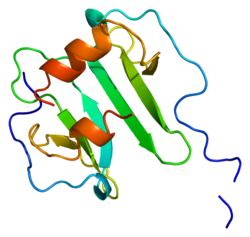
Struktura
urediGen
urediGen CXCL12 nalazi se na hromosomu 10 u pojasu 10q11.1 i sadrži 9 egzona.[5] Ovaj gen proizvodi sedam alternativno prerađenih izoformi.[10]
Protein
urediOvaj protein pripada porodici interkrinskih alfa (hemokina CXC).[10] SDF-1 se proizvodi u dva oblika, SDF-1α/CXCL12a i SDF-1β/CXCL12b , naizmjeničnom preradom istog gena.[11] Hemokine karakterizira prisutnost četiri konzervirana cisteina, koji tvore dvije disulfidne veze. Proteini CXCL12 pripadaju grupi CXC hemokina, čiji je početni par cisteina odvojen jednom intervenirajućom aminokiselinom. Osim toga, prvih osam ostataka CXCL12 N-terminala služi kao mjesto vezanja receptora, iako samo Lys-1 i Pro-2 izravno sudjeluju u aktiviranju receptora. U međuvremenu, RFFESH motiv (ostaci 12-17) u regiji petlje funkcionira kao mjesto vezivanjsa za CXCL12 receptore.[12]
Funkcija
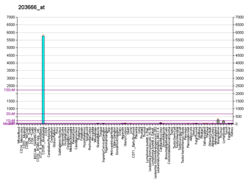
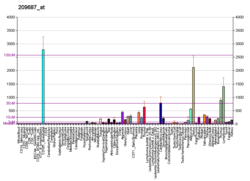
urediCXCL12 se eksprimira u mnogim tkivima miševa uključujući mozak, timus, srce, pluća, jetru, bubrege, slezenu i koštanu srž.[13] CXCL12 je snažno hemotaksijaki za limfocite.[14][15][16][17] Tokom embriogeneze, usmjerava migraciju hematopoetskih ćelija iz fetusne jetre u koštanu srž i stvaranje velikih krvnih žila. Također je pokazano da signalizacija CXCL12-a regulira ekspresiju CD20 na B-ćelijama. CXCL12 je također hemotaksijski za mezenhimske matične ćelije i eksprimiran je u području upalnog uništavanja kostiju, gdje posreduje u njihovom supresivnom djelovanju na osteoklastogenezu.[18]
U odrasloj dobi, CXCL12 ima važnu ulogu u angiogenezi, regrutiranjem endotelnih progenitorskih ćelija (EPC) iz koštane srži, putem mehanizma ovisnog o CXCR4.[19]
CXCR4, prethodno nazvan LESTR ili fuzin, jest receptor za CXCL12.[14] Ova interakcija CXCL12-CXCR4 smatrala se ekskluzivnom (za razliku od drugih hemokina i njihovih receptora), ali nedavno, predloženo je da CXCL12 također može vezati CXCR7 receptor (sada se naziva ACKR3).[20][21][22] Blokiranjem CXCR4, glavnog koreceptora za ulazak HIV-1, CXCL12 djeluje kao endogeni inhibitor CXCR4-tropskih sojeva HIV-1.[23]
Tokom embrionskog razvoja, CXCL12 ima ulogu u formiranju malog mozga, putem migracije neurona.[24] Unutar CNS-a, CXCL12 doprinosi proliferaciji ćelija, neurogenezi (razvoj i rast nervnog tkiva), kao i nervnim upalama. Neuronske matične ćelije (NPC) su matične ćelije koje se diferenciraju u glijske i neuronske ćelije. CXCL12 podstiiče njihovu migraciju na mjesta lezija unutar mozga, posebno u širokim rasponima. Kad dođu na mjesto oštećenja, NPC-i mogu započeti popravak tkiva na bazi matičnih ćelija na leziji.[25] Osovina CXCL12/CXCR4 pruža znakove navođenja u aksone i neurite, čime se podstiču izrastanje neurita (neuroni stvaraju izbočine) i neurogeneza.[26] Kao i drugi hemokini, CXCL12 je uključen u migraciju ćelija koja doprinosi upali. Što se tiče CNS-a, CXCL12 ima ulogu u neuroinflamaciji, privlačeći leukocite preko krvno-moždane barijere.[25] Međutim, pretjerana proizvodnja i nakupljanje CXCL12 mogu postati toksični, a nastala upala može rezultirati ozbiljnim posljedicama .[27]
Klinički značaj
urediKod ljudi je CXCL12 bio uključen u veliki broj biomedicinskih stanja koja uključuju nekoliko organskih sistema.[28] Nadalje, signalizacija CXCL12 zajedno sa signalizacijom CXCR7 bila je umiješana u progresiju raka gušterače.[7] U sistemu mokraćnog trakta, metilacija promotora CXCL12 i ekspresija PD-L1 mogu biti moćni prognostički biomarkeri za biohemijski recidiv kod pacijenata sa karcinomom prostate, nakon radikalne prostatektomije, a u toku su dalje studije kako bi se potvrdilo može li metilacija CXCL12 pomoći u strategijama aktivnog nadzora.[29] U području onkologije, melanomski povezani fibroblasti stimulirani su stimulacijom A2B adenozinskog receptora, nakon čega slijedi stimulacija faktora rasta fibroblasta i povećana ekspresija CXCL12.[8]
Klinički marker
urediStudija genetičkog rizika sa više lokusa, zasnovana na kombinaciji 27 lokusa, uključujući gen CXCL12, identifikovala je osobe sa povećanim rizikom i za incidente i za ponavljane događaje koronarne arterijske bolesti, kao i za poboljšanu kliničku korist od terapije statinima. Studija se temeljila na kohortnom proučavanju zajednice (studija Malmo Diet and Cancer) i četiri dodatna randomizirano kontrolirana ispitivanja kohorti primarne prevencije (JUPITER i ASCOT) i sekundarne kohortne prevencije (CARE i PROVE IT-TIMI 22).[9]
Multipla skleroza
urediNeurološko stanje koje je posljedica neispravne interakcije između imunskog i nervnog sistema je multipla skleroza (MS). MS karakterizira demijelinizacija živaca zbog imunoskog sistema koji napada CNS. Povišeni nivoi CXCL12 zapaženi su u cerebralnoj kičmenoj tečnosti pacijenata sa MS. CXCL12 prelazi krvno-moždanu barijeru i uzrokuje neuroinflamaciju, koja doprinosi oštećenju aksona, a time i progresiji multiple skleroze.[30]
Alzheimerova bolest
urediIako CXCL12 može biti štetan za osobe s MS-om, novija istraživanja sugeriraju da bi ovaj hemokin mogao biti koristan u smanjenju progresije pacijenata s Alzheimerovom bolešću. Alzheimerova bolest je još jedno neurološko stanje i najčešći oblik demencije kod koje kognicija značajno opada. Jedna od glavnih karakteristika Alzheimerove bolesti je nakupljanje moždanog plaka poznatog kao beta-amiloid. Postoje neuroprotektivni aspekti CXCL12 kod miševa s ovim plakovima/Alzheimerovom bolesti. PAK je protein povezan s održavanjem dendritskih bodlji koje su bitne u sinapsama za primanje informacija iz aksona. Kod pacijenata s Alzheimerovom bolešću dolazi do pogrešne lokalizacije PAK-a, ali prethodna obrada neurona kod miševa s CXCL12 pokazala je potiskivanje te pogrešne lokalizacije.[31] Osim toga, ovaj predtretman sa CXCL smanjio je prevalenciju apoptoza i oksidativnog oštećenja, obično uzrokovanog prisustvom beta-amiloidnog plaka.[31]
Kao meta lijekova
urediHemokini i receptori za hemokine, od kojih se ističe CXCR, reguliraju više procesa, kao što su morfogeneza, angiogeneza i imunski odgovori i smatraju se potencijalnim metama za razvoj lijekova. U sistemu gastrointestinalnog trakta, ispituje se osovina CXCL12-CXCR4, kao antifibrotska terapija u liječenju hroničnog pankreatitisa.[32] Naprimjer, blokiranje CXCR4, receptora za CXCL12 , Plerixaforom (AMD-3100) povećalo je efikasnost kombretastatina u mišjem modelu raka dojke, vjerovatno sprječavajući da se makrofagi regrutiraju u tumore. Faktor izveden iz stromnih ćelija, AMD-3100 također se široko koristi u kombinaciji s G-CSF-om, za mobilizaciju hematopoetskih matičnih ćelija u krvotok, omogućavajući prikupljanje za transplantaciju koštane srži.[33]
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000107562 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000061353 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c "Entrez Gene: CXCL12 chemokine (C-X-C motif) ligand 12 (stromal cell-derived factor 1)".
- ^ "BioGPS - your Gene Portal System". biogps.org. Pristupljeno 11. 10. 2016.
- ^ a b Guo JC, Li J, Zhou L, Yang JY, Zhang ZG, Liang ZY, Zhou WX, You L, Zhang TP, Zhao YP (august 2016). "CXCL12-CXCR7 axis contributes to the invasive phenotype of pancreatic cancer". Oncotarget. 7 (38): 62006–62018. doi:10.18632/oncotarget.11330. PMC 5308707. PMID 27542220.
- ^ a b Sorrentino C, Miele L, Porta A, Pinto A, Morello S (august 2016). "Activation of the A2B adenosine receptor in B16 melanomas induces CXCL12 expression in FAP-positive tumor stromal cells, enhancing tumor progression". Oncotarget. 7 (39): 64274–64288. doi:10.18632/oncotarget.11729. PMC 5325441. PMID 27590504.
- ^ a b Mega JL, Stitziel NO, Smith JG, Chasman DI, Caulfield MJ, Devlin JJ, Nordio F, Hyde CL, Cannon CP, Sacks FM, Poulter NR, Sever PS, Ridker PM, Braunwald E, Melander O, Kathiresan S, Sabatine MS (juni 2015). "Genetic risk, coronary heart disease events, and the clinical benefit of statin therapy: an analysis of primary and secondary prevention trials". Lancet. 385 (9984): 2264–71. doi:10.1016/S0140-6736(14)61730-X. PMC 4608367. PMID 25748612.
- ^ a b "CXCL12 - Stromal cell-derived factor 1 precursor - Homo sapiens (Human) - CXCL12 gene & protein". UniProt.
- ^ De La Luz Sierra M, Yang F, Narazaki M, Salvucci O, Davis D, Yarchoan R, Zhang HH, Fales H, Tosato G (april 2004). "Differential processing of stromal-derived factor-1alpha and stromal-derived factor-1beta explains functional diversity". Blood. 103 (7): 2452–9. doi:10.1182/blood-2003-08-2857. PMID 14525775.
- ^ Crump MP, Gong JH, Loetscher P, Rajarathnam K, Amara A, Arenzana-Seisdedos F, Virelizier JL, Baggiolini M, Sykes BD, Clark-Lewis I (decembar 1997). "Solution structure and basis for functional activity of stromal cell-derived factor-1; dissociation of CXCR4 activation from binding and inhibition of HIV-1". The EMBO Journal. 16 (23): 6996–7007. doi:10.1093/emboj/16.23.6996. PMC 1170303. PMID 9384579.
- ^ Schrader AJ, Lechner O, Templin M, Dittmar KE, Machtens S, Mengel M, Probst-Kepper M, Franzke A, Wollensak T, Gatzlaff P, Atzpodien J, Buer J, Lauber J (april 2002). "CXCR4/CXCL12 expression and signalling in kidney cancer". British Journal of Cancer. 86 (8): 1250–6. doi:10.1038/sj.bjc.6600221. PMC 2375348. PMID 11953881.
- ^ a b Bleul CC, Fuhlbrigge RC, Casasnovas JM, Aiuti A, Springer TA (septembar 1996). "A highly efficacious lymphocyte chemoattractant, stromal cell-derived factor 1 (SDF-1)". The Journal of Experimental Medicine. 184 (3): 1101–9. doi:10.1084/jem.184.3.1101. PMC 2192798. PMID 9064327.
- ^ Ara T, Nakamura Y, Egawa T, Sugiyama T, Abe K, Kishimoto T, Matsui Y, Nagasawa T (april 2003). "Impaired colonization of the gonads by primordial germ cells in mice lacking a chemokine, stromal cell-derived factor-1 (SDF-1)". Proceedings of the National Academy of Sciences of the United States of America. 100 (9): 5319–23. doi:10.1073/pnas.0730719100. PMC 154343. PMID 12684531.
- ^ Askari AT, Unzek S, Popovic ZB, Goldman CK, Forudi F, Kiedrowski M, Rovner A, Ellis SG, Thomas JD, DiCorleto PE, Topol EJ, Penn MS (august 2003). "Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy". Lancet. 362 (9385): 697–703. doi:10.1016/S0140-6736(03)14232-8. PMID 12957092. S2CID 24354002.
- ^ Ma Q, Jones D, Borghesani PR, Segal RA, Nagasawa T, Kishimoto T, Bronson RT, Springer TA (august 1998). "Impaired B-lymphopoiesis, myelopoiesis, and derailed cerebellar neuron migration in CXCR4- and SDF-1-deficient mice". Proceedings of the National Academy of Sciences of the United States of America. 95 (16): 9448–53. doi:10.1073/pnas.95.16.9448. PMC 21358. PMID 9689100.
- ^ Takano T, Li YJ, Kukita A, Yamaza T, Ayukawa Y, Moriyama K, Uehara N, Nomiyama H, Koyano K, Kukita T (2014). "Mesenchymal stem cells markedly suppress inflammatory bone destruction in rats with adjuvant-induced arthritis". Laboratory Investigation. 94 (3): 286–96. doi:10.1038/labinvest.2013.152. PMID 24395111.
- ^ Zheng H, Fu G, Dai T, Huang H (2007). "Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1alpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway". Journal of Cardiovascular Pharmacology. 50 (3): 274–80. doi:10.1097/FJC.0b013e318093ec8f. PMID 17878755. S2CID 13616442.
- ^ Balabanian K, Lagane B, Infantino S, Chow KY, Harriague J, Moepps B, Arenzana-Seisdedos F, Thelen M, Bachelerie F (2005). "The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes". The Journal of Biological Chemistry. 280 (42): 35760–6. doi:10.1074/jbc.M508234200. PMID 16107333.
- ^ Burns JM, Summers BC, Wang Y, Melikian A, Berahovich R, Miao Z, Penfold ME, Sunshine MJ, Littman DR, Kuo CJ, Wei K, McMaster BE, Wright K, Howard MC, Schall TJ (2006). "A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development". The Journal of Experimental Medicine. 203 (9): 2201–13. doi:10.1084/jem.20052144. PMC 2118398. PMID 16940167.
- ^ Cruz-Orengo L, Holman DW, Dorsey D, Zhou L, Zhang P, Wright M, McCandless EE, Patel JR, Luker GD, Littman DR, Russell JH, Klein RS (2011). "CXCR7 influences leukocyte entry into the CNS parenchyma by controlling abluminal CXCL12 abundance during autoimmunity". The Journal of Experimental Medicine. 208 (2): 327–39. doi:10.1084/jem.20102010. PMC 3039853. PMID 21300915.
- ^ Oberlin E, Amara A, Bachelerie F, Bessia C, Virelizier JL, Arenzana-Seisdedos F, Schwartz O, Heard JM, Clark-Lewis I, Legler DF, Loetscher M, Baggiolini M, Moser B (1996). "The CXC chemokine SDF-1 is the ligand for LESTR/fusin and prevents infection by T-cell-line-adapted HIV-1" (PDF). Nature. 382 (6594): 833–5. doi:10.1038/382833a0. PMID 8752281.
- ^ Bajetto A, Bonavia R, Barbero S, Florio T, Schettini G (juli 2001). "Chemokines and their receptors in the central nervous system". Frontiers in Neuroendocrinology. 22 (3): 147–84. doi:10.1006/frne.2001.0214. PMID 11456467. S2CID 29689159.
- ^ a b Li M, Hale JS, Rich JN, Ransohoff RM, Lathia JD (oktobar 2012). "Chemokine CXCL12 in neurodegenerative diseases: an SOS signal for stem cell-based repair". Trends in Neurosciences. 35 (10): 619–28. doi:10.1016/j.tins.2012.06.003. PMC 3461091. PMID 22784557.
- ^ Guyon A (mart 2014). "CXCL12 chemokine and its receptors as major players in the interactions between immune and nervous systems". Frontiers in Cellular Neuroscience. 8: 65. doi:10.3389/fncel.2014.00065. PMC 3944789. PMID 24639628.
- ^ Guyon A (2014). "CXCL12 chemokine and its receptors as major players in the interactions between immune and nervous systems". Frontiers in Cellular Neuroscience. 8: 65. doi:10.3389/fncel.2014.00065. PMC 3944789. PMID 24639628.
- ^ Pozzobon T, Goldoni G, Viola A, Molon B (septembar 2016). "CXCR4 signaling in health and disease". Immunology Letters. 177: 6–15. doi:10.1016/j.imlet.2016.06.006. PMID 27363619.
- ^ Goltz D, Holmes EE, Gevensleben H, Sailer V, Dietrich J, Jung M, Röhler M, Meller S, Ellinger J, Kristiansen G, Dietrich D (juli 2016). "CXCL12 promoter methylation and PD-L1 expression as prognostic biomarkers in prostate cancer patients". Oncotarget. 7 (33): 53309–53320. doi:10.18632/oncotarget.10786. PMC 5288188. PMID 27462860.
- ^ Krumbholz M, Theil D, Cepok S, Hemmer B, Kivisäkk P, Ransohoff RM, Hofbauer M, Farina C, Derfuss T, Hartle C, Newcombe J, Hohlfeld R, Meinl E (januar 2006). "Chemokines in multiple sclerosis: CXCL12 and CXCL13 up-regulation is differentially linked to CNS immune cell recruitment". Brain: A Journal of Neurology. 129 (Pt 1): 200–11. doi:10.1093/brain/awh680. PMID 16280350.
- ^ a b Raman D, Milatovic SZ, Milatovic D, Splittgerber R, Fan GH, Richmond A (novembar 2011). "Chemokines, macrophage inflammatory protein-2 and stromal cell-derived factor-1α, suppress amyloid β-induced neurotoxicity". Toxicology and Applied Pharmacology. 256 (3): 300–13. doi:10.1016/j.taap.2011.06.006. PMC 3236026. PMID 21704645.
- ^ Neesse A, Ellenrieder V (septembar 2016). "NEMO-CXCL12/CXCR4 axis: a novel vantage point for antifibrotic therapies in chronic pancreatitis?". Gut. 66 (2): gutjnl–2016–312874. doi:10.1136/gutjnl-2016-312874. PMID 27590996. S2CID 3493909.
- ^ De Clercq E. (2019) Mozobil(R) (Plerixafor, AMD3100), 10 years after its approval by the US Food and Drug Administration. Antivir Chem Chemother 27:1.
Dopunska literatura
uredi- Kucia M, Reca R, Miekus K, Wanzeck J, Wojakowski W, Janowska-Wieczorek A, Ratajczak J, Ratajczak MZ (august 2005). "Trafficking of normal stem cells and metastasis of cancer stem cells involve similar mechanisms: pivotal role of the SDF-1-CXCR4 axis". Stem Cells. 23 (7): 879–94. doi:10.1634/stemcells.2004-0342. PMID 15888687. S2CID 22504846.
- Kryczek I, Wei S, Keller E, Liu R, Zou W (mart 2007). "Stroma-derived factor (SDF-1/CXCL12) and human tumor pathogenesis". American Journal of Physiology. Cell Physiology. 292 (3): C987–95. doi:10.1152/ajpcell.00406.2006. PMID 16943240. S2CID 7423893.
- Stellos K, Gawaz M (mart 2007). "Platelets and stromal cell-derived factor-1 in progenitor cell recruitment". Seminars in Thrombosis and Hemostasis. 33 (2): 159–64. doi:10.1055/s-2007-969029. PMID 17340464.
- Wang J, Liu X, Lu H, Jiang C, Cui X, Yu L, Fu X, Li Q, Wang J (mart 2015). "CXCR4(+)CD45(-) BMMNC subpopulation is superior to unfractionated BMMNCs for protection after ischemic stroke in mice". Brain, Behavior, and Immunity. 45: 98–108. doi:10.1016/j.bbi.2014.12.015. PMC 4342301. PMID 25526817.
- Arya M, Ahmed H, Silhi N, Williamson M, Patel HR (2007). "Clinical importance and therapeutic implications of the pivotal CXCL12-CXCR4 (chemokine ligand-receptor) interaction in cancer cell migration". Tumour Biology. 28 (3): 123–31. doi:10.1159/000102979. PMID 17510563. S2CID 44356923.