CSNK1E
Izoforma epsilon kazein-kinaze I ili CK1ε, jest enzim koji je kod ljudi kodiran genom CSNK1E sa hromosoma 22.[5][6] To je homolog sisara za dvokorak. CK1ε je serin/treonin protein kinaza i veoma je konzerviran; stoga je ova kinaza vrlo slična ostalim članovima porodice kazein kinaza 1,[7] od kojih postoji sedam sisarskih izoformi (α , β, γ1, γ2, γ3, δ i ε).[8] CK1ε je po strukturi i funkciji najsličniji CK1δ jer ov dva enzima održavaju visoku sličnost sekvence na svojim regulatornim C-terminalom i katalitskim domenima.[8] Ovaj gen je glavna komponenta sisarskog oscilatora koji kontrolira cirkadijski ritam.[7] CK1ε je također bio uključen u modulaciju različitih ljudskih zdravstvenih probleme kao što su rak, neurodegenerativne bolesti i dijabetes.[8]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je aminokiselina, a molekulska težina Da.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MELRVGNKYR | LGRKIGSGSF | GDIYLGANIA | SGEEVAIKLE | CVKTKHPQLH | ||||
| IESKFYKMMQ | GGVGIPSIKW | CGAEGDYNVM | VMELLGPSLE | DLFNFCSRKF | ||||
| SLKTVLLLAD | QMISRIEYIH | SKNFIHRDVK | PDNFLMGLGK | KGNLVYIIDF | ||||
| GLAKKYRDAR | THQHIPYREN | KNLTGTARYA | SINTHLGIEQ | SRRDDLESLG | ||||
| YVLMYFNLGS | LPWQGLKAAT | KRQKYERISE | KKMSTPIEVL | CKGYPSEFST | ||||
| YLNFCRSLRF | DDKPDYSYLR | QLFRNLFHRQ | GFSYDYVFDW | NMLKFGAARN | ||||
| PEDVDRERRE | HEREERMGQL | RGSATRALPP | GPPTGATANR | LRSAAEPVAS | ||||
| TPASRIQPAG | NTSPRAISRV | DRERKVSMRL | HRGAPANVSS | SDLTGRQEVS | ||||
| RIPASQTSVP | FDHLGK |
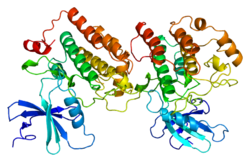
Snimanje strukture
urediSnimanje strukture CK1ε je 2012. godine izvršio Alexander Long i kolege koristeći kristalografiju X-zraka.[8] Određeni strukturni motivi povezani s kinazom su naknadno potvrđeni, kao što je okretanje β-lanca. Motiv -β-lanca učvršćuje ATP, DFG motiv koji orijentira ATP-fosfate, katalitsku petlju koja liči na onu kod PKA, i glavna mjesta za prepoznavanje supstrata u C-terminalnom domenu.[8]
Struktura
urediTrodimenzijske strukture katalitskih domena CK1δ i CK1ε sisara su prvi put riješene rendgenskom kristalografijom 1996. i 2012. godine.[8] CK1-kinaza ima više izoformi , uključujući ukupno sedam karakteriziranih kod sisara (alfa, beta, gama1-3, delta i epsilon.[9] Različite izoforme se uglavnom razlikuju po dužini i strukturi svog C-terminalnog nekatalitskog regiona.[9] Pokazalo se da samo izoforme delta i epsilon imaju važnu ulogu u regulaciji cirkadijskog ritma.<ref. name="Yang_2017"/>
CK1δ i CK1ε dijele veoma sličan obrazac u svojim strukturama.[9] Bogata glicinom P-petlja nalazi se između β1 i β2 niti, formirajući klasični β-lanac-zavoj motiva -β-lanca koji učvršćuje i steže alfa fosfat ATP-a.[8] CK1δ/ε dodatno dijele konzervirane karakteristike unutar katalitskog domena, koje se sastoje i od N-terminalna režnja i od α-heliksnog C-terminalnog režnja.[8] Katalitski centar nalazi se u području rascjepa između dva režnja, koji se također povezuje sa nukleotidom i supstratom.[8] Svi poznati inhibitori se vezuju za ovaj centar, blokirajući vezivanje ATP-a.[9]
Funkcija
urediEnzimska funkcija
urediProtein kodiran epsilon genom kazein-kinaze 1 je serin/treonin protein kinaza i član porodice proteina kazein-kinaza I, čiji su članovi uključeni u kontrolu citoplazmatskih i jedarnih procesa, uključujući replikaciju i popravak DNK. Kao i drugi članovi porodice proteinkih kazein-kinaza 1, kazein-kinaza 1 epsilon prepoznaje Ser (p)XXSer/Thr motiv za fosforilacije.[10] Nalazi se u citoplazmi kao monomer i može fosforilirati razne proteine, uključujući i samog sebe. Ova autofosforilacija događa se u proteinskim C-terminalnom domenu, regiji za koju se vjeruje da se ponaša kao pseudosubstrat i inhibira aktivnost kinaze.[7][11][12]
Cirkadijski sat
urediProtein kazein kinaze 1 epsilon je dio sisarskog oscilatora, grupe proteina koji održavaju ćelije na otprilike 24-satnom rasporedu.[13] Ovaj oscilator, ili "cirkadijski sat", sastoji se od petlja povratne informacije o transkripciji–translaciji (TTFL) u kojoj nekoliko proteina djeluje u tandemu, od kojih svaki reguliše ekspresiju drugih kako bi se stvorio otprilike 24-satni ciklus nivoa iRNK i proteina.[14] TTFL takođe generira otprilike 24-satne ritmove izlaza kao što su nivoi oslobađanja ćelijskih hormona.[15] Dnevne oscilacije transkripcija proteina i iRNK uočene su u mnogim ćelijama, uključujući glavni sat sisara poznat kao suprahijazmatsko jezgro (SCN).[16] Međutim, za razliku od većine proteina cirkadijskog ritma koji osciliraju u svojoj ekspresiji, kazein-kinaza 1 epsilon je konstitutivno aktivna.[15]
Osnovni proteini koji čine TTFL sisara uključuju Period (PER), kriptohrom (CRY), BMAL1, CLOCK i kazein-kinazu 1 epsilon.[17] BMAL1 i CLOCK rade na povećanju transkripcije PER i CRY, formiranjem heterodimera i vezivanjem na domene E-kutija uzvodno od sekvenci kodiranja gena PER i CRY.[17] Nivoi PER i CRY regulisani su negativnom povratnom spregom, što znači da potiskuju sopstvenu transkripciju.[17] Fosforilacija PER proteina pomoću CK1ε i u citoplazmi i u jedru označava ove proteine za degradaciju.[18] Fosforilacija također ometa sposobnost PER da uđe u jedro, izazivanjem konformacijske promjene u njegovoj sekvenci jedarne lokalizacije.[7][19][20] S druge strane, proteinski kompleks FBXL3 posreduje u razgradnji CRY proteina i u citoplazmi i u jedru.[21][22] Ako se CRY veže za PER prije nego što ga fosforilira CK1ε, ova tri proteina se stabiliziraju u kompleks koji može ući u jedro.[7] U jedru, PER i CRY rade na inhibiranju vlastite transkripcije dok kazein-kinaza 1 epsilon djeluje na modulaciji aktivnosti BMAL1 i CLOCK-a putem fosforilacije.[7]
Kao što je prethodno pomenuto, C-terminalni domen kazein-kinaze 1 epsilon ponaša se kao pseudosubstrat kada je fosforiliran, inhibirajući aktivnost kinaze.[7][11] Domen C-terminala je također pokazao da je defosforiliran pomoću fosfataze kao što je protein-fosfataza 1 (PP1) in vitro i u kulturi ćelija, koja regulira nivoe aktivne kazein-kinaze in vivo.[7][14][23] Važeća teorija cirkadijskih ritmova pretpostavlja da je ovaj ciklus fosforilacije/defosforilacije kazein-kinaze 1 epsilon važan u modulaciji perioda cirkadijskih ritmova u ćeliji, uz povećanu fosforilaciju koja smanjuje aktivnost kazein-kinaze 1 i uz naknadno povećanje aktivnog CRY i PER) i defosforilacija kazein-kinaze 1 epsilon, što rezultira aktivnijom kinazom (i nižim nivoima aktivnog CRY i PER).[14]
Kod miševa se pokazalo da kazein-kinaza 1 epsilon fosforilira i PER1 i PER2, kao i CRY1 i CRY2.[15] Kazein-kinaza 1 rezultira cikličkom ekspresijom proteina oscilatora sisara, što omogućava mjerače vremena (sisarske oscilatore) za ćeliju:[24]
| Nivo proteina | Međurezultat | Odgođeni rezultat | |
|---|---|---|---|
| Zora (7 sati ujutro) | Niska koncentracija proteina PER i CRY [25] | Per i Cry (gen) aktivno transkribovani i stimulirani transkripcijski faktori BMAL1 i CLOCK | N/A |
| Sumrak (19 sati) | Visoka koncentracija proteina PER i CRY[25] | Visoki nivoi proteina PER i CRY potiskuju transkripciju Per i Cry (gena) | Kazein-kinaza 1 epsilon fosforilira PER i CRY, označavajući protein za razgradnju: koncentracija PER i CRY proteina se smanjuje. |
Interakcije
urediPokazalo se da kazein-kinaza 1 epsilon reaguje sa PER1,[20] PER2, CRY1, CRY2, BMAL1, CLOCK, NPAS2 i AXIN1.[7][26] PER1, PER2 i BMAL1 mogu biti direktno fosforilirani pomoću CK1ɛ, dok PER3, CRY1 i CRY2 mogu biti fosforilirani samo pomoću CK1ɛ kada su povezani sa PER1 ili PER2.[13]
Inhibitori
urediBiotehnološke kompanije su proizvele nekoliko inhibitora kako bi olakšale istraživanje o funkciji kazein-kinaze 1 epsilon. Testiranje sa CK1ε inhibitorima je potvrdilo uključenost CK1ε u različite procese, posebno u regulaciji cirkadijskih ritmova.
Pf-670462 i PF-4800567
urediPF-670462, koji je razvio Pfizer, dobro je okarakterisan inhibitor i CK1ε i CK1δ za koji se pokazalo da produžava period cirkadijskih ritmova kada se daje in vitro fibroblastima pacova i COS ćelijama i miševima in vivo.[13][27][28] PF-4800567, koji je takođe razvio Pfizer, je specifičan inhibitor CK1ε. Međutim, njegova sposobnost da produži cirkadijske ritmove je slabija od one kod PF-670462 i kod modela "in vitro" fibroblasta pacova i "in vivo" modela miševa.[28] Mehanizmi inhibicije PF-670462 i PF-4800567 se također razlikuju između ove dvije molekule.[8] PF-670462 održava CK1ε/δ sa DFG motivom okrenutim prema unutra, dok PF-4800567 hidrofobno stupa u interakciju sa CK1ε/δ okretanjem DFG motiv prema van, što ukazuje na kinazu tip-II.[8]
IC261
urediIC261 je inhibitor koji cilja na ATP-vezujuće mjesto i CK1δ i CK1ε.[13][29] Slično tome, pokazalo se da produžava cirkadijski period kod fibroblasta pacova,[29] a uključen je u terapije za liječenje karcinoma pankreasa i neuroblastomskih karcinoma.[30]
Ostali
urediZa ostale CK1 inhibitore, kao što su D4476 i analozi pirazolopiridina, od kojih oba ciljaju CK1δ, okarakterizirano je da imaju terapeutske sposobnosti; međutim, njihovi korisni efekti nisu dobro proučeni i mogu proizaći iz drugih ćelijskih ciljeva.
Također pogledajte
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000213923 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000022433 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Fish KJ, Cegielska A, Getman ME, Landes GM, Virshup DM (June 1995). "Isolation and characterization of human casein kinase I epsilon (CKI), a novel member of the CKI gene family". The Journal of Biological Chemistry. 270 (25): 14875–83. doi:10.1074/jbc.270.25.14875. PMID 7797465.
- ^ Sakanaka C, Leong P, Xu L, Harrison SD, Williams LT (October 1999). "Casein kinase iepsilon in the wnt pathway: regulation of beta-catenin function". Proceedings of the National Academy of Sciences of the United States of America. 96 (22): 12548–52. doi:10.1073/pnas.96.22.12548. PMC 22983. PMID 10535959.
- ^ a b c d e f g h i Knippschild U, Gocht A, Wolff S, Huber N, Löhler J, Stöter M (June 2005). "The casein kinase 1 family: participation in multiple cellular processes in eukaryotes". Cellular Signalling. 17 (6): 675–89. doi:10.1016/j.cellsig.2004.12.011. PMID 15722192.
- ^ a b c d e f g h i j k Yang Y, Xu T, Zhang Y, Qin X (February 2017). "Molecular basis for the regulation of the circadian clock kinases CK1δ and CK1ε". Cellular Signalling. 31: 58–65. doi:10.1016/j.cellsig.2016.12.010. PMID 28057520.
- ^ a b c d "NCBI CDD CDD Conserved Protein Domain STKc_CK1_delta_epsilon". www.ncbi.nlm.nih.gov. Pristupljeno 2019-04-11.
- ^ Niefind K, Guerra B, Pinna LA, Issinger OG, Schomburg D (May 1998). "Crystal structure of the catalytic subunit of protein kinase CK2 from Zea mays at 2.1 A resolution". The EMBO Journal. 17 (9): 2451–62. doi:10.1093/emboj/17.9.2451. PMC 1170587. PMID 9564028.
- ^ a b Graves PR, Roach PJ (September 1995). "Role of COOH-terminal phosphorylation in the regulation of casein kinase I delta". The Journal of Biological Chemistry. 270 (37): 21689–94. doi:10.1074/jbc.270.37.21689. PMID 7665585.
- ^ Klimczak LJ, Farini D, Lin C, Ponti D, Cashmore AR, Giuliano G (October 1995). "Multiple isoforms of Arabidopsis casein kinase I combine conserved catalytic domains with variable carboxyl-terminal extensions". Plant Physiology. 109 (2): 687–96. doi:10.1104/pp.109.2.687. PMC 157637. PMID 7480353.
- ^ a b c d Etchegaray JP, Machida KK, Noton E, Constance CM, Dallmann R, Di Napoli MN, DeBruyne JP, Lambert CM, Yu EA, Reppert SM, Weaver DR (July 2009). "Casein kinase 1 delta regulates the pace of the mammalian circadian clock". Molecular and Cellular Biology. 29 (14): 3853–66. doi:10.1128/MCB.00338-09. PMC 2704743. PMID 19414593.
- ^ a b c Richards J, Gumz ML (September 2012). "Advances in understanding the peripheral circadian clocks". FASEB Journal. 26 (9): 3602–13. doi:10.1096/fj.12-203554. PMC 3425819. PMID 22661008.
- ^ a b c Ko CH, Takahashi JS (October 2006). "Molecular components of the mammalian circadian clock". Human Molecular Genetics. 15 Spec No 2 (suppl 2): R271-7. doi:10.1093/hmg/ddl207. PMID 16987893.
- ^ Meijer JH, Michel S, Vanderleest HT, Rohling JH (December 2010). "Daily and seasonal adaptation of the circadian clock requires plasticity of the SCN neuronal network". The European Journal of Neuroscience. 32 (12): 2143–51. doi:10.1111/j.1460-9568.2010.07522.x. PMID 21143668. S2CID 12754517.
- ^ a b c Takahashi JS (March 2017). "Transcriptional architecture of the mammalian circadian clock". Nature Reviews Genetics. 18 (3): 164–179. doi:10.1038/nrg.2016.150. PMC 5501165. PMID 27990019.
- ^ Blau J (July 2008). "PERspective on PER phosphorylation". Genes & Development. 22 (13): 1737–40. doi:10.1101/gad.1696408. PMC 2732424. PMID 18593875.
- ^ Akashi M, Tsuchiya Y, Yoshino T, Nishida E (March 2002). "Control of intracellular dynamics of mammalian period proteins by casein kinase I epsilon (CKIepsilon) and CKIdelta in cultured cells". Molecular and Cellular Biology. 22 (6): 1693–703. doi:10.1128/MCB.22.6.1693-1703.2002. PMC 135601. PMID 11865049.
- ^ a b Vielhaber E, Eide E, Rivers A, Gao ZH, Virshup DM (July 2000). "Nuclear entry of the circadian regulator mPER1 is controlled by mammalian casein kinase I epsilon". Molecular and Cellular Biology. 20 (13): 4888–99. doi:10.1128/MCB.20.13.4888-4899.2000. PMC 85940. PMID 10848614.
- ^ Liu N, Zhang EE (2016-09-23). "Phosphorylation Regulating the Ratio of Intracellular CRY1 Protein Determines the Circadian Period". Frontiers in Neurology. 7: 159. doi:10.3389/fneur.2016.00159. PMC 5033960. PMID 27721804.
- ^ Yoo SH, Mohawk JA, Siepka SM, Shan Y, Huh SK, Hong HK, Kornblum I, Kumar V, Koike N, Xu M, Nussbaum J, Liu X, Chen Z, Chen ZJ, Green CB, Takahashi JS (February 2013). "Competing E3 ubiquitin ligases govern circadian periodicity by degradation of CRY in nucleus and cytoplasm". Cell. 152 (5): 1091–105. doi:10.1016/j.cell.2013.01.055. PMC 3694781. PMID 23452855.
- ^ Gietzen KF, Virshup DM (November 1999). "Identification of inhibitory autophosphorylation sites in casein kinase I epsilon". The Journal of Biological Chemistry. 274 (45): 32063–70. doi:10.1074/jbc.274.45.32063. PMID 10542239.
- ^ Eide EJ, Kang H, Crapo S, Gallego M, Virshup DM (2005). "Casein kinase I in the mammalian circadian clock". Methods in Enzymology. 393: 408–18. doi:10.1016/S0076-6879(05)93019-X. ISBN 9780121827984. PMC 1513158. PMID 15817302.
- ^ a b Partch CL, Green CB, Takahashi JS (February 2014). "Molecular architecture of the mammalian circadian clock". Trends in Cell Biology. 24 (2): 90–9. doi:10.1016/j.tcb.2013.07.002. PMC 3946763. PMID 23916625.
- ^ Zhang Y, Qiu WJ, Chan SC, Han J, He X, Lin SC (May 2002). "Casein kinase I and casein kinase II differentially regulate axin function in Wnt and JNK pathways". The Journal of Biological Chemistry. 277 (20): 17706–12. doi:10.1074/jbc.M111982200. PMID 11884395.
- ^ Smadja Storz S, Tovin A, Mracek P, Alon S, Foulkes NS, Gothilf Y (2013-01-21). "Casein kinase 1δ activity: a key element in the zebrafish circadian timing system". PLOS ONE. 8 (1): e54189. Bibcode:2013PLoSO...854189S. doi:10.1371/journal.pone.0054189. PMC 3549995. PMID 23349822.
- ^ a b Badura L, Swanson T, Adamowicz W, Adams J, Cianfrogna J, Fisher K, Holland J, Kleiman R, Nelson F, Reynolds L, St Germain K, Schaeffer E, Tate B, Sprouse J (August 2007). "An inhibitor of casein kinase I epsilon induces phase delays in circadian rhythms under free-running and entrained conditions". The Journal of Pharmacology and Experimental Therapeutics. 322 (2): 730–8. doi:10.1124/jpet.107.122846. PMID 17502429. S2CID 85875627.
- ^ a b Kon N, Sugiyama Y, Yoshitane H, Kameshita I, Fukada Y (2015-07-25). "Cell-based inhibitor screening identifies multiple protein kinases important for circadian clock oscillations". Communicative & Integrative Biology. 8 (4): e982405. doi:10.4161/19420889.2014.982405. PMC 4594307. PMID 26478783.
- ^ Knippschild U, Krüger M, Richter J, Xu P, García-Reyes B, Peifer C, Halekotte J, Bakulev V, Bischof J (2014). "The CK1 Family: Contribution to Cellular Stress Response and Its Role in Carcinogenesis". Frontiers in Oncology (jezik: engleski). 4: 96. doi:10.3389/fonc.2014.00096. PMC 4032983. PMID 24904820.