Epitelni natrijev kanal
Epitelni natrijev kanal (ENaC), (također poznat kao natrij-kanal osetljiv na amilorid) je membranom vezan ionski kanal koji je selektivno propustljiv za natrijeve ione (Na+
). Sastavljen je kao heterotrimerod tri homologne podjedinice α ili δ, β i γ,[2] Ove podjedinice kodiraju četiri gena: SCNN1A, SCNN1B, SCNN1G i SCNN1D. ENaC je prvenstveno uključen u reapsorpciju iona natrija u sabirnim kanalimaima bubrežnih nefrona. Osim što su umiješani u bolesti kod kojih je poremećena ravnoteža tekućine kroz epitelne membrane, uključujući plućni edem, cistastu fibrozu, KOPB i COVID-19, proteolizirani oblici ENaC funkcionišu kao ljudski receptor okusa soli.[3]
| Epitelni natrijski kanal | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
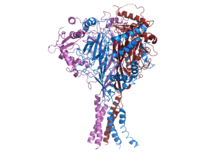 Struktura ljudskog ENaC.[1] | |||||||||||
| Identifikatori | |||||||||||
| Simbol | ASC | ||||||||||
| Pfam | PF00858 | ||||||||||
| InterPro | IPR001873 | ||||||||||
| PROSITE | PDOC00926 | ||||||||||
| SCOP2 | 6BQN / SCOPe / SUPFAM | ||||||||||
| TCDB | 1.A.6 | ||||||||||
| OPM superporodica | 181 | ||||||||||
| OPM protein | 4fz1 | ||||||||||
| |||||||||||
Apikalne membrane mnogih zategnutih epitela sadrže natrijeve kanale koje karakteriše prvenstveno njihov visok afinitet za diuretički blokator amilorid.[2][4][5][6] Ovi kanali posreduju u prvom koraku aktivne reapsorpcije natrija koji je neophodan za održavanje homeostaze soli i vode u tijelu.[4] Kod kičmenjaka, kanali kontroliraju reapsorpciju natrija u bubrezima, debelom crijevu, plućima i znojnim žlijezdama; oni takođe imaju ulogu u percepciji okusa.
Epitelni natrijski kanali su strukturno i vjerovatno evolucijski povezani sa P2X purinoreceptorim, receptorima za bol koji se aktiviraju kada otkriju ATP.
Lokacija i funkcija
urediENaC se nalazi u apikalnoj membrani polarizovanih epitelnih ćelija, posebno u bubregu (prvenstveno u sabirnoj tubuli), plućima, koži,[7] muškom i ženskom reproduktivnom traktu i debelom crijevu.[2][8][9] Epitelni natrijski kanali olakšavaju reapsorpciju Na⁺ preko apikalnih membrana epitela u distalnim nefronima, respiratornom i reproduktivnom traktu i egzokrinim žlijezdama. Pošto je koncentracija Na⁺ iona glavna determinanta vanćelijske tečnosti osmolarnosti, promjene u koncentraciji Na⁺ utiču na kretanje tečnosti i posljedično na zapreminu tečnosti i krvni pritisak. Aktivnost ENaC u debelom crijevu i bubrezima modulira mineralokortikoidni aldosteron. Može ga blokirati ili triamteren ili amilorid, koji se medicinski koriste kao diuretici. U bubrezima ga inhibira pretkomorski natriuretski peptid, uzrokujući natriurezu i diurezu.
Epitelni Na+ kanali (ENaCs) u mozgu imaju značajnu ulogu u regulaciji krvnog pritiska.[10] Vazopresinski neuroni (VP) imaju ključnu ulogu u koordinaciji neuroendokrinih i autonomnih odgovora za održavanje kardiovaskularne homeostaze. Visok unos soli u ishrani uzrokuje povećanje ekspresije i aktivnosti ENaC, što rezultira depolarizacijom VP neurona u stabilnom stanju.[10] Ovo je jedan od mehanizama koji leže u osnovi kako unos soli u ishrani utiče na aktivnost VP neurona putem aktivnosti ENaC. ENaC kanali u mozgu uključeni su u odgovor krvnog pritiska na natrij iz hrane.
Studije imunofluorescencija visoke rezolucije otkrile su da se u respiratornom traktu i ženskom reproduktivnom traktu ENaC nalazi duž cijele dužine cilija koje pokrivaju površinu višestrukih ćelija.[8] Dakle, u ovim epitelima s pokretnim cilijama, ENaC funkcionira kao regulator osmolarnosti pericilijske tekućine, a njegova funkcija je neophodna za održavanje volumena tekućine na dubini potrebnoj za pokretljivost cilija. U respiratornom traktu ovo kretanje je neophodno za čišćenje površine sluzokože, a u ženskom reproduktivnom traktu pokretljivost cilija je neophodna za kretanje oocita.[8]
Za razliku od ENaC, CFTR koji reguliše transport hloridnih iona nije pronađen na cilijama. Ovi nalazi su u suprotnosti s prethodnom hipotezom da se ENaC smanjuje direktnom interakcijom sa CFTR. Kod pacijenata sa cistastom fibrozom (CF), CFTR ne može smanjiti ENaC, uzrokujući hiperapsorpciju u plućima i ponavljajuće infekcije pluća. Sugerirano je da bi to mogao biti ligand-vođeni ionski kanal.[11]
U epidermalnim slojevima kože, ENaC se eksprimira u keratinocitima, lojnim žlijezdama i ćelijama glatkih mišića.[7] U ovim ćelijama ENaC se uglavnom nalazi u citoplazmi.[7] U ekkrinim znojnim žlezdama, ENaC se pretežno nalazi u apikalnoj membrani okrenutoj prema lumenu znojnih kanala.[7] Glavna funkcija ENaC-a u ovim kanalima je ponovno preuzimanje Na⁺ iona koji se izlučuju znojem. Kod pacijenata sa mutacijama EnaC, koje uzrokuju sistemski pseudohipoaldosteronizam tipa I, pacijenti mogu izgubiti značajnu količinu iona Na⁺, posebno u vrućim klimama.
ENaC se takođe nalazi u receptorima okusa, gdje ima važnu ulogu u percepciji slanosti. Kod glodara, skoro cio okus soli je posredovan ENaC-om, dok se čini da ima manje značajnu ulogu kod ljudi: oko 20 procenata može biti akreditovano za epitelni natrijski kanal.
Protoelizirane varijante ENaC-a također funkcionišu kao ljudski receptori okusa soli. Ova uloga je prvi put potvrđena korištenjem ljudskih senzornih studija kako bi se procijenio učinak 4-propilfenil 2-furoata na percepciju slanog okusa kuhinjske soli, natrij-hlorida (NaCl). 4-propilfenil 2-furoat je spoj za koji je otkriveno da aktivira proteolizirani ENaC.[3]
Ionska selektivnost
urediStudije pokazuju da je ENaC kanal propustljiv za Na+
i ione Li+
, ali ima vrlo malu propusnost za K+
, Cs+
ili Rb+
ioni.[12][13]
Transportna reakcija
urediGeneralizirana transportna reakcija za Na+
kanale je:
- Na+
(izlaz) → Na+
(ulaz)
To za degenerine je:
- Kation (izlaz) → kation (ulaz)
Struktura
urediENaC se sastoji od tri različite podjedinice:α, β, γ.[2][14] Sve tri podjedinice su neophodne za transport do membranskog sklopa funkcionalnih kanala na membrani.[15] C-terminal svake ENaC podjedinice sadrži PPXY motiv koji kada se mutira ili deletira u β- ili γ-ENaC podjedinici dovodi do Liddleovog sindroma, ljudskog autosomno dominantnog oblika hipertenzijeni. cryoEM struktura ENaC-a ukazuje da je kanal heterotrimerni protein poput ionskog kanala osjetljivog na kiselinu 1. (ASIC1) , koji pripada istoj porodici.[1][16] Svaka od podjedinica sastoji se od dvije transmembranske spirale i vanćelijske petlje. Sva tri polipeptida amino- i karboksi-kraja nalaze se u citosolu.
Kristalna struktura ASIC1 i studije mutageneze usmjerene na mjesto sugeriraju da ENaC ima centralni ionski kanal smješten duž centralne ose simetrije između tri podjedinice.[13][17]
Što se tiče strukture, proteini koji pripadaju ovoj porodici sastoje se od oko 510 do 920 aminokiselinskih ostataka. Sastoje se od unutarćelijskog N-terminalnog regiona praćenog transmembranskom domenom, velikom vanćelijskom petljom, drugim transmembranskim segmentom i C-terminalnim unutarćelijskim repom.
Geni
urediArhitektura egzon-introna tri gena koji kodiraju tri podjedinice ENaC ostala je visoko konzervirana uprkos divergenciji njihovih sekvenci.[18]
Postoje četiri povezana natrijeva kanala osjetljiva na amilorid:
Klinički značaj
urediInterakcija ENaC sa CFTR je od važne patofiziološke važnosti za cistastu fibrozu. CFTR je transmembranski kanal odgovoran za transport hlorida i defekti u ovom proteinu uzrokuju cistasatu fibrozu, dijelom kroz regulaciju ENaC kanala u odsustvu funkcionalnog CFTR.
U disajnim putevima, CFTR omogućava "lučenje" hlorida, a ioni natrija i voda prate pasivno. Međutim, u odsustvu funkcionalnog CFTR-a, ENaC kanal se pojačava i dodatno smanjuje lučenje soli i vode, reapsorbujući ione natrija. Kao takve, respiratorne komplikacije kod cistaste fibroze nisu samo uzrokovane nedostatkom lučenja hlorida, već umjesto toga povećanjem reapsorpcije natrija i vode. To rezultira taloženjem guste, dehidrirane sluzi, koja se skuplja u respiratornom traktu, ometajući razmjenu plinova i omogućavajući skupljanje bakterija.[19] Ipak, povećanje CFTR-a ne ispravlja uticaj visokoaktivnog ENaC-a.[20] Vjerovatno su drugi proteini koji djeluju u interakciji neophodni za održavanje funkcionalne homeostaze iona u epitelnom tkivu pluća, poput kalijevih kanala, akvaporina ili Na/K-ATPaza.[21]
U znojnim žlijezdama, CFTR je odgovoran za „reapsorpciju“ hlorida u znojnom kanalu. Ioni natrija prate pasivno kroz ENaC kao rezultat elektrohemijskog gradijenta uzrokovanog protokom hlorida. Ovo smanjuje gubitak soli i vode. U nedostatku protoka hlorida kod cistaste fibroze, ioni natrija ne prolaze kroz ENaC, što dovodi do većeg gubitka soli i vode. (Ovo je tačno uprkos povećanju regulacije ENaC kanala, jer je protok u znojnim kanalima ograničen elektrohemijskim gradijentom koji je uspostavljen protokom hlorida kroz CFTR.) Kao takva, koža pacijenata ima slani okus, i to se obično koristi da pomogne u dijagnostici bolesti, kako u prošlosti tako i danas modernim električnim testovima.[22]
Mutacije povećanja funkcije na β i γ podjedinicama povezane su sa Liddleovim sindromom.[23]
Amilorid i triamteren su diuretici koji štede kalij, koji djeluju kao blokatori epitelnih natrijskih kanala.
Reference
uredi- ^ a b Noreng S, Bharadwaj A, Posert R, Yoshioka C, Baconguis I (septembar 2018). "Structure of the human epithelial sodium channel by cryo-electron microscopy". eLife. 7: e39340. doi:10.7554/eLife.39340. PMC 6197857. PMID 30251954.
- ^ a b c d Hanukoglu I, Hanukoglu A (april 2016). "Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases". Gene. 579 (2): 95–132. doi:10.1016/j.gene.2015.12.061. PMC 4756657. PMID 26772908.
- ^ a b Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (mart 2021). "Cell engineering method using fluorogenic oligonucleotide signaling probes and flow cytometry". Biotechnology Letters. 43 (5): 949–958. doi:10.1007/s10529-021-03101-5. PMC 7937778. PMID 33683511.
- ^ a b Garty H (maj 1994). "Molecular properties of epithelial, amiloride-blockable Na+ channels". FASEB Journal. 8 (8): 522–8. doi:10.1096/fasebj.8.8.8181670. PMID 8181670. S2CID 173677.
- ^ Le T, Saier MH (1996). "Phylogenetic characterization of the epithelial Na+ channel (ENaC) family". Molecular Membrane Biology. 13 (3): 149–57. doi:10.3109/09687689609160591. PMID 8905643.
- ^ Waldmann R, Champigny G, Bassilana F, Voilley N, Lazdunski M (novembar 1995). "Molecular cloning and functional expression of a novel amiloride-sensitive Na+ channel". The Journal of Biological Chemistry. 270 (46): 27411–4. doi:10.1074/jbc.270.46.27411. PMID 7499195.
- ^ a b c d Hanukoglu I, Boggula VR, Vaknine H, Sharma S, Kleyman T, Hanukoglu A (juni 2017). "Expression of epithelial sodium channel (ENaC) and CFTR in the human epidermis and epidermal appendages". Histochemistry and Cell Biology. 147 (6): 733–748. doi:10.1007/s00418-016-1535-3. PMID 28130590. S2CID 8504408.
- ^ a b c Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A (mart 2012). "Epithelial sodium channels (ENaC) are uniformly distributed on motile cilia in the oviduct and the respiratory airways". Histochemistry and Cell Biology. 137 (3): 339–53. doi:10.1007/s00418-011-0904-1. PMID 22207244. S2CID 15178940.
- ^ Sharma S, Hanukoglu A, Hanukoglu I (april 2018). "Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa". Journal of Molecular Histology. 49 (2): 195–208. doi:10.1007/s10735-018-9759-2. PMID 29453757. S2CID 3761720.
- ^ a b Sharma K, Haque M, Guidry R, Ueta Y, Teruyama R (septembar 2017). "Effect of dietary salt intake on epithelial Na+ channels (ENaC) in vasopressin magnocellular neurosecretory neurons in the rat supraoptic nucleus". The Journal of Physiology. 595 (17): 5857–5874. doi:10.1113/JP274856. PMC 5577521. PMID 28714095.
- ^ Horisberger JD, Chraïbi A (2004). "Epithelial sodium channel: a ligand-gated channel?". Nephron Physiology. 96 (2): 37–41. doi:10.1159/000076406. PMID 14988660. S2CID 24608792.
- ^ Happle R (oktobar 1990). "Ptychotropism as a cutaneous feature of the CHILD syndrome". Journal of the American Academy of Dermatology. 23 (4 Pt 1): 763–6. doi:10.1016/0190-9622(90)70285-p. PMID 2229513.
- ^ a b Hanukoglu I (februar 2017). "ASIC and ENaC type sodium channels: conformational states and the structures of the ion selectivity filters". The FEBS Journal. 284 (4): 525–545. doi:10.1111/febs.13840. PMID 27580245. S2CID 24402104.
- ^ Loffing J, Schild L (novembar 2005). "Functional domains of the epithelial sodium channel". Journal of the American Society of Nephrology. 16 (11): 3175–81. doi:10.1681/ASN.2005050456. PMID 16192417.
- ^ Edelheit O, Hanukoglu I, Dascal N, Hanukoglu A (april 2011). "Identification of the roles of conserved charged residues in the extracellular domain of an epithelial sodium channel (ENaC) subunit by alanine mutagenesis". American Journal of Physiology. Renal Physiology. 300 (4): F887-97. doi:10.1152/ajprenal.00648.2010. PMID 21209000.
- ^ Jasti J, Furukawa H, Gonzales EB, Gouaux E (septembar 2007). "Structure of acid-sensing ion channel 1 at 1.9 A resolution and low pH". Nature. 449 (7160): 316–23. Bibcode:2007Natur.449..316J. doi:10.1038/nature06163. PMID 17882215.
- ^ Edelheit O, Ben-Shahar R, Dascal N, Hanukoglu A, Hanukoglu I (april 2014). "Conserved charged residues at the surface and interface of epithelial sodium channel subunits--roles in cell surface expression and the sodium self-inhibition response". The FEBS Journal. 281 (8): 2097–111. doi:10.1111/febs.12765. PMID 24571549. S2CID 5807500.
- ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A (novembar 1998). "Gene structure of the human amiloride-sensitive epithelial sodium channel beta subunit". Biochemical and Biophysical Research Communications. 252 (1): 208–13. doi:10.1006/bbrc.1998.9625. PMID 9813171.
- ^ Mall M, Grubb BR, Harkema JR, O'Neal WK, Boucher RC (maj 2004). "Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice". Nature Medicine. 10 (5): 487–93. doi:10.1038/nm1028. PMID 15077107. S2CID 45366866.
- ^ Grubb BR, O'Neal WK, Ostrowski LE, Kreda SM, Button B, Boucher RC (januar 2012). "Transgenic hCFTR expression fails to correct β-ENaC mouse lung disease". American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (2): L238-47. doi:10.1152/ajplung.00083.2011. PMC 3349361. PMID 22003093.
- ^ Toczyłowska-Mamińska R, Dołowy K (februar 2012). "Ion transporting proteins of human bronchial epithelium". Journal of Cellular Biochemistry. 113 (2): 426–32. doi:10.1002/jcb.23393. PMID 21975871. S2CID 31970069.
- ^ Berdiev BK, Qadri YJ, Benos DJ (februar 2009). "Assessment of the CFTR and ENaC association". Molecular BioSystems. 5 (2): 123–7. doi:10.1039/B810471A. PMC 2666849. PMID 19156256.
- ^ Ion Channel Diseases
Vanjski linkovi
uredi- Epithelial sodium channel na US National Library of Medicine Medical Subject Headings (MeSH)