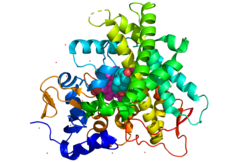
CYP21A2
Steroid 21-hidroksilaza, znana i kao citohrom P450c21, steroid 21-monooksigenaza, 21α-hidroksilaza i, manje uobičajeno, 21β-hidroksilaza, jest enzim koji je kod ljudi kodiran genom CYP21A2. Hidroksilira steroide na poziciji C21[13][14] i uključen je u biosintezu aldosterona i kortizola. Enzim pretvara progesteron i 17α-hidroksiprogesteron u 11-deoksikortikosteron i 11-deoksikortizol[15][16] unutar metaboličkih puteva koji na kraju dovode do aldosterona i kortizola. Nedostatak enzima može uzrokovati urođenu nadbubrežnu hiperplaziju.
| Steroidna 21-hidroksilaza | |
|---|---|
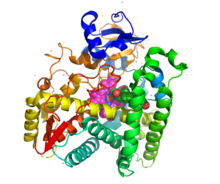 | |
| Identifikatori | |
| Simbol | CYP21A2 |
| Alt. nazivi | P45021A2, CYP21A2, citohrom P450c21,[5][6][7] steroid 21-monooksigenaza,[8] 21-hidroksilaza, 21α-hidroksilaza,[9][10] 21β-hidroksilaza[11][12] |
| CAS broj | |
Steroidna 21-hidroksilaza je član porodice citohrom P450, enzima monooksigenaza koja koristi gvožđe koje sadrži hem kofaktor za oksidaciju supstrata. Enzim je lokaliziran u endoplazmatskom retikulumu membrana kore nadbubrežne žlijezde,[17][18] i kodiran je CYP21A2, koji se nalazi u blizini pseudogena CYP21A1P sa visokim stepenom sličnosti sekvenci. Ova sličnost otežava analizu gena na molekulskom nivou, a ponekad dovodi do mutacija sa gubitkom funkcije gena zbog međugenske razmjene DNK.
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 494 aminokiseline, а molekulska težina 55.887 Da.[19]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MLLLGLLLLP | LLAGARLLWN | WWKLRSLHLP | PLAPGFLHLL | QPDLPIYLLG | ||||
| LTQKFGPIYR | LHLGLQDVVV | LNSKRTIEEA | MVKKWADFAG | RPEPLTYKLV | ||||
| SKNYPDLSLG | DYSLLWKAHK | KLTRSALLLG | IRDSMEPVVE | QLTQEFCERM | ||||
| RAQPGTPVAI | EEEFSLLTCS | IICYLTFGDK | IKDDNLMPAY | YKCIQEVLKT | ||||
| WSHWSIQIVD | VIPFLRFFPN | PGLRRLKQAI | EKRDHIVEMQ | LRQHKESLVA | ||||
| GQWRDMMDYM | LQGVAQPSME | EGSGQLLEGH | VHMAAVDLLI | GGTETTANTL | ||||
| SWAVVFLLHH | PEIQQRLQEE | LDHELGPGAS | SSRVPYKDRA | RLPLLNATIA | ||||
| EVLRLRPVVP | LALPHRTTRP | SSISGYDIPE | GTVIIPNLQG | AHLDETVWER | ||||
| PHEFWPDRFL | EPGKNSRALA | FGCGARVCLG | EPLARLELFV | VLTRLLQAFT | ||||
| LLPSGDALPS | LQPLPHCSVI | LKMQPFQVRL | QPRGMGAHSP | GQNQ |
Funkcija
urediEnzim steroidna 21-hidroksilaza hidroksilira steroid na položaju C21.[16] Enzim katalizira reakciju u kojoj se hidroksil grupa (–OH) dodaje na položaju C21 biomolekula steroida.
Enzim je član nadporodice citohtoma P450. Steroidno numerisanje, C21 je u bočnom lancu C17. Enzim steroidna 21-hidroksilaza hidroksilati steroid nalazi se na položaju C21.[16] Enzim katalizira hemijsku reakciju u kojoj se hidroksil grupa (–OH) dodaje na položaju C21 steroidnih biomolekula.
Enzim je član nadporodice citohrom P450 monooksigenaznih enzima. Enzimi citohroma P450 kataliziraju mnoge reakcije uključene u metabolizam lijekova i sintezu holesterola, steroida i drugih lipida.
21-hidroksilaza je lokalizirana u mikrosommima endoplazmatskoretikulumskih membrana unutar kore nadbubrežne žlijezde. Jedan je od tri mikrosomna steroidogena enzima P450, a drugi su 17-hidroksilaza i aromataza.[20]
21-hidroksilaza je esencijalna za biosintezu kortizola i aldosterona.[21][22]
Struktura
uredi21-hidroksilaza, kao član porodice citohroma P450, enzima monooksigenaza, sadrži konzervirano jezgro od četiri snopa α-heliksa, dva dodatna alfa-heliksa, dva skupa β-listova i hem kofaktorska vezna petlja.[23] Svaka podjedinica u ljudskom enzimu sastoji se od ukupno 13 α-helika i devet β-niti koje se savijaju u trouglastu prizmu tercijarnu strukturu.[15] Gvožđe (III) grupe hema koja definira aktivno mjesto nalazi se u središtu svake podjedinice. Ljudski enzim veže jedan po jedan supstrat.[15] Nasuprot tome, dobro karakterizirani goveđi enzim može vezati dva supstrata.[24] Ljudski i goveđi enzim dijele 80% identiteta aminokiselinske sekvence, ali se strukturno razlikuju, posebno u regijama petlje, a također su evidentni u elementima sekundarne strukture.[15]
Mehanizam
uredi21-hidroksilaza je enzim citohroma P450 koji je značajan po specifičnosti supstrata) i relativno visokoj katalitskoj efikasnosti. Varijacije enzima 21-hidroksilaze mogu se naći u svim kičmenjacima.[25]
Kao i drugi enzimi citohroma P450, 21-hidroksilaza učestvuje u katalitski ciklus citohroma P450 i učestvuje u jednoelektronskom prijenosu sa NADPH-P450 reduktazom. 21-hidroksilaza je visoko specifična za hidroksilaciju progesterona i 17-hidroksiprogesterona. Ovo je u izrazitoj suprotnosti sa evolucijski i funkcionalno povezanim enzimom P450 17-hidroksilaza, koji ima širok raspon supstrata.[26]
Hemijska reakcija u kojoj 21-hidroksilaza katalizira dodavanje hidroksila (–OH) u položaj C21 progesterona, 17α-hidroksiprogesterona i 21-dezoksikortizona[27] opisana je prvi puta 1952.[28]
Studije ljudskog enzima eksprimiranog u kvascima prvotno su klasificirale 17-hidroksiprogesteron kao preferirani supstrat za 21-hidroksilazu,[26][29][30] i veću katalitsku efikasnost za progesteron u odnosu na 17-hidroksiprogesteron.[15]
Katalitska efikasnost 21-hidroksilaze za konverziju progesterona kod ljudi je približno 11,3 x 107 M−1s−1 na 37 °C. To ga čini katalitski najefikasnijim enzimom P450 od svih do sada prijavljenih, a efikasnijim i od blisko povezanog enzima goveđe 21-hidroksilaze.[17] CH prekid veze za stvaranje primarnog ugljikovog radikala smatra se korakom ograničavanja brzine u hidroksilaciji.[15]
Genetika
uredi| CYP21A2 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||
| Identifikatori | |||||||||||||||||||||||||
| Aliasi | CYP21A2 | ||||||||||||||||||||||||
| Vanjski ID-jevi | OMIM: 613815 MGI: 88591 HomoloGene: 68063 GeneCards: CYP21A2 | ||||||||||||||||||||||||
| EC broj | 1.14.14.16,1.14.14.16 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortolozi | |||||||||||||||||||||||||
| Vrste | Čovjek | Miš | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl |
| ||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNK) | |||||||||||||||||||||||||
| RefSeq (bjelančevina) |
| ||||||||||||||||||||||||
| Lokacija (UCSC) | Chr 6: 32.04 – 32.04 Mb | Chr 17: 35.02 – 35.02 Mb | |||||||||||||||||||||||
| PubMed pretraga | [31] | [32] | |||||||||||||||||||||||
| Wikipodaci | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
21-hidroksilaza je protein koji je kod ljudi kodiran genom CYP21A2 . Srodni pseudogen, CYP21A1P , nalazi se u blizini i zadržava 98% identiteta egzonske sekvence sa funkcionalnim genom CYP21A2. Oba gena se nalaze na hromosomu 6, u glavnom kompleksu histokompatibilnosti MHC klasa III.[33][34][35] blizu gena za komplementnu komponentu 4 C4A i C4B, gena tenascin X TNXB i STK19.[36]
U mišjem genomu, CYP21A2 je pseudogen, a CYP21A1 je funkcionalni gen.[37] U kokošiju i prepelica postoji samo jedan gen CYP21, čiji se lokus nalazi između komponente komplementa C4 i TNX gena, zajedno sa CENPA.[38]
Gen CYP21A2 prenosi se u tandemu sa pseudogenom, CYP21P1, a visok stupanj sličnosti sekvenci među njima ukazuje da ova dva gena evoluiraju u tandemu putem međugenske razmjene DNK.[39] Gen CYP21A2 nalazi se unutar klastera RCCX (kratica sastavljena od naziva gena RP, C4, CYP21 i TNX),[40] koji je najsloženiji genski klaster u ljudskom genomu.[41] Dio je glavnog kompleksa histokompatibilnosti klase III (MHC klasa III),[35] koji je genima najgušća regija u ljudskom genomu, csa mnogim genima koji do sada nepaju poznatu fdunkciju ili strukturu.[42] Zbog visokog stupnja homologije između gena "CYP21A2" i pseudogena "CYP21P1" i složenosti lokusa, teško je proučavati gen "CYP21A2" na molekulnom nivou.[43]
Klinički značaj
urediUrođena adrenalna hiperplazija
urediGenetičke varijante u genu CYP21A2 uzrokuju poremećaj u razvoju enzima, što dovodi do kongenitalne adrenalne hiperplazije (CAH) zbog nedostatka 21-hidroksilaze. Konverzija gena je događaj koji uključuje funkcionalni gen i pseudogen, uzrokujući mnoge slučajeve nedostatka steroidne 21-hidroksilaze.[13] CAH je autosomno recesivni poremećaj. Postoji više oblika CAH-a, podijeljenih na klasične i neklasične, na osnovu količine zadržane enzimske funkcije.
Klasični oblici javljaju se otprilike u 1 10.000 do 1 u 20.000 rođenja globalno,[22][44] i uključuju soli-rasipne i jednostavne virilizujuće forme. Potpuni gubitak enzimske aktivnosti uzrokuje gubitak soli. Varijacije u strukturi 21-hidroksilaze povezane su s kliničkom težinom kongenitalne adrenalne hiperplazije. Deficit kortizola i aldosterona povezan je sa životno ugrožavajućim gubitkom soli (stoga i trošenjem soli), jer steroidi imju ulogu u regulaciji homeostaze. natrija. Pacijenti s CAH-om koji se jednostavno virilizuje (~1-2% enzimske funkcije)[22] održavaju odgovarajuću homeostazu natrija, ali pokazuju i druge simptome slične obliku trošenja soli, uključujući ubrzani rast u djetinjstvu i dvosmislene genitalije kod novorođenčadi.
Neklasični oblik je najblaži, zadržavajući oko 20% do 50% funkcije enzima.[22] Ovaj oblik je povezan s blagim i klinički tihim oštećenjem kortizola,[44] ali višak androgena nakon puberteta.[45]
Neklasična kongenitalna nadbubrežna hiperplazija
urediNeklasična kongenitalna nadbubrežna hiperplazija uzrokovana nedostatkom 21-hidroksilaze (NCCAH) je blaža i kasna kongenitalna kongenitalna hiperplazija nadbubrežne žlijezde. Stopa njegove prevalencije u različitim etničkim grupama varira od 1/1000 do 1/50.[22] Neki ljudi pogođeni ovim stanjem nemaju relevantne znakove i simptome , dok drugi imaju simptome hiperandrogenizma.[22][44][45]
Žene sa NCCAH-om obično imaju normalne ženske genitalije pri rođenju. U kasnijem životu znakovi i simptomi stanja mogu uključivati akne, hirzutizam, ćelavost po muškom obrascu, neredovne menstruacije i neplodnost.[22][44][46]
Manje je studija objavljeno o muškarcima s NCCAH u usporedbi s onima o ženama, jer su muškarci općenito asimptomski.[22][46] Muškarci, međutim, mogu imati akne [47][48] i rano ćelavljenje.[49][50]
Dok se simptomi obično dijagnosticiraju nakon puberteta, kod djece se mogu javiti prerane adrenarhe.[51]
Također pogledajte
urediReference
uredi- ^ a b c d e f ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 GRCh38: Ensembl release 89: ENSG00000198457, ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 - Ensembl, maj 2017
- ^ a b c d e f GRCm38: Ensembl release 89: ENSMUSG00000024365 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Marino S, Perez Garrido N, Ramírez P, Pujana M, Dratler G, Belgorosky A, Marino R (2020). "Molecular analysis of the CYP21A2 gene in dried blood spot samples". Medicina. 80 (3): 197–202. PMID 32442933.
- ^ Kaewkot A, Boonkaewwan C, Noosud J, Kayan A (novembar 2017). "Expression level of the cytochrome P450c21 (CYP21) protein correlating to drip loss in pigs". Animal Science Journal. 88 (11): 1855–1859. doi:10.1111/asj.12863. PMID 28677294.
- ^ Mizrachi D, Wang Z, Sharma KK, Gupta MK, Xu K, Dwyer CR, Auchus RJ (maj 2011). "Why human cytochrome P450c21 is a progesterone 21-hydroxylase". Biochemistry. 50 (19): 3968–74. doi:10.1021/bi102078e. PMC 3165045. PMID 21446712.
- ^ "Information on EC 1.14.14.16 - steroid 21-monooxygenase".
- ^ Mukangwa M, Takizawa K, Aoki Y, Hamano S, Tetsuka M (februar 2020). "Expression of genes encoding mineralocorticoid biosynthetic enzymes and the mineralocorticoid receptor, and levels of mineralocorticoids in the bovine follicle and corpus luteum". The Journal of Reproduction and Development. 66 (1): 75–81. doi:10.1262/jrd.2019-127. PMC 7040213. PMID 31839646.
- ^ Sarafoglou K, Lorentz CP, Otten N, Oetting WS, Grebe SK (juli 2012). "Molecular testing in congenital adrenal hyperplasia due to 21α-hydroxylase deficiency in the era of newborn screening". Clinical Genetics. 82 (1): 64–70. doi:10.1111/j.1399-0004.2011.01694.x. PMID 21534945. S2CID 7197547.
- ^ Bergamaschi R, Livieri C, Uggetti C, Candeloro E, Egitto MG, Pichiecchio A, Cosi V, Bastianello S (mart 2006). "Brain white matter impairment in congenital adrenal hyperplasia". Archives of Neurology. 63 (3): 413–6. doi:10.1001/archneur.63.3.413. PMID 16540460.
- ^ Marcol W, Kalina-Faska B, Wackermann-Ramos A, Koehler B (2000). "Congenital adrenal hyperplasia conditioned by 21beta-hydroxylase deficiency - clinical considerations". Endokrynologia, Diabetologia I Choroby Przemiany Materii Wieku Rozwojowego (jezik: poljski). 6 (1): 67–9. PMID 14640134.
- ^ a b "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". National Center for Biotechnology Information. Pristupljeno 30. 11. 2020.
This gene encodes a member of the cytochrome P450 superfamily of enzymes. The cytochrome P450 proteins are monooxygenases which catalyze many reactions involved in drug metabolism and synthesis of cholesterol, steroids and other lipids. This protein localizes to the endoplasmic reticulum and hydroxylates steroids at the 21 position. Its activity is required for the synthesis of steroid hormones including cortisol and aldosterone. Mutations in this gene cause congenital adrenal hyperplasia. A related pseudogene is located near this gene; gene conversion events involving the functional gene and the pseudogene are thought to account for many cases of steroid 21-hydroxylase deficiency. Two transcript variants encoding different isoforms have been found for this gene.
- ^ Ryan KJ, Engel LL (mart 1957). "Hydroxylation of steroids at carbon 21" (PDF). The Journal of Biological Chemistry. 225 (1): 103–14. doi:10.1016/S0021-9258(18)64913-0. PMID 13416221.
- ^ a b c d e f Pallan PS, Wang C, Lei L, Yoshimoto FK, Auchus RJ, Waterman MR, Guengerich FP, Egli M (maj 2015). "Human Cytochrome P450 21A2, the Major Steroid 21-Hydroxylase: structure of the enzyme progesterone substrate complex and rate-limiting c-h bond cleavage". The Journal of Biological Chemistry. 290 (21): 13128–43. doi:10.1074/jbc.M115.646307. PMC 4505568. PMID 25855791.
- ^ a b c Neunzig J, Milhim M, Schiffer L, Khatri Y, Zapp J, Sánchez-Guijo A, et al. (mart 2017). "The steroid metabolite 16(β)-OH-androstenedione generated by CYP21A2 serves as a substrate for CYP19A1". The Journal of Steroid Biochemistry and Molecular Biology. 167: 182–191. doi:10.1016/j.jsbmb.2017.01.002. PMID 28065637. S2CID 36860068.
- ^ a b Guengerich FP, Waterman MR, Egli M (august 2016). "Recent Structural Insights into Cytochrome P450 Function". Trends in Pharmacological Sciences. 37 (8): 625–40. doi:10.1016/j.tips.2016.05.006. PMC 4961565. PMID 27267697.
- ^ Sushko TA, Gilep AA, Usanov SA (juni 2012). "Mechanism of intermolecular interactions of microsomal cytochrome P450s CYP17 and CYP21 involved in steroid hormone biosynthesis". Biochemistry. Biokhimiia. 77 (6): 585–92. doi:10.1134/S0006297912060041. PMID 22817457. S2CID 18927484.
- ^ "UniProt, P08686" (jezik: engleski). Pristupljeno 10. 9. 2021.
- ^ Auchus RJ, Miller WL (2015). "P450 enzymes in steroid processing". Cytochrome P450: Structure, Mechanism, and Biochemistry (Fourth izd.). Springer International Publishing. str. 851–879. doi:10.1007/978-3-319-12108-6_12. ISBN 978-3-319-12107-9.
- ^ Araújo RS, Mendonca BB, Barbosa AS, Lin CJ, Marcondes JA, Billerbeck AE, Bachega TA (oktobar 2007). "Microconversion between CYP21A2 and CYP21A1P promoter regions causes the nonclassical form of 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. 92 (10): 4028–34. doi:10.1210/jc.2006-2163. PMID 17666484.
- ^ a b c d e f g h Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. (novembar 2018). "Congenital Adrenal Hyperplasia Due to Steroid 21-Hydroxylase Deficiency: An Endocrine Society Clinical Practice Guideline". The Journal of Clinical Endocrinology and Metabolism. 103 (11): 4043–4088. doi:10.1210/jc.2018-01865. PMC 6456929. PMID 30272171.
- ^ Werck-Reichhart D, Feyereisen R (2000). "Cytochromes P450: a success story". Genome Biology. 1 (6): REVIEWS3003. doi:10.1186/gb-2000-1-6-reviews3003. PMC 138896. PMID 11178272.
- ^ Zhao B, Lei L, Kagawa N, Sundaramoorthy M, Banerjee S, Nagy LD, Guengerich FP, Waterman MR (mart 2012). "Three-dimensional structure of steroid 21-hydroxylase (cytochrome P450 21A2) with two substrates reveals locations of disease-associated variants". The Journal of Biological Chemistry. 287 (13): 10613–22. doi:10.1074/jbc.M111.323501. PMC 3323056. PMID 22262854.
- ^ Graham SE, Peterson JA (2002). "Sequence alignments, variabilities, and vagaries". Methods in Enzymology. 357: 15–28. doi:10.1016/s0076-6879(02)57661-8. ISBN 9780121822606. PMID 12424893.
- ^ a b Auchus RJ, Sampath Kumar A, Andrew Boswell C, Gupta MK, Bruce K, Rath NP, Covey DF (januar 2003). "The enantiomer of progesterone (ent-progesterone) is a competitive inhibitor of human cytochromes P450c17 and P450c21". Archives of Biochemistry and Biophysics. 409 (1): 134–44. doi:10.1016/s0003-9861(02)00491-5. PMID 12464252.
- ^ Rosenfeld G, Ungar F, Dorfman RI, Pincus G (1955). "Irradiation and adrenal steroidogenesis: steroid transformations by irradiated isolated perfused calf adrenals". Endocrinology. 56 (1): 24–9. doi:10.1210/endo-56-1-24. PMID 13220521.
- ^ Dorfman RI, Hayano M (mart 1952). "The action of adrenal homogenates on progesterone, 17-hydroxyprogesterone and 21-desoxycortisone". Archives of Biochemistry and Biophysics. 36 (1): 237–9. doi:10.1016/0003-9861(52)90397-4. PMID 14934270.
- ^ Lorence MC, Trant JM, Mason JI, Bhasker CR, Fujii-Kuriyama Y, Estabrook RW, Waterman MR (august 1989). "Expression of a full-length cDNA encoding bovine adrenal cytochrome P450C21". Archives of Biochemistry and Biophysics. 273 (1): 79–88. doi:10.1016/0003-9861(89)90164-1. PMID 2502949.
- ^ Wu DA, Hu MC, Chung BC (april 1991). "Expression and functional study of wild-type and mutant human cytochrome P450c21 in Saccharomyces cerevisiae". DNA and Cell Biology. 10 (3): 201–9. doi:10.1089/dna.1991.10.201. PMID 1707279.
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Šablon:Cite journal = Proceedings of the National Academy of Sciences of the United States of America
- ^ Concolino P, Rizza R, Costella A, Carrozza C, Zuppi C, Capoluongo E (juni 2017). "CYP21A2 intronic variants causing 21-hydroxylase deficiency". Metabolism: Clinical and Experimental. 71: 46–51. doi:10.1016/j.metabol.2017.03.003. PMID 28521877.
- ^ a b Yu CY (1999). "Molecular genetics of the human MHC complement gene cluster". Experimental and Clinical Immunogenetics. 15 (4): 213–30. doi:10.1159/000019075. PMID 10072631. S2CID 25061446.
- ^ White PC, Grossberger D, Onufer BJ, Chaplin DD, New MI, Dupont B, Strominger JL (februar 1985). "Two genes encoding steroid 21-hydroxylase are located near the genes encoding the fourth component of complement in man". Proceedings of the National Academy of Sciences of the United States of America. 82 (4): 1089–93. Bibcode:1985PNAS...82.1089W. doi:10.1073/pnas.82.4.1089. PMC 397199. PMID 2983330.
- ^ Parker KL, Chaplin DD, Wong M, Seidman JG, Smith JA, Schimmer BP (decembar 1985). "Expression of murine 21-hydroxylase in mouse adrenal glands and in transfected Y1 adrenocortical tumor cells". Proceedings of the National Academy of Sciences of the United States of America. 82 (23): 7860–4. Bibcode:1985PNAS...82.7860P. doi:10.1073/pnas.82.23.7860. PMC 390869. PMID 2999780.
- ^ Shiina T, Shimizu S, Hosomichi K, Kohara S, Watanabe S, Hanzawa K, et al. (juni 2004). "Comparative genomic analysis of two avian (quail and chicken) MHC regions". Journal of Immunology. 172 (11): 6751–63. doi:10.4049/jimmunol.172.11.6751. PMID 15153492.
- ^ Miller WL, Merke DP (2018). "Tenascin-X, Congenital Adrenal Hyperplasia, and the CAH-X Syndrome". Hormone Research in Paediatrics. 89 (5): 352–361. doi:10.1159/000481911. PMC 6057477. PMID 29734195.
- ^ Sweeten TL, Odell DW, Odell JD, Torres AR (januar 2008). "C4B null alleles are not associated with genetic polymorphisms in the adjacent gene CYP21A2 in autism". BMC Medical Genetics. 9: 1. doi:10.1186/1471-2350-9-1. PMC 2265260. PMID 18179706.
- ^ Milner CM, Campbell RD (august 2001). "Genetic organization of the human MHC class III region". Frontiers in Bioscience: A Journal and Virtual Library. 6: D914–26. doi:10.2741/milner. PMID 11487476.
- ^ Xie T, Rowen L, Aguado B, Ahearn ME, Madan A, Qin S, Campbell RD, Hood L (decembar 2003). "Analysis of the gene-dense major histocompatibility complex class III region and its comparison to mouse". Genome Research. 13 (12): 2621–36. doi:10.1101/gr.1736803. PMC 403804. PMID 14656967.
- ^ Espinosa Reyes TM, Collazo Mesa T, Lantigua Cruz PA, Agramonte Machado A, Domínguez Alonso E, Falhammar H (novembar 2020). "Molecular diagnosis of patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency". BMC Endocrine Disorders. 20 (1): 165. doi:10.1186/s12902-020-00643-z. PMC 7653887. PMID 33168061.
- ^ a b c d Merke DP, Auchus RJ (septembar 2020). "Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency". The New England Journal of Medicine. 383 (13): 1248–1261. doi:10.1056/NEJMra1909786. PMID 32966723.
- ^ a b Miller WL, Auchus RJ (februar 2011). "The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders". Endocrine Reviews. 32 (1): 81–151. doi:10.1210/er.2010-0013. PMC 3365799. PMID 21051590.
- ^ a b "Non-classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency". Genetic and Rare Diseases Information Center (GARD). U.S. Department of Health & Human Services. Arhivirano s originala, 11. 11. 2020. Pristupljeno 1. 10. 2021.
- ^ Sharquie KE, Noaimi AA, Saleh BO, Anbar ZN (decembar 2009). "The frequency of 21-alpha hydroxylase enzyme deficiency and related sex hormones in Iraqi healthy male subjects versus patients with acne vulgaris". Saudi Medical Journal. 30 (12): 1547–50. PMID 19936418.
- ^ Falhammar H, Nordenström A (septembar 2015). "Nonclassic congenital adrenal hyperplasia due to 21-hydroxylase deficiency: clinical presentation, diagnosis, treatment, and outcome". Endocrine. 50 (1): 32–50. doi:10.1007/s12020-015-0656-0. PMID 26082286. S2CID 23469344.
- ^ New MI (novembar 2006). "Extensive clinical experience: nonclassical 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. 91 (11): 4205–14. doi:10.1210/jc.2006-1645. PMID 16912124.
Loss of scalp hair in females and males is embarrassing, requiring treatment with 5α-reductase inhibitors
- ^ Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, Grossman A, Hershman JM, Hofland J, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Purnell J, Singer F, Stratakis CA, Trence DL, Wilson DP, Yau M, Gujral J, New MI (april 2019). Congenital Adrenal Hyperplasia: Diagnosis and Emergency Treatment. MDText.com. PMID 25905311.
- ^ Witchel SF, Azziz R (2010). "Nonclassic congenital adrenal hyperplasia". International Journal of Pediatric Endocrinology. 2010: 625105. doi:10.1155/2010/625105. PMC 2910408. PMID 20671993.
Vanjski linkovi
uredi- GeneReviews/NCBI/NIH/UW entry on 21-Hydroxylase-Deficient Congenital Adrenal Hyperplasia
- OMIM entry on 21-Hydroxylase-Deficient Congenital Adrenal Hyperplasia
- Synthesis of Desoxycorticosterone from Progesterone through 21-Hydroxylase (Image) Arhivirano 26. 4. 2021. na Wayback Machine
- Steroid 21-Hydroxylase na US National Library of Medicine Medical Subject Headings (MeSH)
- Lokacija ljudskog genoma CPS1 i stranica sa detaljima o genu CPS1 u UCSC Genome Browseru.
- Lokacija ljudskog genoma CYP21A2 i stranica sa detaljima o genu CYP21A2 u UCSC Genome Browseru.
- P08686