Endoplazmatski retikulum
Endoplazmatski retikulum je najšire zastupljena ćelijska, odnosno citoplazmatska, organela i predstavlja sistem membrana. U citoplazmi se nalaze u obliku relativno spljoštenih kesica ili razgranate mreže cjevčica. Membrane zatvaraju prostor koji se kontinuirano pruža duž mreže i povezuje se s prostorom između dvije jedarne membrane.[1][2][3][4][5][6][7]
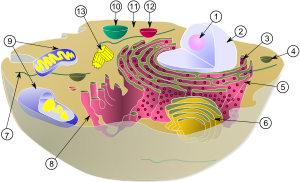
1 – Jedarce
2 – Jedro
3 – Ribosomi
4 – Vezikula
5 – Hrapavi endoplazmatski retikulum
6 – Golgijev aparat
7 – Mikrotubula
8 – Glatki endoplazmatski retikulum
9 – Mitohondrija
10 – Lizosom
11 – Citoplazma
12 – Mikrotijela
13 – Centriole
Razlikuju se dva oblika endoplazmatskog retikuluma: hrapavi (zrnasti, granulirani) i glatki (agranulirani). Hrapavi endoplazmatski retikulum posjeduje ribosome vezane na površini prema citosolu i ima spljošten izgled. Glatki endoplazmatski retikulum nema ribosoma na svojoj površini i ima izgled razgranatih cjevčica. Oba ova tipa endoplazmatskog retikuluma mogu se naći u istoj ćeliji. Relativna zastupljenost ova dva tipa endoplazmatskog retikuluma različita je u različitim ćelijama kao i u istoj ćeliji u toku različitih perioda njene aktivnosti. Hrapavi endoplazmatski retikulum uključen je u sintezu proteina koji treba da butu izlučeni iz ćelija, dok se u glatkom sintetiziraju lipidi.
Postoji i specijalni tip glatkog endoplazmatskog retikuluma koji se zove sarkoplazmatski retikulum koji se nalazi u mišićnim ćelijama i služi kao skladište i pumpa za kalcijumove jone koji se oslobađaju prilikom mišićne kontrakcije.
Struktura
urediOpća struktura endoplazmatskog retikulum je mrežasta membrana zvana cisterne. Ove kesaste strukture drže se zajedno putem citoskeleta. Fosfolipidna membrana zatvara cisternski prostor (ili lumen), koji je kontinuiran s perinjedarnim prostorom, ali je odvojen od citosola. Funkcije endoplazmatičnog retikulum mogu se sažeti na sintezu i transport proteina i membranskih lipida, ali variraju između ER i tipa i funkcije ćelija. Količina i hrapavog i glatkog endoplazmatskog retikuluma u ćeliji može se polahko smjenjivati iz jednog tipa u drugi, ovisno o promjenama metaboličke aktivnosti ćelije. Transformacija može uključiti ugrađivanje novih proteina u membranu, kao i strukturne promjene. Promjene u sadržaju proteina mogu doći bez primjetnih strukturnih promjena.
Hrapavi (grubi, zrnasti ili granulirani) endoplaznmatski retikulum
urediUkupno trajanje animacije je oko dvije minute.
Površina hrapavog endoplazmatskog retikuluma (često skraćeno RER ili hrpavi ER) (također se zove i zrnasti endoplazmatski retikulum) je optočena proizvođačima proteina – ribosommima, što mu daje "hrapav" izgled (otud ime).[8] Mjesto vezanja ribosoma na endoplazmatskom retikulumu je translokon.[9] Međutim, ribosomi nisu stabilni dio strukture ove organele kao što su stalno vezani i otpuštani sa membrane. Ribosomi se vežu samo za hrapavi endoplazmatski retikulum u jednan specifičan proteinsko-nukleinskokiselinski složeni oblik u citosolu. Kada je slobodan ribosomu, ovaj posebno složeni oblik počinje prevođenje iRNK u jezik proteina koji su predodređeni za sekrecijski put.[10] Prvih 5-30 aminokiselina polimerizovanog kodiranja signalnog peptida, proslijeđuje molekulsku poruku koja je prepoznatljiva i vezana zA česticu prepoznavanja signala (SRP). Transkacija prestaje i ribozomni kompleks se veže za RER translokon gdje nastavlja translaciju stvaranjem novonastalih proteina formirajući u RER lumen i/ili membrane. Protein se prerađuje u ER lumenski enzim (signalna peptidaza), koji uklanja peptidni signal. Ribosom tada može biti otpušten natrag u citosol; međutim, za netranslacijske ribosome je poznato da ostaju povezani sa translokonima.[11]
Membrana hrapavog endoplazmatskog retikuluma formira velike udvojene membranske listove koji se nalaze u blizini, a kontinuirani su sa vanjskim slojem jedrove ovojnice.[12] Dvostruka membranski listovi listovi slažu se i povezuju preko nekoliko desno- ili lijevosmjernih spiralnih rampi, tzv. Terasakijevih rampi, što dovodi do stvaranja strukture koja je nalik garaži.[13] Iako ne postoji kontinuirana membrana između endoplazmatskog retikuluma i Golgijevog aparata, vezikule koje su vezane za membranu prenose proteine između ova dva odjela.[14] Vezikule su okružene slojem proteina zvanih COPI i COPII. Vezikule koje ciljaju COPII ciljeve vezikule na Golgijevom aparatu i COPI označavaju da se vratio hrapavi endoplazmatski retikulum. Ovaj endoplazmatski retikulum djeluje u suglasnosti sa aktivnošću Golgijevog kompleksa vežući nove proteine da ih pravilno prenesu na njihova odredišta. Drugi način transporta iz endoplazmatskog retikuluma uključuje područja pod nazivom mjesto membranakog kontakta, gdje se održavaju blisko spojene membrane endoplazmatskog retikuluma i druge organele, omogućavajući prijenos lipida i drugih malih molekula.[15][16]
Grapavi endoplazmatski retikulum je ključ u više funkcija:
- Proizvodnja lizosomnih enzima sa manoza-6-fosfatnim markerom dodanim u cis-Golgijevu mrežu;
- Proizvodnja sekretnih proteina, koji se izlučuju konstitutivno bez oznake ili na regulacijski način koji uključuje klatrin i uparene osnovne aminokiseline u signalni peptid;
- Integralni membranski proteini koji ostaju ugrađeni u membrane kao izlazi vezikula i vežu se za nove membrane. Rab proteini su ključni u ciljanju membrane; SNAP i SNARE ključni su proteini pri spajanju;
- Nastavlja početnu glikolizaciju kao cjelinu. Ovo je N-vezanje (O-povezivanje javlja se u Golgijevom aparatu);
Glatki endoplazmatki retikulum
urediGlatki endoplazmatki retikulum (SER) ili nezrnsati (negranulirani) endoplazmatski retikulum ima funkcije u nekoliko metaboličkih procesa. Sintetizira lipide, fosfolipide i steroide. Ćelije koje luče ove proizvode, kao što su one u testisima, jajniku i lojnim žlijezdama imaju obilje glatkog endoplazmatskog retikuluma.[17] Također obavlja metabolizam ugljikohidrata, detoksikaciju prirodnih produkata metabolizma, alkohola i lijekova, vezanje receptore na ćelijskim membranama proteina i metabolizam steroida.[18] U mišićnim ćelijama, regulira koncentraciju kalcijskih iona. Glatki endoplazmatski retikulum nalazi se u različitim tipovima ćelija (i životinja i biljaka), a u svakoj ima različite funkcije. Glatki endoplazmatski retikulum sadrži enzim glukoza-6-fosfataza, koji pretvara glukoza-6-fosfat u glukozu, što je korak u glukogenezi. Povezan je s jedrovom ovojnicom, a sastoji se od tubula koje se nalaze u blizini ćelijske periferije. Ove cijevi ponekad se granaju, formirajući strukturu mrežastog izgleda.[12] U nekim ćelijama, postoje proširena područja, kao što su kese u hrapavom endoplazmatskom retikulumu. Mreža glatkog endoplazmatskog retikulum omogućava povećanu aktivnu površinu ili služi za pohranu ključnih enzima i njihovih proizvoda.
Sarkoplazmatski retikulum
urediSarkoplazmatski retikulum (SR, od grčkog σάρξ - sarks = meso, meso), je glatki ER koji se nalazi u miocitima. Jedina strukturna razlika između ove organele i glatkog endoplazmatskog retikuluma je prisustvo mješovitih proteina koji su vezani za njihove membrane ili plivaju u okvirima njihovog lumena. Ova osnovna razlika je pokazatelj njihove funkcije: endoplazmatski retikulum sintetizira molekule, dok sarkoplazmatski pohranjuje ione kalcija i pumpa ih u sarkoplazmu kada je mišićno vlakano stimulirano.[19][20] Nakon otpuštanja iz sarkoplazmatskog retikuluma, ioni kalcija ulaze u interakciju s kontraktilnim proteinima koji koriste ATP za skraćivanje mišićnih vlakana. Sarkoplazmatski retikulum ima glavnu ulogu u spoju nadražaj-kontrakcija.[21]
Funkcije
urediEndoplazmatski retikulum ima mnoge opće funkcije, uključujući i sklapanje proteinskih molekula u kesice pod nazivom cisterne i transport sintetiranih proteina u vezikule Golgijevog aparata. Pravilno sklapanje novostvorenih proteina je omogućava nekoliko haperonskih proteina endoplazmatskog retikuluma, uključujući i protein-disulfid izomerazu (PIO), ERp29 i Hsp70, koji je porodice BiP/Grp78, kalneksin, kalretikulin, porodice peptidilpropil izomeraza. Samo pravilno presavijeni proteini prenose se iz hrapavog ER na Golgijev aparat – nesvijeni proteini izazivaju odgovor nepresavijenih proteina kao odgovor na stres u ER. Usljed toga, javljaju se poremećaji u redoks regulaciji kalcija, deprivacija glukoze i virusne infekcije[22] or the over-expression of proteins[23] koji mogu voditi ka stresnog odgovora endoplazmatskog retikulum (ER stres), stanju koje usporava presavijanje proteina, što izaziva odgovor nepresavijenih proteina . Ovaj stres se pojavljuje kao potencijalni uzrok oštećenja u hipoksiji/ishemiji, otpornosti na insulin i drugih poremećaja.[24]
Transport proteina
urediSekrecijski proteini, uglavnom glikoproteini, se transportuju preko membrane endoplazmatskog retikuluma. Proteini koji se tako prenose širom ćelije označeni su i „adresirani“ pomoću signalne sekvence. N-kraj (jedan od krajeva) polipeptidnog lanca (tj. proteina) sadrži nekoliko aminokiselina koje djeluju kao kao oznaka adrese, koja se uklanja kada polipeptid stigne na odredište. Nastajući peptidi dolaze do ER preko translokona, koji je multiproteinski kompleks ugrađen u membranu. Proteini koji su predodređeni za mjesta izvan endoplazmatskog retikuluma pakuju se u transportne vezikule i transportuju duž citoskeleta, prema odredištiu. U ljudskim fibroblastima, ER je uvijek kodistribuiran sa mikrotubulama, a depolimerizacija ovog drugog izazva svog koagregaciju sa mitohondrijama, koje su također povezane sa endoplazmatskim retikulumom.[25]
Endoplazmatski retikulum je također dio sortiranja proteinskog puta. To je, u suštini, transportni sistem eukariotske ćelije. Većina njegovih unutrašnjih proteina zadržavaju se u njemu tokom zadržavanja motiva. Ovaj motiv se sastoji od četiri aminokiseline na kraju sekvence proteina. Najčešća zadržavajuća sekvence su KDEL, za proteine koji se nalaze u lumenu i KKXX za transmembranski protein.[26] Međutim, varijacije KDEL i KKXX i drugih sekvenci također mogu dovesti do retencije endoplazmatskog retikuluma. Nije poznato da li se takve varijacije mogu dovesti do sub-ER lokalizacije. U ćelijama sisara, postoje tri KDEL (1, 2 i 3) receptora, koji imaju vrlo visok stepen identiteta sekvence. Ostaje da se preciznije spoznaju funkcijske razlike između ovih receptora.[27]
Klinički značaj
urediAbnormalnosti u XBP1 vode ka povišeno. Stresni dgovor endoplazmatskog retikuluma potom izaziva veću osjetljivost za upalne procese koji mogu čak doprinijeti i pojavi Alzheimerove bolesti.[28]
U debelom crijevu, anomalije XBP1 su povezane sa upalnim bolestima crijeva, uključujući Crohnovu bolest.[29]
Odgovor nepresavijenih proteina (UPR) je ćelijski odgovor na stres koji je u vezi sa endoplazmatskim retikulumom.[30] UPR se aktivira kao odgovor na gomilanje nepresavijenih ili pogrešno presavijenih proteina u lumenu endoplazmatskog retikuluma. Funkcije UPR za vraćanje normalnu funkciju ćelije zaustavljanjem translacije proteina, dagradacijom pogrešno presavijenih proteina i aktiviranjem signalnih puteva koji dovode do povećanja proizvodnje molekulske pratilaca koji su uključeni u presavijanje proteina. Održiva nadaktivacija UPP je upletena u prionske bolesti, kao i nekoliko drugih neurodegenerativnih bolesti, a inhibicija UPP mogla bi postati dio tretmanA za ove bolesti.[31]
Također pogledajte
urediReference
uredi- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
- ^ Kapur Pojskić L. (2014). Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-8-3.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2002). Biologija 2. Svjetlost, Sarajevo. ISBN 9958-10-222-6.CS1 održavanje: više imena: authors list (link)
- ^ Berberović Lj., Hadžiselimović R. (1986). Rječnik genetike. Svjetlost, Sarajevo. ISBN 86-01-00723-6.
- ^ Sofradžija A., Šoljan D., Hadžiselimović R. (2004). Biologija 1. Svjetlost, Sarajevo. ISBN 9958-10-686-8.CS1 održavanje: više imena: authors list (link)
- ^ Hadžiselimović R., Pojskić N. (2005). Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 9958-9344-3-4.
- ^ Sofradžija A., Berberović Lj., Hadžiselimović R. (2003). Biologija za 2. Svjetlost, Sarajevo. ISBN 9958-10-581-0.CS1 održavanje: više imena: authors list (link)
- ^ "reticulum". The Free Dictionary.
- ^ Görlich D, Prehn S, Hartmann E, Kalies KU, Rapoport TA (1992). "A mammalian homolog of SEC61p and SECYp is associated with ribosomes and nascent polypeptides during translocation". Cell. 71 (3): 489–503. doi:10.1016/0092-8674(92)90517-G. PMID 1423609.CS1 održavanje: upotreba parametra authors (link)
- ^ Lodish, Harvey; et al. (2003). Molecular Cell Biology (5th izd.). W. H. Freeman. str. 659–666. ISBN 0-7167-4366-3.
- ^ Seiser, R. M. (2000). "The Fate of Membrane-bound Ribosomes Following the Termination of Protein Synthesis". Journal of Biological Chemistry. 275 (43): 33820–33827. doi:10.1074/jbc.M004462200. ISSN 0021-9258.
- ^ a b Shibata, Yoko; Voeltz, Gia K.; Rapoport, Tom A. (2006). "Rough Sheets and Smooth Tubules". Cell. 126 (3): 435–439. doi:10.1016/j.cell.2006.07.019. ISSN 0092-8674.
- ^ Terasaki, Mark; Shemesh, Tom; Kasthuri, Narayanan; Klemm, Robin W.; Schalek, Richard; Hayworth, Kenneth J.; Hand, Arthur R.; Yankova, Maya; Huber, Greg; Lichtman, Jeff W.; Rapoport, Tom A.; Kozlov, Michael M. (2013). "Stacked Endoplasmic Reticulum Sheets Are Connected by Helicoidal Membrane Motifs". Cell. 154 (2): 285–296. doi:10.1016/j.cell.2013.06.031.
- ^ Endoplasmic reticulum. (n.d.). McGraw-Hill Encyclopedia of Science and Technology. Retrieved September 13, 2006, from Answers.com Web site: http://www.answers.com/topic/endoplasmic-reticulum
- ^ Levine T (septembar 2004). "Short-range intracellular trafficking of small molecules across endoplasmic reticulum junctions". Trends Cell Biol. 14 (9): 483–90. doi:10.1016/j.tcb.2004.07.017. PMID 15350976.
- ^ Levine T, Loewen C (august 2006). "Inter-organelle membrane contact sites: through a glass, darkly". Curr. Opin. Cell Biol. 18 (4): 371–8. doi:10.1016/j.ceb.2006.06.011. PMID 16806880.CS1 održavanje: upotreba parametra authors (link)
- ^ "Functions of Smooth ER". University of Minnesota Duluth.
- ^ Maxfield FR, Wüstner D (oktobar 2002). "Intracellular cholesterol transport". J. Clin. Invest. 110 (7): 891–8. doi:10.1172/JCI16500. PMC 151159. PMID 12370264.CS1 održavanje: upotreba parametra authors (link)
- ^ Toyoshima C, Nakasako M, Nomura H, Ogawa H (2000). "Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 A resolution". Nature. 405 (6787): 647–55. doi:10.1038/35015017. PMID 10864315.CS1 održavanje: upotreba parametra authors (link)
- ^ Medical Cell Biology 3rd/ed. Academic Press. str. 69.
- ^ Martini, Frederick; Nath, Judi; Bartholomew, Edwin (2014). Fundamentals of Anatomy and Physiology (10th izd.). ISBN 978-0321909077.
- ^ Xu, C; et al. (2005). "Endoplasmic Reticulum Stress: Cell Life and Death Decisions". J. Clin. Invest. 115 (10): 2656–2664. doi:10.1172/JCI26373. PMC 1236697. PMID 16200199.
- ^ Kober L, Zehe C, Bode J (oktobar 2012). "Development of a novel ER stress based selection system for the isolation of highly productive clones". Biotechnol. Bioeng. 109 (10): 2599–611. doi:10.1002/bit.24527. PMID 22510960.CS1 održavanje: upotreba parametra authors (link)
- ^ Ozcan, U.; Cao, Q; Yilmaz, E; Lee, AH; Iwakoshi, NN; Ozdelen, E; Tuncman, G; Görgün, C; Glimcher, LH; Hotamisligil, GS (2004). "Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes". Science. 306 (5695): 457–461. doi:10.1126/science.1103160. PMID 15486293.
- ^ Soltys ,B.J. and Gupta, R.S. (1992) Interrelationships of endoplasmic reticulum, mitochondria, intermediate filaments, and microtubules – a quadruple fluorescence labeling study. PMID 1363623.
- ^ Mariano Stornaiuolo; Lavinia V. Lotti; Nica Borgese; Maria-Rosaria Torrisi; Giovanna Mottola; Gianluca Martire; Stefano Bonatti (mart 2003). "KDEL and KKXX Retrieval Signals Appended to the Same Reporter Protein Determine Different Trafficking between Endoplasmic Reticulum, Intermediate Compartment, and Golgi Complex". Molecular Biology of the Cell. 14 (3): 889–902. doi:10.1091/mbc.E02-08-0468.
- ^ Raykhel I, Alanen H, Salo K, Jurvansuu J, Nguyen VD, Latva-Ranta M, Ruddock L (2008) A molecular specificity code for the three mammalian KDEL receptors. PMID 18086916.
- ^ {{cite journal|last=Casas-Tinto|first=S|author2=Zhang, Y |author3=Sanchez-Garcia, J |author4=Gomez-Velazquez, M |author5=Rincon-Limas, DE |author6=Fernandez-Funez, P |title=The ER stress factor XBP1s prevents amyloid-{beta} neurotoxicity.|journal=Human Molecular Genetics|date=25. 3. 2011|pmid=21389082|doi=10.1093/hmg/ddr100|pmc=3090193|volume=20|issue=11|pages=2144–60}}
- ^ Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH, Blumberg RS (septembar 2008). "XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease". Cell. 134 (5): 743–56. doi:10.1016/j.cell.2008.07.021. PMC 2586148. PMID 18775308.CS1 održavanje: upotreba parametra authors (link)
- ^ Walter, Peter. "Peter Walter's short talk: Unfolding the UPR". iBiology. Arhivirano s originala, 12. 7. 2017. Pristupljeno 13. 12. 2016.
- ^ Moreno, J. A.; Halliday, M.; Molloy, C.; Radford, H.; Verity, N.; Axten, J. M.; Ortori, C. A.; Willis, A. E.; Fischer, P. M.; Barrett, D. A.; Mallucci, G. R. (2013). "Oral Treatment Targeting the Unfolded Protein Response Prevents Neurodegeneration and Clinical Disease in Prion-Infected Mice". Science Translational Medicine. 5 (206): 206ra138. doi:10.1126/scitranslmed.3006767. PMID 24107777.