PAH (gen)
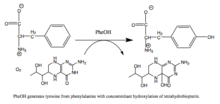
Fenilalanin-hidroksilaza (PAH) (EC 1.14.16.1) je enzim koji katalizira hidroksilaciju aromatskog bočnog lanca fenilalanina, za stvaranje tirozina. PAH je jedan od tri člana biopterin-ovisnih hidrolaznih aromatskih aminokiselina, klase monooksigenaza, koja za katalizu koristi tetrahidrobiopterin (BH4, pteridinski kofaktor) i gvožđe bez hema. Tokom reakcije, molekulni kisik se heterolitki cijepa uz uzastopnu inkorporaciju jednog atoma kisika u BH 4 i supstrat fenilalanina.[5][6] Kod ljudi, mutacije u kodirajućem genu, PAH , mogu dovesti do metaboličkog poremećaja zvanog fenilketonurija.
 |
Enzimski mehanizam
urediSmatra se da se reakcija odvija u sljedećim koracima:
- formiranje mosta Fe (II)-O-O-BH4.
- heterolitičko cijepanje O-O veze, kako bi se dobio feril-okso hidroksilacijski međuprodukt Fe (IV) = O
- napad na Fe(IV)=O da hidroksilira fenilalaninski supstrat u tirozin.[7]
Formiranje i rascjep gvožđe-peroksipterinskog mosta: Iako dokazi snažno podržavaju da je Fe(IV)=O hidroksilirajući intermedijar,[8] mehanički detalji koji su u osnovi formiranja mosta Fe(II)-O-O-BH4 prije heterolitnog cijepanja i dalje su kontroverzni. Predložena su dva puta na osnovu modela koji se razlikuju po blizini gvožđa do kofaktora pterina i broju molekula vode za koje se pretpostavlja da su tokom katalize koordinirane gvožđem. Prema jednom modelu, kompleks gvožđe-dioksida je inicijalno formiran i stabiliziran kao rezonantni hibrid Fe2+O2 i Fe3+O2– . Aktivirani O2 zatim napada BH4, tvoreći prijelazno stanje koje karakterizira razdvajanje naboja između pterinskog prstena s nedostatkom elektrona i elektronom bogatih vrsta kisika.[9] Kasnije se formira most Fe(II)-O-O-BH4. S druge strane, formiranje ovog mosta modelirano je pretpostavljajući da se BH4 nalazi u prvoj koordinacijskoj ljusci gvožđa i da ono nije koordinirano ni s jednom molekulom vode. Ovaj model predviđa drugačiji mehanizam, koji uključuje radikal pterina i superoksid, kao kritične međuprodukte.[10] Kad se formira, Fe(II)-O-O-BH4, most se razgrađuje putem heterolitskog cijepanja O-O veze na Fe(IV)=O i 4a-hidroksitetrahidrobiopterin; stoga je molekulski kisik izvor oba atoma kisika koji se koriste za hidroksilaciju pterinskog prstena i fenilalanina.
Hidroksilacija fenilalanina pomoću feril-okso međuproizvoda: Budući da mehanizam uključuje Fe(IV)=O (za razliku od peroksipterina) hidroksilacijski intermedijer, oksidacija kofaktora BH4 i hidroksilacija fenilalanina može se odvojiti, što rezultira neproduktivnom potrošnjom BH4 i stvaranjem H2O2.[7] Međutim, kada je produktivan, Fe(IV)=O međuprodukt dodaje se fenilalaninu u reakciji elektrofilne aromatske supstitucije koja reducira gvožđe iz feri u stanje fero.[7] Iako je u početku bio predložen arenski oksid ili radikalni međuprodukt, analize srodnih triptofan– i tirozin-hidroksilaze sugerirale su da se reakcija umjesto toga odvija kroz kationski intermedijer koji zahtijeva da se Fe(IV)=O koordinira s vodenim ligandom, a ne s hidrokso-grupom.[7][11] Ovaj kationski intermedijer naknadno prolazi 1,2-hidridni NIH pomak, dajući dienonski međuprodukt koji se zatim tautomerizira u tvorbu tirozinskih proizvoda.[12] Kofaktor pterina regenerira se hidratacijom karbinolaminskog produkta PAH u kinonoid-dihidrobiopterin (qBH2), koji se zatim reducira na BH4.[13]
Regulacija enzima
urediPredlaže se da se PAH koristi morfinski model alosterne regulacije.[14][15]
Sisarski PAH postoji u ravnoteži koja se sastoji od tetramera dvije različite arhitekture, s jednim ili više dimernih oblika kao dijelom ravnoteže. Ovo ponašanje je u skladu s disocijativnim alosternim mehanizmom.[15]
Mnoge studije sugeriraju se sisarski PAH ponaša usporedivo s porfobilinogen-sintazom (PBGS), pri čemu se navodi da različiti faktori, poput pH i vezivanja liganda, utiču na aktivnost enzima i stabilnost proteina.[15]
Aminokiselinska sekvenca
urediDužina polipeptidnog lanca je 452 aminokiseline, a molekulska težina 51 862Da.[16]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSTAVLENPG | LGRKLSDFGQ | ETSYIEDNCN | QNGAISLIFS | LKEEVGALAK | ||||
| VLRLFEENDV | NLTHIESRPS | RLKKDEYEFF | THLDKRSLPA | LTNIIKILRH | ||||
| DIGATVHELS | RDKKKDTVPW | FPRTIQELDR | FANQILSYGA | ELDADHPGFK | ||||
| DPVYRARRKQ | FADIAYNYRH | GQPIPRVEYM | EEEKKTWGTV | FKTLKSLYKT | ||||
| HACYEYNHIF | PLLEKYCGFH | EDNIPQLEDV | SQFLQTCTGF | RLRPVAGLLS | ||||
| SRDFLGGLAF | RVFHCTQYIR | HGSKPMYTPE | PDICHELLGH | VPLFSDRSFA | ||||
| QFSQEIGLAS | LGAPDEYIEK | LATIYWFTVE | FGLCKQGDSI | KAYGAGLLSS | ||||
| FGELQYCLSE | KPKLLPLELE | KTAIQNYTVT | EFQPLYYVAE | SFNDAKEKVR | ||||
| NFAATIPRPF | SVRYDPYTQR | IEVLDNTQQL | KILADSINSE | IGILCSALQK | ||||
| IK |
- Simboli
Struktura
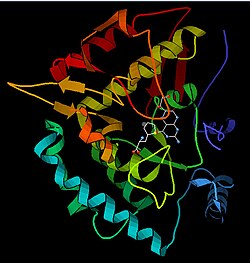
urediMonomer PAH (51,9 kDa) sastoji se od tri različita domena: regulatornog N-terminalnog (ostaci 1–117) koji sadrži Phe-vezujuću ACT poddomeni, katalitskog domena (ostaci 118-427) i domena C-terminala (ostaci 428–453), odgovornih za oligomerizaciju identičnih monomera. Provedena je opsežna kristalografska analiza, posebno na katalitskom domenu koordiniranom pterinom i gvožđem, kako bi se ispitalo aktivno mjesto. Određena je i struktura N-terminalnog regulatornog domena, a zajedno s riješenom strukturom homolognog C-terminalnog domena tetramerizacije tirozin-hidroksilaze, a predložen je i strukturni model tetramernog PAH-a.[13] Using X-ray crystallography, the structure of full-length rat PAH was determined experimentally and showed the auto-inhibited, or resting-state form of the enzyme.[17] Oblik stanja mirovanja (RS-PAH) arhitektonski se razlikuje od aktiviranog oblika (A-PAH).[18] Još uvijek nedostaje cjelovita struktura A-PAH-a, ali je utvrđeno Phe stabilizirano sučelje ACT-ACT, koje je karakteristično za A-PAH i predložen je strukturni model A-PAH na osnovu analize SAXS-a.[19][20]
Katalitski domen
urediRiješene kristalne strukture katalitskog domena ukazuju na to da se aktivno mjesto sastoji od otvorenog i prostranog džepa obloženog prvenstveno hidrofobnim ostacima, iako su prisutna i tri ostatka glutaminske kiseline, dva histidina i tirozin koji vežu gvožđe.[13] Postoje kontradiktorni dokazi o koordinacijskom stanju gvožđevog atoma i njegovoj blizini BH4 unutar aktivnog mjesta. Prema kristalografskoj analizi, Fe(II) je koordiniran vodom, His285, His290 i Glu330 (aranžman trijade 2-his-1-karboksilatoliki) sa oktaedarskom geometrijom.[21] Uključivanjem analoga Phe u kristalnu strukturu, mijenja se i gvožđe iz šesto– do petokoordiniranog stanja koje uključuje jednu molekulu vode i dvozubu koordinaciju do Glu330 i otvaranje mjesta za vezanje kisika. BH4 se istodobno pomiče prema atomu gvožđa, iako pterinski kofaktor ostaje u drugoj koordinacijskoj sferi.[22] S druge strane, konkurentski model zasnovan na NMR i analizama molekulskog modeliranja sugerira da su sve koordinirane molekule vode prisiljene napustiti aktivno mjesto tokom katalitskog ciklusa, dok BH4 postaje izravno koordiniran gvožđem.[23] Kao što je gore navedno, rješavanje ove razlike bit će važno za utvrđivanje tačnog mehanizma PAH katalize.
N-terminalno regulatorno područje
urediRegulatorna priroda N-terminalnog domena (ostaci 1–117) data je njegovom strukturnom fleksibilnošću.[24] Analiza izmjene vodik/deuterij pokazuje da alosterno vezivanje Phe globalno mijenja konformaciju PAH, tako da je aktivno mjesto manje zagueno, jer je sučelje između regulatornih i katalitskih domena sve izloženije rastvaraču.[24][25][26] Ovo zapažanje je u skladu s kinetičkim studijama, koje pokazuju početno nisku stopu stvaranja tirozina za PAH cijele dužine. Ovo vrijeme kašnjenja se ne primjećuje za krnji PAH bez N-terminalnog domena ili ako je enzim pune dužine prethodno inkubiran s Phe.
Delecija domena N-terminala također eliminira vrijeme kašnjenja i povećava afinitet za Phe gotovo dvostruko; ne primjećuje se razlika u Vmax ili Km za kofaktor tetrahidrobiopterina.[27] Dodatne propise pruža Ser16; fosforilacija ovog ostatka ne mijenja konformaciju enzima, ali smanjuje koncentraciju Phe potrebnu za alosteričku aktivaciju.[26] Ovaj N-terminalni regulatorni domen nije primijećena u bakterijskih PAH-a, ali pokazuje značajnu strukturnu homologiju sa regulatornim domenom fosfogilcerat-dehidrogenaza, enzima u biosintetskom putu serina.[26]
Tetramerizacijski domen
urediProkariotski PAH je monomerni, dok eukariotski postoji u ravnoteži između homotetramernih i homodimernih oblika.[7][13] Interfejs dimerizacije sastoji se od petlji povezanih sa simetrijom koje povezuju identične monomere, dok se preklapajući C-terminalni domen tetramerizacije posreduje u udruživanju konformacijski različitih dimera, koje karakterizira različita relativna orijentacija katalitskog i tetramerizacijskog domena (Flatmark, Erlandsen). Rezultirajuće izobličenje simetrije tetramera očito je u diferencijalnoj površini sučelja dimerizacije i razlikuje PAH od tetramerno simetrične tirozin-hidroksilaze.[13] Predložen je mehanizam zamjene tetramernog domena iz dimernog, u kojima alfa-heliksi C-terminala međusobno mijenjaju svoju konformaciju oko fleksibilnog područja šarki sa pet ostataka sa C-terminalom, kako bi formirale strukturu uprede zavojnice, pomičući ravnotežu prema tetramernom obliku.[7][13][28] Iako su i homodimerni i homotetramerni oblici PAH katalitski aktivni, ova dva pokazuju različitu kinetiku i regulaciju. Osim smanjene katalitske učinkovitosti, dimer ne pokazuje pozitivnu kooperativnost prema L-Phe (koji pri visokim koncentracijama aktivira enzim), što sugerira da L-Phe alosterno regulira PAH, utičući na interakciju dimer-dimer.[28]
Biološka funkcija
urediPAH je kritični enzim u metabolizmu fenilalanina i katalizira korak ograničavanja brzine u njegovom potpunom katabolizmu do ugljik-dioksida i vode.[13][29] Regulacija protoka kroz puteve povezane s fenilalaninom kritična je u metabolizmu sisara, što dokazuje toksičnost visokih koncentracija ove aminokiseline u plazmi zabilježena u fenilketonuriji (vidi dolje). Glavni izvor fenilalanina su uneseni proteini, ali relativno malo ovog bazena koristi se za sintezu proteina.[29] Umjesto toga, većina unesenog fenilalanina se katabolizira kroz PAH u oblik tirozin; dodavanje hidroksilne grupe omogućava da se benzenski prsten razbije u narednim katabolitskim koracima. Transaminacija u fenilpiruvat, čiji se metaboliti izlučuju urinom, predstavlja još jedan put prometa fenilalanina, ali prevladava katabolizam putem PAH-s.[29]
Kod ljudi, ovaj enzim se eksprimira i u jetri i u bubrezima, a postoje neke indicije da se u tim tkivima može različito regulirati.[30] PAH je neobičan među hidroksilazama aromatskih aminokiselina po svom učešću u katabolizmu; tirozin i triptofan-hidroksilaza , s druge strane, primarno se eksprimiraju u centralnom nervnom sistemu i katalizuju korake koji ograničavaju brzinu u biosintezi neurotransmitera/hormona.[13]
Klinički značaj
urediNedostatak aktivnosti PAH-a zbog mutacija u PAH-u uzrokuje hiperfenilalaninemiju (HPA), a kada se razina fenilalanina u krvi poveća iznad 20 puta normalne koncentracije, dolazi do metaboličke bolesti fenilketonurija (PKU).[29] PKU je i genotipski i fenotipski heterogen: identificirano je preko 300 različitih patogenih varijanti, od kojih većina odgovara misens mutacijama koje se preslikavaju u katalitski domen.[13][21] Kada je kohorta identificiranih mutanata PAH eksprimirana u rekombinantnim sistemima, enzimi su pokazali promijenjeno kinetičko ponašanje i/ili smanjenu stabilnost, u skladu sa strukturnim mapiranjem ovih mutacija i na katalitski i na tetramerizacijski domen enzima.[13] BH4 4 primijenjen je kao farmakološki tretman i pokazano je da smanjuje razinu fenilalanina u krvi za segment pacijenata s PKU-om, čiji su genotipovi dovode do neke zaostale aktivnosti PAH -a, ali nemaju nedostatak u sintezi ili regeneraciji BH44. Kontrolne studije ukazuju na to da u slučaju određenih PAH mutanata, višak BH44 djeluje kao farmakološki šaperon za stabilizaciju mutiranih enzima s poremećenim sastavom tetramera i povećanom osjetljivošću na proteolitsko cijepanje i agregaciju.[31] Mutacije koje su identifikovane u lokusu PAH dokumentovane su u bazi poznatih fenilalanin hidroksilaze (PAHdb), [1].
Budući da fenilketonurija može uzrokovati nepovratna oštećenja, imperativ je da se nedostaci u fenilalanin-hidroksilazi utvrde u ranom razvoju. U početku je to učinjeno pomoću testa inhibicije bakterija poznatog kao Guthriejev test. Sada je PKU dio skrininga novorođenčadi u mnogim zemljama, a povišene razine fenilalanina se identificiraju ubrzo nakon rođenja mjerenjem tandemskom masenom spektrometrijom. Stavljanjem osoba na dijetu sa niskim sadržajem fenilalanina, visokim tirozina, može se spriječiti dugotrajno oštećenje njihovog razvoja.
Srodni enzimi
urediFenilalanin-hidroksilaza je usko povezana sa dva druga enzima:
- triptofan-hidroksilaza (EC broj 1.14.16.4), koji kontrolira nivo serotonina u mozgu i gastrointestinalnom traktu
- tirozin-hidroksilaza (EC broj 1.14.16.2), koji kontrolira nivoe dopamina, epinefrina i norepinefrina u mozgu i srži nabubrežnih žlijezda.
Tri enzima su homologna, odnosno smatra se da su nastala iz iste iste drevne hidroksilaze.
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000171759 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000020051 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Fitzpatrick PF (1999). "Tetrahydropterin-dependent amino acid hydroxylases". Annual Review of Biochemistry. 68: 355–81. doi:10.1146/annurev.biochem.68.1.355. PMID 10872454.
- ^ Kaufman S (februar 1958). "A new cofactor required for the enzymatic conversion of phenylalanine to tyrosine". The Journal of Biological Chemistry. 230 (2): 931–9. PMID 13525410.
- ^ a b c d e f Fitzpatrick PF (decembar 2003). "Mechanism of aromatic amino acid hydroxylation". Biochemistry. 42 (48): 14083–91. doi:10.1021/bi035656u. PMC 1635487. PMID 14640675.
- ^ Panay AJ, Lee M, Krebs C, Bollinger JM, Fitzpatrick PF (mart 2011). "Evidence for a high-spin Fe(IV) species in the catalytic cycle of a bacterial phenylalanine hydroxylase". Biochemistry. 50 (11): 1928–33. doi:10.1021/bi1019868. PMC 3059337. PMID 21261288.
- ^ Bassan A, Blomberg MR, Siegbahn PE (januar 2003). "Mechanism of dioxygen cleavage in tetrahydrobiopterin-dependent amino acid hydroxylases". Chemistry. 9 (1): 106–15. doi:10.1002/chem.200390006. PMID 12506369.
- ^ Olsson E, Martinez A, Teigen K, Jensen VR (mart 2011). "Formation of the iron-oxo hydroxylating species in the catalytic cycle of aromatic amino acid hydroxylases". Chemistry. 17 (13): 3746–58. doi:10.1002/chem.201002910. PMID 21351297.
- ^ Bassan A, Blomberg MR, Siegbahn PE (septembar 2003). "Mechanism of aromatic hydroxylation by an activated FeIV=O core in tetrahydrobiopterin-dependent hydroxylases". Chemistry. 9 (17): 4055–67. doi:10.1002/chem.200304768. PMID 12953191.
- ^ Pavon JA, Fitzpatrick PF (septembar 2006). "Insights into the catalytic mechanisms of phenylalanine and tryptophan hydroxylase from kinetic isotope effects on aromatic hydroxylation". Biochemistry. 45 (36): 11030–7. doi:10.1021/bi0607554. PMC 1945167. PMID 16953590.
- ^ a b c d e f g h i j Flatmark T, Stevens RC (august 1999). "Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms". Chemical Reviews. 99 (8): 2137–2160. doi:10.1021/cr980450y. PMID 11849022.
- ^ Selwood T, Jaffe EK (mart 2012). "Dynamic dissociating homo-oligomers and the control of protein function". Archives of Biochemistry and Biophysics. 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ a b c Jaffe EK, Stith L, Lawrence SH, Andrake M, Dunbrack RL (februar 2013). "A new model for allosteric regulation of phenylalanine hydroxylase: implications for disease and therapeutics". Archives of Biochemistry and Biophysics. 530 (2): 73–82. doi:10.1016/j.abb.2012.12.017. PMC 3580015. PMID 23296088.
- ^ "UniProt, P00439". Pristupljeno 12. 8. 2021.
- ^ Arturo EC, Gupta K, Héroux A, Stith L, Cross PJ, Parker EJ, Loll PJ, Jaffe EK (mart 2016). "First structure of full-length mammalian phenylalanine hydroxylase reveals the architecture of an autoinhibited tetramer". Proceedings of the National Academy of Sciences of the United States of America. 113 (9): 2394–9. doi:10.1073/pnas.1516967113. PMC 4780608. PMID 26884182.
- ^ Jaffe EK (august 2017). "New protein structures provide an updated understanding of phenylketonuria". Molecular Genetics and Metabolism. 121 (4): 289–296. doi:10.1016/j.ymgme.2017.06.005. PMC 5549558. PMID 28645531.
- ^ Patel D, Kopec J, Fitzpatrick F, McCorvie TJ, Yue WW (april 2016). "Structural basis for ligand-dependent dimerization of phenylalanine hydroxylase regulatory domain". Scientific Reports (jezik: engleski). 6 (1): 23748. doi:10.1038/srep23748. PMC 4822156. PMID 27049649.
- ^ Meisburger SP, Taylor AB, Khan CA, Zhang S, Fitzpatrick PF, Ando N (maj 2016). "Domain Movements upon Activation of Phenylalanine Hydroxylase Characterized by Crystallography and Chromatography-Coupled Small-Angle X-ray Scattering". Journal of the American Chemical Society (jezik: engleski). 138 (20): 6506–16. doi:10.1021/jacs.6b01563. PMC 4896396. PMID 27145334.
- ^ a b Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (decembar 1997). "Crystal structure of the catalytic domain of human phenylalanine hydroxylase reveals the structural basis for phenylketonuria". Nature Structural Biology. 4 (12): 995–1000. doi:10.1038/nsb1297-995. PMID 9406548. S2CID 6293946.
- ^ Andersen OA, Flatmark T, Hough E (juli 2002). "Crystal structure of the ternary complex of the catalytic domain of human phenylalanine hydroxylase with tetrahydrobiopterin and 3-(2-thienyl)-L-alanine, and its implications for the mechanism of catalysis and substrate activation". Journal of Molecular Biology. 320 (5): 1095–108. doi:10.1016/S0022-2836(02)00560-0. PMID 12126628.
- ^ Teigen K, Frøystein NA, Martínez A (decembar 1999). "The structural basis of the recognition of phenylalanine and pterin cofactors by phenylalanine hydroxylase: implications for the catalytic mechanism". Journal of Molecular Biology. 294 (3): 807–23. doi:10.1006/jmbi.1999.3288. PMID 10610798.
- ^ a b Li J, Dangott LJ, Fitzpatrick PF (april 2010). "Regulation of phenylalanine hydroxylase: conformational changes upon phenylalanine binding detected by hydrogen/deuterium exchange and mass spectrometry". Biochemistry. 49 (15): 3327–35. doi:10.1021/bi1001294. PMC 2855537. PMID 20307070.
- ^ Li J, Ilangovan U, Daubner SC, Hinck AP, Fitzpatrick PF (januar 2011). "Direct evidence for a phenylalanine site in the regulatory domain of phenylalanine hydroxylase". Archives of Biochemistry and Biophysics. 505 (2): 250–5. doi:10.1016/j.abb.2010.10.009. PMC 3019263. PMID 20951114.
- ^ a b c Kobe B, Jennings IG, House CM, Michell BJ, Goodwill KE, Santarsiero BD, Stevens RC, Cotton RG, Kemp BE (maj 1999). "Structural basis of autoregulation of phenylalanine hydroxylase". Nature Structural Biology. 6 (5): 442–8. doi:10.1038/8247. PMID 10331871. S2CID 11709986.
- ^ Daubner SC, Hillas PJ, Fitzpatrick PF (decembar 1997). "Expression and characterization of the catalytic domain of human phenylalanine hydroxylase". Archives of Biochemistry and Biophysics. 348 (2): 295–302. doi:10.1006/abbi.1997.0435. PMID 9434741.
- ^ a b Bjørgo E, de Carvalho RM, Flatmark T (februar 2001). "A comparison of kinetic and regulatory properties of the tetrameric and dimeric forms of wild-type and Thr427-->Pro mutant human phenylalanine hydroxylase: contribution of the flexible hinge region Asp425-Gln429 to the tetramerization and cooperative substrate binding". European Journal of Biochemistry. 268 (4): 997–1005. doi:10.1046/j.1432-1327.2001.01958.x. PMID 11179966.
- ^ a b c d Kaufman S (mart 1999). "A model of human phenylalanine metabolism in normal subjects and in phenylketonuric patients". Proceedings of the National Academy of Sciences of the United States of America. 96 (6): 3160–4. doi:10.1073/pnas.96.6.3160. PMC 15912. PMID 10077654.
- ^ Lichter-Konecki U, Hipke CM, Konecki DS (august 1999). "Human phenylalanine hydroxylase gene expression in kidney and other nonhepatic tissues". Molecular Genetics and Metabolism. 67 (4): 308–16. doi:10.1006/mgme.1999.2880. PMID 10444341.
- ^ Muntau AC, Gersting SW (decembar 2010). "Phenylketonuria as a model for protein misfolding diseases and for the development of next generation orphan drugs for patients with inborn errors of metabolism". Journal of Inherited Metabolic Disease. 33 (6): 649–58. doi:10.1007/s10545-010-9185-4. PMID 20824346. S2CID 20843095.
Dopunska literatura
uredi- Eisensmith RC, Woo SL (1993). "Molecular basis of phenylketonuria and related hyperphenylalaninemias: mutations and polymorphisms in the human phenylalanine hydroxylase gene". Human Mutation. 1 (1): 13–23. doi:10.1002/humu.1380010104. PMID 1301187. S2CID 19476605.
- Konecki DS, Lichter-Konecki U (august 1991). "The phenylketonuria locus: current knowledge about alleles and mutations of the phenylalanine hydroxylase gene in various populations". Human Genetics. 87 (4): 377–88. doi:10.1007/BF00197152. PMID 1679029. S2CID 25627287.
- Cotton RG (1991). "Heterogeneity of phenylketonuria at the clinical, protein and DNA levels". Journal of Inherited Metabolic Disease. 13 (5): 739–50. doi:10.1007/BF01799577. PMID 2246858. S2CID 21931016.
- Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (decembar 1997). "Crystal structure of the catalytic domain of human phenylalanine hydroxylase reveals the structural basis for phenylketonuria". Nature Structural Biology. 4 (12): 995–1000. doi:10.1038/nsb1297-995. PMID 9406548. S2CID 6293946.
- Waters PJ, Parniak MA, Nowacki P, Scriver CR (1998). "In vitro expression analysis of mutations in phenylalanine hydroxylase: linking genotype to phenotype and structure to function". Human Mutation. 11 (1): 4–17. doi:10.1002/(SICI)1098-1004(1998)11:1<4::AID-HUMU2>3.0.CO;2-L. PMID 9450897.
- Waters PJ (april 2003). "How PAH gene mutations cause hyper-phenylalaninemia and why mechanism matters: insights from in vitro expression". Human Mutation. 21 (4): 357–69. doi:10.1002/humu.10197. PMID 12655545. S2CID 23769500.
Vanjski linkovi
uredi- GeneReviews/NCBI/NIH/UW entry on Phenylalanine Hydroxylase Deficiency
- Locus-specific database of the human phenylalanine hydroxylase gene variants
- Molecule of the Month: Phenylalanine Hydroxylase Arhivirano 16. 10. 2015. na Wayback Machine
- P00439