Dihidrofolat-reduktaza
Dihdrofolat-reduktaza (DHFR) je enzim koji redukuje dihidrofolnu kiselinu na tetrahidrofolnu kiselinu, koristeći NADPH kao donor elektrona, koji se može pretvoriti u vrste tetrahidrofolata kofaktor koji se koristi u hemiji prenosa sa ugljikom1. Kod ljudi, enzim DHFR kodira gen DHFR.[5][6] Nalazi se ns poziciji regiona q11→q22 hromosoma 5.[7] Bakterijske vrste imaju različite DHFR enzime (zasnovane na njihovom obrascu vezanja diaminoheterocikličnih molekula), ali sisarski DHFR-i su vrlo slični.[8]
| Dihidrofolat-reduktaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kristalna struktura dihidrofolat-reduktaze pileće jetre. PDB unos 8dfr} | |||||||||
| Identifikatori | |||||||||
| EC broj | 1.5.1.3 | ||||||||
| CAS broj | 9002-03-3 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA unos | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG unos | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| PDB strukture | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologija gena | AmiGO / QuickGO | ||||||||
| |||||||||
| Dihidrofolat-reduktaza | |
|---|---|
| Identifikatori | |
| Simbol | DHFR_1 |
| R67 dihidrofolat-reduktaza | |
|---|---|
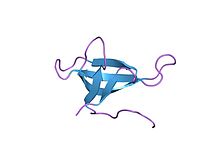 Struktura visoke rezolucije dihidrofolat-reduktaze kodirane plazmidom iz E. coli. PDBe-2gqv | |
| Identifikatori | |
| Simbol | DHFR_2 |
Struktura
urediCentralni osmolančani beta-nabrani list čini glavnu karakteristiku polipeptidnog savijanja DHFR-a.[9] Sedam od ovih lanaca je paralelno, a osmi protiče antiparalelno. Četiri alfa-heliksa povezuju uzastopne beta-lance.[10] Aminokiselinski ostaci 9 - 24 nazivaju se "Met20" ili "petlja 1" i, zajedno s ostalim petljama, dio su glavneog poddomena koji okružuje aktivno mjesto.[11] Aktivno mjesto nalazi se u polovini sekvence N-kraja, koja uključuje konzervirani Pro –x Trp dipeptid ; pokazalo se da je triptofan uključen u vezanje supstrata pomoću enzima.[12]
Funkcija
urediDihidrofolat-reduktaza pretvara dihidrofolat u tetrahidrofolat, protonski šatl potreban za de novo sintezu purina, timidilnske kiseline i određenih aminokiselina . Dok je funkcionalni gen dihidrofolat reduktaze mapiran na hromosomu 5, na odvojenim hromosomima identificirani su višestruko obrađeni pseudogeni ili geni nalik onim za dihidrofolat-reduktazu, bez introna.[13]
Pronađen u svim organizmima, DHFR ima presudnu ulogu u regulaciji količine tetrahidrofolata u ćeliji. Tetrahidrofolat i njegovi derivati su neophodni za sintezu purina i timidilata, koji su važni za proliferaciju i rast ćelija.[14] DHFR ima središnju ulogu u sintezi prekursora nukleinskih kiselina, a pokazano je da je mutantnim ćelijama kojima potpuno nedostaje DHFR potrebna aminokiselina glicin i timidin za rast.[15] DHFR se također ispoljava kao enzim koji učestvuje u spašavanju tetrahidrobiopterina iz dihidrobiopterina.[16]
Mehanizam
urediOpći mehanizam
urediDHFR katalizira transfer hidrida iz NADPH u dihidrofolat sa pratećom protonacijom, da bi se dobio tetrahidrofolat. Na kraju se dihidrofolat redukuje u tetrahidrofolat, a NADPH se oksidira u NADP+. Visoka fleksibilnost Met20 i drugih petlji u blizini aktivnog mjesta ima ulogu u promociji oslobađanja proizvoda, tetrahidrofolata.[11]
Mehanizam ovog enzima je postepen i ustaljen. Konkretno, katalitska reakcija započinje s NADPH i supstratom, koji se veže na mjesto vezanja enzima, nakon čega slijedi protonacija i prijenos hidrida iz kofaktora NADPH u supstrat. Međutim, dva posljednja koraka ne odvijaju se istovremeno u istom prijelaznom stanju.[17][18] U studiji koja koristi računarski i eksperimentalni pristup, Liu i suradnici zaključuju da prijenosu hidrida prethodi korak protonacije.[19]
U strukturi su DHF i THF obojeni crveno, NADPH žuto, a ostatak Met20 plavo
Pokazalo se da enzimski mehanizam DHFR ovisi o pH, posebno o koraku prijenosa hidrida, jer promjene pH imaju izuzetan uticaj na elektrostatiku aktivnog mjesta i stanje ionizacije njegovih ostataka. Kiselost ciljanog dušika na supstratu važna je za vezanje supstrata za mjesto vezanja enzima za koje se pokazalo da je hidrofobno, iako ima direktan kontakt s vodom.[17][20] Asp27 je jedini nabijeni hidrofilni ostatak na mjestu vezanja, a neutralizacija punjenja na Asp27 može promijeniti pKa enzima. Asp27 ima kritičnu ulogu u katalitskom mehanizmu, pomažući protoniranje supstrata i ograničavajući supstrat u konformaciji povoljnoj za prijenos hidrida. Pokazalo se da je korak protonacije povezan s tautomerizacijom enola, iako se ova konverzija ne smatra povoljnom za doniranje protona. Dokazano je da je molekula vode uključena u korak protoniranja.[21][22][23] Ulazak molekula vode u aktivno mjesto enzima olakšan je pomoću petlje Met20.[24]
Konformacijske promjene DHFR-a
urediKatalitski ciklus reakcije pomoću DHFR uključuje pet važnih međuprodukata: holoenzim (E: NADPH), Michaelisov kompleks (E: NADPH: DHF), trostruki kompleks proizvoda ((E:NADP+:THF)), tetrahidrofolatni binarni kompleks (E:THF) i THF‚NADPH kompleks (E:NADPH:THF). Korak disocijacije proizvoda (THF) od E: NADPH: THF do E: NADPH je korak koji određuje stopu tokom stabilnog stanja prometa.[25]
U katalitskom mehanizmu DHFR-a, ključne su konformacijske promjene.[26] Petlja Met20 DHFR-a može otvoriti, zatvoriti ili začepiti aktivno mjesto.[17][22] U skladu s tim, tri različite konformacije klasificirane kao otvorena, zatvorena i začepljena stanja, dodjeljuju se Met20. Pored toga, definirana je i dodatna iskrivljena konformacija Met20 zbog njegovih nejasnih rezultata karakterizacije. Petlja Met20 uočena je u svojoj začepljenoj konformaciji u tri međuprodukta koji ligirauju proizvod, pri čemu je nikotinamidni prsten zatvoren iz aktivnog mjesta. Ova konformacijska značajka objašnjava činjenicu da se zamjena NADP+NADPH dešava prije disocijacije proizvoda. Dakle, sljedeći krug reakcije može se dogoditi nakon vezanja supstrata.
R67 DHFR
urediZbog svoje jedinstvene strukture i katalitskih karakteristika, R67 DHFR je široko proučavan. R67 DHFR je DHFR kodiran R-plazmidom tipa II, bez genetičke i strukturne veze sa hromosomskim DHFR E. coli. To je homotetramer koji ima 222 simetrije sa jednom aktivnom porom, koja je izložena rastvaraču [nul].[27] Ova simetrija aktivnog mjesta rezultira različitim načinom vezanja enzima: može se vezati s dvije molekule dihidrofolata (DHF), s pozitivnom kooperativnošću ili dvije molekule NADPH s negativnom kooperativnošću ili jednim supstratom plus jedan, ali samo ovaj drugi ima katalitsku aktivnost.[28] U usporedbi s hromosomskim DHFR E. coli, on ima veći Km u vezanju dihidrofolata (DHF) i NADPH. Mnogo niža katalitska kinetika pokazuje da je prijenos hidrida korak određivanja brzine, a ne oslobađanje proizvoda (THF).[29]
U strukturi R67 DHFR, homotetramer stvara pore aktivnog mjesta. U katalitskom procesu DHF i NADPH ulaze u pore iz suprotnog položaja. Interakcija slaganja π-π između NADPH-ovog nikotinamidnog prstena i DHF-ovog pteridinskog prstena čvrsto povezuje dva reaktanta na aktivnom mjestu. Međutim, nakon vezanja, uočena je fleksibilnost repa p-aminobenzoilglutamata DHF, što može pospješiti stvaranje prijelaznog stanja.[30]
Klinički značaj
urediNedostatak dihidrofolat reduktaze povezan je sa megaloblastnom anemijom. Liječenje se vrši reduciranim oblicima folne kiseline. Budući da je tetrahidrofolat, proizvod ove reakcije, aktivni oblik folata kod ljudi, inhibicija DHFR-a može prouzrokovati funkcionalni nedostatak folata. DHFR je atraktivna farmaceutska meta za inhibiciju, zbog svoje ključne uloge u sintezi prekursora DNK. Trimetoprim, antibiotik, inhibira bakterijski DHFR, dok metotreksat, hemoterapijsko sredstvo, inhibira DHFR sisara. Međutim, rezistencija razvila se protiv nekih lijekova, kao rezultat mutacijskih promjena u samom DHFR-u.[31]
DHFR mutacije uzrokuju rijetku autosomno recesivnu urođenu grešku metabolizma folata, koja rezultira megaloblastičnom anemijom, pancitopenijom i ozbiljnom nedostatkom cerebralnog folata, što se može ispraviti dodatkom folinske kiseline.[32][33]
Terapijska primjena
urediBudući da je folat potreban za brzo dijeljenje ćelija da bi se stvorio timin, ovaj efekt može se koristiti kao terapeutsku prednost.
DHFR može biti usmjeren u liječenju karcinoma i kao potencijalna meta protiv bakterijskih infekcija. DHFR je odgovoran za nivoe tetrahidrofolata u ćeliji, a inhibicija DHFR može ograničiti rast i proliferaciju ćelija karakterističnih za rak i bakterijske infekcije. Metotreksat, kompetitivni inhibitor DHFR-a, jedan je takav lijek protiv raka koji inhibira DHFR.[34] Ostali lijekovi uključuju trimetoprim i pirimetamin. Ova tri se široko koriste kao antitumorska i antimikrobna sredstva.[35] Ostale klase spojeva koje ciljaju DHFR općenito, a posebno bakterijske DHFR, pripadaju klasama kao što su diaminopteridini, diaminotriazini, diaminopirolokinazolini, stilbeni, halkoni, deoksibenzoini, između ostalih.[36]
Trimetoprim je pokazao aktivnost protiv različitih Gram-pozitivnih bakterijskih patogena.[37] Međutim, rezistencija na trimetoprim i druge lijekove usmjerene na DHFR može nastati zbog različitih mehanizama koji ograničavaju uspjeh njihove terapijske upotrebe.[38][39][40] Otpor može nastati pojačavanjem DHFR gena, mutacijama u DHFR,[41][42] smanjenje uzimanja lijekova, između ostalog. Bez obzira na to, trimetoprim i sulfametoksazol u kombinaciji se već desetljećima koriste kao antibakterijsko sredstvo.
Folat je neophodan za rast ,[43] a put metabolizma folata je meta u razvoju tretmana za rak. DHFR je jedna od takvih meta. Pokazano je da režim fluorouracila, doksorubicin i metotreksata produžava preživljavanje kod pacijenata sa uznapredovalim karcinomom želuca.[44] Daljnje studije inhibitora DHFR mogu dovesti do više načina liječenja raka.
Bakterijama je također potreban DHFR za rast i razmnožavanje, pa su stoga inhibitori selektivni za bakterijski DHFR našli primjenu kao antibakterijska sredstva.
Klase malih molekula koje se koriste kao inhibitori dihidrofolat-reduktaze uključuju diaminokinazolin i diaminopirolokvinazolin,[45] diaminopirimidin, diaminopteridin i diaminotriazin.[46]
Potencijalno liječenje antraksa
urediDihidrofolat-reduktaza iz Bacillus anthracis (BaDHFR) potvrđena je meta u liječenju zarazne bolesti, antraksa. BaDHFR je manje osjetljiv na analoge trimetoprima nego dihidrofolat-reduktaza drugih vrsta kao što su Escherichia coli, Staphylococcus aureus i Streptococcus pneumoniae. Strukturno poravnanje dihidrofolat-reduktaze iz sve četiri vrste pokazuje da samo BaDHFR ima kombinaciju fenilalanina i tirozina na pozicijama 96, odnosno 102.
Otpornost BaDHFR na analoge trimetoprima, posljedica je ova dva ostatka (F96 i Y102), koji također daju poboljšanu kinetiku i katalitsku efikasnost.[47] Sadašnja istraživanja koriste aktivne mutante u BaDHFR za usmjeravanje optimizacije olova za nove inhibitore antifolata.
Alat za istraživanje
urediDHFR se koristi kao alat za otkrivanje interakcija protein-protein u testu komplementacije protein-fragmenta (PCA).
CHO ćelije
urediDHFR kojima nedostaju CHO ćelije najčešće su korištene ćelijske linije za proizvodnju rekombinantnih proteina. Te ćelije se transfektiraju plazmidom koji nosi gen dhfr i gen za rekombinantni protein u jednom ekspresijskom sistemu, a zatim se podvrgavaju selektivnim uslovima u nedostajanju timidinske podloge. Opstaju samo ćelije s egzogenim genom DHFR, zajedno sa genom od interesa.
Interakcije
urediPokazalo se da je dihidrofolat-reduktaza u interakcijama sa GroEL[48] i Mdm2.[49]
Mapa interaktivnog puta
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000228716 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000021707 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Chen MJ, Shimada T, Moulton AD, Harrison M, Nienhuis AW (decembar 1982). "Intronless human dihydrofolate reductase genes are derived from processed RNA molecules". Proceedings of the National Academy of Sciences of the United States of America. 79 (23): 7435–9. Bibcode:1982PNAS...79.7435C. doi:10.1073/pnas.79.23.7435. PMC 347354. PMID 6961421.
- ^ Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (mart 1984). "The functional human dihydrofolate reductase gene". The Journal of Biological Chemistry. 259 (6): 3933–43. doi:10.1016/S0021-9258(17)43186-3. PMID 6323448. Arhivirano s originala, 25. 1. 2020. Pristupljeno 26. 2. 2021.
- ^ Funanage VL, Myoda TT, Moses PA, Cowell HR (oktobar 1984). "Assignment of the human dihydrofolate reductase gene to the q11----q22 region of chromosome 5". Molecular and Cellular Biology. 4 (10): 2010–6. doi:10.1128/mcb.4.10.2010. PMC 369017. PMID 6504041.
- ^ Smith SL, Patrick P, Stone D, Phillips AW, Burchall JJ (novembar 1979). "Porcine liver dihydrofolate reductase. Purification, properties, and amino acid sequence". The Journal of Biological Chemistry. 254 (22): 11475–84. doi:10.1016/S0021-9258(19)86510-9. PMID 500653.
- ^ Matthews DA, Alden RA, Bolin JT, Freer ST, Hamlin R, Xuong N, Kraut J, Poe M, Williams M, Hoogsteen K (juli 1977). "Dihydrofolate reductase: x-ray structure of the binary complex with methotrexate". Science. 197 (4302): 452–5. Bibcode:1977Sci...197..452M. doi:10.1126/science.17920. PMID 17920.
- ^ Filman DJ, Bolin JT, Matthews DA, Kraut J (novembar 1982). "Crystal structures of Escherichia coli and Lactobacillus casei dihydrofolate reductase refined at 1.7 Å resolution. II. Environment of bound NADPH and implications for catalysis". The Journal of Biological Chemistry. 257 (22): 13663–72. doi:10.1016/S0021-9258(18)33498-7. PMID 6815179.
- ^ a b Osborne MJ, Schnell J, Benkovic SJ, Dyson HJ, Wright PE (august 2001). "Backbone dynamics in dihydrofolate reductase complexes: role of loop flexibility in the catalytic mechanism". Biochemistry. 40 (33): 9846–59. doi:10.1021/bi010621k. PMID 11502178.
- ^ Bolin JT, Filman DJ, Matthews DA, Hamlin RC, Kraut J (novembar 1982). "Crystal structures of Escherichia coli and Lactobacillus casei dihydrofolate reductase refined at 1.7 Å resolution. I. General features and binding of methotrexate". The Journal of Biological Chemistry. 257 (22): 13650–62. doi:10.1016/S0021-9258(18)33497-5. PMID 6815178.
- ^ "Entrez Gene: DHFR dihydrofolate reductase".
- ^ Schnell JR, Dyson HJ, Wright PE (2004). "Structure, dynamics, and catalytic function of dihydrofolate reductase". Annual Review of Biophysics and Biomolecular Structure. 33 (1): 119–40. doi:10.1146/annurev.biophys.33.110502.133613. PMID 15139807.
- ^ Urlaub G, Chasin LA (juli 1980). "Isolation of Chinese hamster cell mutants deficient in dihydrofolate reductase activity". Proceedings of the National Academy of Sciences of the United States of America. 77 (7): 4216–20. Bibcode:1980PNAS...77.4216U. doi:10.1073/pnas.77.7.4216. PMC 349802. PMID 6933469.
- ^ Crabtree MJ, Tatham AL, Hale AB, Alp NJ, Channon KM (oktobar 2009). "Critical role for tetrahydrobiopterin recycling by dihydrofolate reductase in regulation of endothelial nitric-oxide synthase coupling: relative importance of the de novo biopterin synthesis versus salvage pathways". The Journal of Biological Chemistry. 284 (41): 28128–36. doi:10.1074/jbc.M109.041483. PMC 2788863. PMID 19666465.
- ^ a b c Rod TH, Brooks CL (juli 2003). "How dihydrofolate reductase facilitates protonation of dihydrofolate". Journal of the American Chemical Society. 125 (29): 8718–9. doi:10.1021/ja035272r. PMID 12862454.
- ^ Wan Q, Bennett BC, Wilson MA, Kovalevsky A, Langan P, Howell EE, Dealwis C (decembar 2014). "Toward resolving the catalytic mechanism of dihydrofolate reductase using neutron and ultrahigh-resolution X-ray crystallography". Proceedings of the National Academy of Sciences of the United States of America. 111 (51): 18225–30. Bibcode:2014PNAS..11118225W. doi:10.1073/pnas.1415856111. PMC 4280638. PMID 25453083.
- ^ Liu CT, Francis K, Layfield JP, Huang X, Hammes-Schiffer S, Kohen A, Benkovic SJ (decembar 2014). "Escherichia coli dihydrofolate reductase catalyzed proton and hydride transfers: temporal order and the roles of Asp27 and Tyr100". Proceedings of the National Academy of Sciences of the United States of America. 111 (51): 18231–6. Bibcode:2014PNAS..11118231L. doi:10.1073/pnas.1415940111. PMC 4280594. PMID 25453098.
- ^ Czekster CM, Vandemeulebroucke A, Blanchard JS (januar 2011). "Kinetic and chemical mechanism of the dihydrofolate reductase from Mycobacterium tuberculosis". Biochemistry. 50 (3): 367–75. doi:10.1021/bi1016843. PMC 3074011. PMID 21138249.
- ^ Reyes VM, Sawaya MR, Brown KA, Kraut J (februar 1995). "Isomorphous crystal structures of Escherichia coli dihydrofolate reductase complexed with folate, 5-deazafolate, and 5,10-dideazatetrahydrofolate: mechanistic implications". Biochemistry. 34 (8): 2710–23. doi:10.1021/bi00008a039. PMID 7873554.
- ^ a b Sawaya MR, Kraut J (januar 1997). "Loop and subdomain movements in the mechanism of Escherichia coli dihydrofolate reductase: crystallographic evidence". Biochemistry. 36 (3): 586–603. doi:10.1021/bi962337c. PMID 9012674.
- ^ Chen YQ, Kraut J, Blakley RL, Callender R (juni 1994). "Determination by Raman spectroscopy of the pKa of N5 of dihydrofolate bound to dihydrofolate reductase: mechanistic implications". Biochemistry. 33 (23): 7021–6. doi:10.1021/bi00189a001. PMID 8003467.
- ^ Shrimpton P, Allemann RK (juni 2002). "Role of water in the catalytic cycle of E. coli dihydrofolate reductase". Protein Science. 11 (6): 1442–51. doi:10.1110/ps.5060102. PMC 2373639. PMID 12021443.
- ^ Fierke CA, Johnson KA, Benkovic SJ (juni 1987). "Construction and evaluation of the kinetic scheme associated with dihydrofolate reductase from Escherichia coli". Biochemistry. 26 (13): 4085–92. doi:10.1021/bi00387a052. PMID 3307916.
- ^ Antikainen NM, Smiley RD, Benkovic SJ, Hammes GG (decembar 2005). "Conformation coupled enzyme catalysis: single-molecule and transient kinetics investigation of dihydrofolate reductase". Biochemistry. 44 (51): 16835–43. doi:10.1021/bi051378i. PMID 16363797.
- ^ Narayana N, Matthews DA, Howell EE, Nguyen-huu X (novembar 1995). "A plasmid-encoded dihydrofolate reductase from trimethoprim-resistant bacteria has a novel D2-symmetric active site". Nature Structural Biology. 2 (11): 1018–25. doi:10.1038/nsb1195-1018. PMID 7583655.
- ^ Bradrick TD, Beechem JM, Howell EE (septembar 1996). "Unusual binding stoichiometries and cooperativity are observed during binary and ternary complex formation in the single active pore of R67 dihydrofolate reductase, a D2 symmetric protein". Biochemistry. 35 (35): 11414–24. doi:10.1021/bi960205d. PMID 8784197.
- ^ Park H, Zhuang P, Nichols R, Howell EE (januar 1997). "Mechanistic studies of R67 dihydrofolate reductase. Effects of pH and an H62C mutation". The Journal of Biological Chemistry. 272 (4): 2252–8. doi:10.1074/jbc.272.4.2252. PMID 8999931.
- ^ Kamath G, Howell EE, Agarwal PK (oktobar 2010). "The tail wagging the dog: insights into catalysis in R67 dihydrofolate reductase". Biochemistry. 49 (42): 9078–88. doi:10.1021/bi1007222. PMID 20795731.
- ^ Cowman AF, Lew AM (novembar 1989). "Antifolate drug selection results in duplication and rearrangement of chromosome 7 in Plasmodium chabaudi". Molecular and Cellular Biology. 9 (11): 5182–8. doi:10.1128/mcb.9.11.5182. PMC 363670. PMID 2601715.
- ^ Banka S, Blom HJ, Walter J, Aziz M, Urquhart J, Clouthier CM, et al. (februar 2011). "Identification and characterization of an inborn error of metabolism caused by dihydrofolate reductase deficiency". American Journal of Human Genetics. 88 (2): 216–25. doi:10.1016/j.ajhg.2011.01.004. PMC 3035707. PMID 21310276.
- ^ Nyhan, William L; Hoffmann, Georg F.; Barshop, Bruce A (30. 12. 2011). Atlas of Inherited Metabolic Diseases 3E. CRC Press. str. 141–. ISBN 978-1-4441-4948-7.
- ^ Li R, Sirawaraporn R, Chitnumsub P, Sirawaraporn W, Wooden J, Athappilly F, Turley S, Hol WG (januar 2000). "Three-dimensional structure of M. tuberculosis dihydrofolate reductase reveals opportunities for the design of novel tuberculosis drugs". Journal of Molecular Biology. 295 (2): 307–23. doi:10.1006/jmbi.1999.3328. PMID 10623528.
- ^ Benkovic SJ, Fierke CA, Naylor AM (mart 1988). "Insights into enzyme function from studies on mutants of dihydrofolate reductase". Science. 239 (4844): 1105–10. Bibcode:1988Sci...239.1105B. doi:10.1126/science.3125607. PMID 3125607.
- ^ Srinivasan B, Tonddast-Navaei S, Roy A, Zhou H, Skolnick J (septembar 2018). "Chemical space of Escherichia coli dihydrofolate reductase inhibitors: New approaches for discovering novel drugs for old bugs". Medicinal Research Reviews. 39 (2): 684–705. doi:10.1002/med.21538. PMC 6370515. PMID 30192413.
- ^ Hawser S, Lociuro S, Islam K (mart 2006). "Dihydrofolate reductase inhibitors as antibacterial agents". Biochemical Pharmacology. 71 (7): 941–8. doi:10.1016/j.bcp.2005.10.052. PMID 16359642.
- ^ Narayana N, Matthews DA, Howell EE, Nguyen-huu X (novembar 1995). "A plasmid-encoded dihydrofolate reductase from trimethoprim-resistant bacteria has a novel D2-symmetric active site". Nature Structural Biology. 2 (11): 1018–25. doi:10.1038/nsb1195-1018. PMID 7583655.
- ^ Huennekens FM (juni 1996). "In search of dihydrofolate reductase". Protein Science. 5 (6): 1201–8. doi:10.1002/pro.5560050626. PMC 2143423. PMID 8762155.
- ^ Banerjee D, Mayer-Kuckuk P, Capiaux G, Budak-Alpdogan T, Gorlick R, Bertino JR (juli 2002). "Novel aspects of resistance to drugs targeted to dihydrofolate reductase and thymidylate synthase". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1587 (2–3): 164–73. doi:10.1016/S0925-4439(02)00079-0. PMID 12084458.
- ^ Toprak E, Veres A, Michel JB, Chait R, Hartl DL, Kishony R (decembar 2011). "Evolutionary paths to antibiotic resistance under dynamically sustained drug selection". Nature Genetics. 44 (1): 101–5. doi:10.1038/ng.1034. PMC 3534735. PMID 22179135.
- ^ Rodrigues JV, Bershtein S, Li A, Lozovsky ER, Hartl DL, Shakhnovich EI (mart 2016). "Biophysical principles predict fitness landscapes of drug resistance". Proceedings of the National Academy of Sciences of the United States of America. 113 (11): E1470-8. Bibcode:2016PNAS..113E1470R. doi:10.1073/pnas.1601441113. PMC 4801265. PMID 26929328.
- ^ Bailey SW, Ayling JE (septembar 2009). "The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake". Proceedings of the National Academy of Sciences of the United States of America. 106 (36): 15424–9. doi:10.1073/pnas.0902072106. PMC 2730961. PMID 19706381.
- ^ Murad AM, Santiago FF, Petroianu A, Rocha PR, Rodrigues MA, Rausch M (juli 1993). "Modified therapy with 5-fluorouracil, doxorubicin, and methotrexate in advanced gastric cancer". Cancer. 72 (1): 37–41. doi:10.1002/1097-0142(19930701)72:1<37::AID-CNCR2820720109>3.0.CO;2-P. PMID 8508427.
- ^ Srinivasan B, Skolnick J (maj 2015). "Insights into the slow-onset tight-binding inhibition of Escherichia coli dihydrofolate reductase: detailed mechanistic characterization of pyrrolo [3,2-f] quinazoline-1,3-diamine and its derivatives as novel tight-binding inhibitors". The FEBS Journal. 282 (10): 1922–38. doi:10.1111/febs.13244. PMC 4445455. PMID 25703118.
- ^ Srinivasan B, Tonddast-Navaei S, Skolnick J (oktobar 2015). "Ligand binding studies, preliminary structure-activity relationship and detailed mechanistic characterization of 1-phenyl-6,6-dimethyl-1,3,5-triazine-2,4-diamine derivatives as inhibitors of Escherichia coli dihydrofolate reductase". European Journal of Medicinal Chemistry. 103: 600–14. doi:10.1016/j.ejmech.2015.08.021. PMC 4610388. PMID 26414808.
- ^ Beierlein JM, Karri NG, Anderson AC (oktobar 2010). "Targeted mutations of Bacillus anthracis dihydrofolate reductase condense complex structure−activity relationships". Journal of Medicinal Chemistry. 53 (20): 7327–36. doi:10.1021/jm100727t. PMC 3618964. PMID 20882962.
- ^ Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (februar 1996). "Protein folding in the central cavity of the GroEL-GroES chaperonin complex". Nature. 379 (6564): 420–6. Bibcode:1996Natur.379..420M. doi:10.1038/379420a0. PMID 8559246.
- ^ Maguire M, Nield PC, Devling T, Jenkins RE, Park BK, Polański R, Vlatković N, Boyd MT (maj 2008). "MDM2 regulates dihydrofolate reductase activity through monoubiquitination". Cancer Research. 68 (9): 3232–42. doi:10.1158/0008-5472.CAN-07-5271. PMC 3536468. PMID 18451149.
Dopunska literatura
uredi- Joska TM, Anderson AC (oktobar 2006). "Structure-activity relationships of Bacillus cereus and Bacillus anthracis dihydrofolate reductase: toward the identification of new potent drug leads". Antimicrobial Agents and Chemotherapy. 50 (10): 3435–43. doi:10.1128/AAC.00386-06. PMC 1610094. PMID 17005826.
- Chan DC, Fu H, Forsch RA, Queener SF, Rosowsky A (juni 2005). "Design, synthesis, and antifolate activity of new analogues of piritrexim and other diaminopyrimidine dihydrofolate reductase inhibitors with omega-carboxyalkoxy or omega-carboxy-1-alkynyl substitution in the side chain". Journal of Medicinal Chemistry. 48 (13): 4420–31. doi:10.1021/jm0581718. PMID 15974594.
- Banerjee D, Mayer-Kuckuk P, Capiaux G, Budak-Alpdogan T, Gorlick R, Bertino JR (juli 2002). "Novel aspects of resistance to drugs targeted to dihydrofolate reductase and thymidylate synthase". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1587 (2–3): 164–73. doi:10.1016/S0925-4439(02)00079-0. PMID 12084458.
- Stockman BJ, Nirmala NR, Wagner G, Delcamp TJ, DeYarman MT, Freisheim JH (januar 1992). "Sequence-specific 1H and 15N resonance assignments for human dihydrofolate reductase in solution". Biochemistry. 31 (1): 218–29. doi:10.1021/bi00116a031. PMID 1731871.
- Beltzer JP, Spiess M (decembar 1991). "In vitro binding of the asialoglycoprotein receptor to the beta adaptin of plasma membrane coated vesicles". The EMBO Journal. 10 (12): 3735–42. doi:10.1002/j.1460-2075.1991.tb04942.x. PMC 453108. PMID 1935897.
- Davies JF, Delcamp TJ, Prendergast NJ, Ashford VA, Freisheim JH, Kraut J (oktobar 1990). "Crystal structures of recombinant human dihydrofolate reductase complexed with folate and 5-deazafolate". Biochemistry. 29 (40): 9467–79. doi:10.1021/bi00492a021. PMID 2248959.
- Will CL, Dolnick BJ (decembar 1989). "5-Fluorouracil inhibits dihydrofolate reductase precursor mRNA processing and/or nuclear mRNA stability in methotrexate-resistant KB cells". The Journal of Biological Chemistry. 264 (35): 21413–21. doi:10.1016/S0021-9258(19)30096-1. PMID 2592384.
- Masters JN, Attardi G (mart 1985). "Discrete human dihydrofolate reductase gene transcripts present in polysomal RNA map with their 5' ends several hundred nucleotides upstream of the main mRNA start site". Molecular and Cellular Biology. 5 (3): 493–500. doi:10.1128/mcb.5.3.493. PMC 366741. PMID 2859520.
- Miszta H, Dabrowski Z, Lanotte M (novembar 1988). "In vitro patterns of enzymic tetrahydrofolate dehydrogenase (EC 1.5.1.3) expression in bone marrow stromal cells". Leukemia. 2 (11): 754–9. PMID 3185016.
- Oefner C, D'Arcy A, Winkler FK (juni 1988). "Crystal structure of human dihydrofolate reductase complexed with folate". European Journal of Biochemistry / FEBS. 174 (2): 377–85. doi:10.1111/j.1432-1033.1988.tb14108.x. PMID 3383852.
- Yang JK, Masters JN, Attardi G (juni 1984). "Human dihydrofolate reductase gene organization. Extensive conservation of the G + C-rich 5' non-coding sequence and strong intron size divergence from homologous mammalian genes". Journal of Molecular Biology. 176 (2): 169–87. doi:10.1016/0022-2836(84)90419-4. PMID 6235374.
- Masters JN, Yang JK, Cellini A, Attardi G (juni 1983). "A human dihydrofolate reductase pseudogene and its relationship to the multiple forms of specific messenger RNA". Journal of Molecular Biology. 167 (1): 23–36. doi:10.1016/S0022-2836(83)80032-1. PMID 6306253.
- Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (mart 1984). "The functional human dihydrofolate reductase gene". The Journal of Biological Chemistry. 259 (6): 3933–43. doi:10.1016/S0021-9258(17)43186-3. PMID 6323448.
- Funanage VL, Myoda TT, Moses PA, Cowell HR (oktobar 1984). "Assignment of the human dihydrofolate reductase gene to the q11----q22 region of chromosome 5". Molecular and Cellular Biology. 4 (10): 2010–6. doi:10.1128/mcb.4.10.2010. PMC 369017. PMID 6504041.
- Masters JN, Attardi G (1983). "The nucleotide sequence of the cDNA coding for the human dihydrofolic acid reductase". Gene. 21 (1–2): 59–63. doi:10.1016/0378-1119(83)90147-6. PMID 6687716.
- Morandi C, Masters JN, Mottes M, Attardi G (april 1982). "Multiple forms of human dihydrofolate reductase messenger RNA. Cloning and expression in Escherichia coli of their DNA coding sequence". Journal of Molecular Biology. 156 (3): 583–607. doi:10.1016/0022-2836(82)90268-6. PMID 6750132.
- Bonifaci N, Sitia R, Rubartelli A (septembar 1995). "Nuclear translocation of an exogenous fusion protein containing HIV Tat requires unfolding". AIDS. 9 (9): 995–1000. doi:10.1097/00002030-199509000-00003. PMID 8527095.
- Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (februar 1996). "Protein folding in the central cavity of the GroEL-GroES chaperonin complex". Nature. 379 (6564): 420–6. Bibcode:1996Natur.379..420M. doi:10.1038/379420a0. PMID 8559246.
- Gross M, Robinson CV, Mayhew M, Hartl FU, Radford SE (decembar 1996). "Significant hydrogen exchange protection in GroEL-bound DHFR is maintained during iterative rounds of substrate cycling". Protein Science. 5 (12): 2506–13. doi:10.1002/pro.5560051213. PMC 2143321. PMID 8976559.
- Schleiff E, Shore GC, Goping IS (mart 1997). "Human mitochondrial import receptor, Tom20p. Use of glutathione to reveal specific interactions between Tom20-glutathione S-transferase and mitochondrial precursor proteins". FEBS Letters. 404 (2–3): 314–8. doi:10.1016/S0014-5793(97)00145-2. PMID 9119086.
- Cody V, Galitsky N, Luft JR, Pangborn W, Rosowsky A, Blakley RL (novembar 1997). "Comparison of two independent crystal structures of human dihydrofolate reductase ternary complexes reduced with nicotinamide adenine dinucleotide phosphate and the very tight-binding inhibitor PT523". Biochemistry. 36 (45): 13897–903. doi:10.1021/bi971711l. PMID 9374868.
- Vanguri VK, Wang S, Godyna S, Ranganathan S, Liau G (april 2000). "Thrombospondin-1 binds to polyhistidine with high affinity and specificity". The Biochemical Journal. 347 (Pt 2): 469–73. doi:10.1042/0264-6021:3470469. PMC 1220979. PMID 10749676.




