Karcinogeneza
Karcinogeneza, koja se naziva i onkogeneza ili tumorigeneza jest proces stvaranje kancera i benignih tumora, pri čemu su normalne ćelije transformiraju u ćelija raka. Proces karakteriziraju promjene na ćelijskim, genetičkim i epigenetičim nivoima i abnormalna ćelijska dioba. Podjela ćelija je fiziološki proces koji se javlja u gotovo svim tkivima i pod različitim okolnostima. Normalno, ravnoteža između proliferacije i programirane ćelijske smrti, u obliku apoptoze, održava se na integritet tkiva i organa. Prema prevladavajućoj prihvaćenoj teoriji karcinogeneze, teoriji somatskih mutacija, mutacija u DNK i epimutacija koje dovode do raka remete pravilnost ove ovih procesa, ometajući programiranje koje ih regulira, narušavajući normalnu ravnotežu između proliferacije i ćelijske smrti. To rezultira nekontroliranom diobom ćelija i evolucije tih ćelija pomoću prirodne selekcije u tijelu. Samo određene mutacije dovode do raka, dok većina mutacija ne.
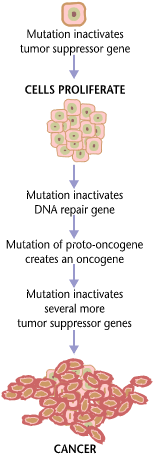
Varijante nasljeđenih gena mogu predisponirati nositelja za rak. Osim toga, okolišni faktori poput kancerogenih i zračenja uzrokuju mutacije koje mogu pridonijeti razvoju raka. Konačno, slučajne greške u normalnoj replikaciji DNK mogu rezultirati karcinomom, uzrokujući mutacije.[1] Obično je potreban niz od nekoliko mutacija za određene klase gena prije nego što se normalna ćelija transformira u ćeliju raka.[2][3][4][5][6] U prosjeku, naprimjer, 15 tzv. "vozačkih mutacija" i 60 "putničkih" mutacija uzrokuje rak debelog crijeva.[2] Mutacije u genima koji reguliraju diobu stanica, apoptoza (ćelijska smrt) i popravak DNK mogu rezultirati nekontroliranom proliferacijom stanica i rakom.
Kancer je u osnovi bolest regulacije rasta tkiva. Da bi se normalna ćelija transformirala u ćeliju raka, geni koje reguliraju rast i ćelijsku diferencijaciju moraju se promijeniti.[7] Genetičke i epigenetičke promjene mogu se pojaviti na mnogim razinama, od dobijanja ili gubitka čitavih hromosoma, do mutacije koja utiče na jednonukleotidni polimorfizam DNK ili do utišavanja ili aktiviranja mikroRNK koja kontrolira ekspresiju 100 do 500 gena.[8][9] Postoje dvije široke kategorije gena na koje utiču ove promjene. Onkogeni mogu biti normalni geni koji su izraženi na neprikladno visokom nivou ili izmijenjeni geni koji imaju nova svojstva. U oba slučaja, ekspresija ovih gena promovira maligni fenotip ćelija raka. Tumor-suppresorsk geni su geni koji inhibiraju ćelijsku diobu, preživljavanje ili druga svojstva ćelija raka. Geni za suzbijanje tumora često su onemogućeni genetičkim promjenama koje podstiču rak. Konačno Oncovirinae, virusi koji sadrže onkogen, kategorizirani su kao onkogeni jer izazivaju rast tumorskih tkiva u domaćinima. Ovaj proces se naziva i virusna transformacija.

| Kancer | Gen | Frevencija u kanceru | Frekvencija u defektu polja | Reference |
|---|---|---|---|---|
| Rak debelog crijeva | MGMT | 46% | 34% | [10] |
| Rak debelog crijeva | MGMT | 47% | 11% | [11] |
| Rak debelog crijeva | MGMT | 70% | 60% | [12] |
| Rak debelog crijeva | MSH2 | 13% | 5% | [11] |
| Rak debelog crijeva | ERCC1 | 100% | 40% | [13] |
| Rak debelog crijeva | PMS2 | 88% | 50% | [13] |
| Rak debelog crijeva | XPF | 55% | 40% | [13] |
| Rak glave i vrata | MGMT | 54% | 38% | [14] |
| Rak glave i vrata | MLH1 | 33% | 25% | [15] |
| Rak glave i vrata | MLH1 | 31% | 20% | [16] |
| Rak želuca | MGMT | 88% | 78% | [17] |
| Rak želuca | MLH1 | 73% | 20% | [18] |
| Rak jednjaka | MLH1 | 77%–100% | 23%–79% | [19] |
Neki od malih polipa u defektu polja prikazani na fotografiji otvorenog segmenta debelog crijeva mogu biti relativno dobroćudne neoplazme. U studiji iz 1996. o polipovima veličine manje od 10 mm koji su pronađeni tokom kolonoskopije, a nakon kojih su uslijedile ponovljene kolonoskopije tokom tri godine, 25% je ostalo nepromijenjene veličine, 35% regresirano ili smanjeno, a 40% povećano.[20]

Biološka svojstva ćelija raka
urediU Hanahanovom i Weinbergovom članku iz 2000. godine, biološka svojstva malignih tumorskih ćelija sažeta su na sljedeći način:[21]
- Sticanje samodostatnosti signala rasta, što dovodi do nekontroliranog rasta.
- Gubitak osjetljivosti na signale protiv rasta, što također dovodi do nekontroliranog rasta.
- Gubitak kapaciteta za apoptoze, omogućavajući rast uprkos genetičkim greškama i vanjskim signalima protiv rasta.
- Gubitak kapaciteta za starenje, što dovodi do neograničenog replikativnog potencijala (besmrtnost)
- Sticanje sposobnosti trajne angiogeneze, omogućavajući tumoru rast van ograničenja pasivne difuzije hranjivih tvari.
- Sticanje sposobnosti invazije na susjedna tkiva, definirajuće svojstvo invazivnog karcinoma.
- Sticanje sposobnosti sijanja metastaza na udaljenim mjestima, kasno svojstvo nekih malignih tumora (karcinoma ili drugih).
Završetak ovih više koraka bio bi vrlo rijedak događaj bez sljedećeg:
- Gubitak kapaciteta za popravljanje genetičkih grešaka, što dovodi do povećane stope mutacija (genomska nestabilnost), čime se ubrzavaju sve ostale promjene.
Ove biološke promjene su klasične u karcinomima; drugi maligni tumori možda nemaju sve. Na primjer, s obzirom na to da su invazija tkiva i podsticanje na udaljena mjesta normalnih svojstava leukocita, ti koraci nisu potrebni u razvoju leukemija. Ni različiti koraci ne predstavljaju nužno pojedinačne mutacije. Na primjer, inaktivacija jednog gena, koji kodira protein p53, uzrokovat će genomsku nestabilnost, izbjegavanje apoptoze i povećanu angiogenezu. Nadalje, ne dijele se sve ćelije raka. Umjesto toga, podskup ćelija u tumorima, zvani matične ćelije raka, repliciraju se same jer stvaraju diferencirane ćelije.[22]
Također pogledajte
urediReference
uredi- ^ Tomasetti C, Li L, Vogelstein B (23. 3. 2017). "Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention". Science. 355 (6331): 1330–1334. Bibcode:2017Sci...355.1330T. doi:10.1126/science.aaf9011. PMC 5852673. PMID 28336671.
- ^ a b Wood LD, Parsons DW, Jones S, Lin J, Sjöblom T, Leary RJ, et al. (novembar 2007). "The genomic landscapes of human breast and colorectal cancers". Science. 318 (5853): 1108–13. Bibcode:2007Sci...318.1108W. CiteSeerX 10.1.1.218.5477. doi:10.1126/science.1145720. PMID 17932254. S2CID 7586573.
- ^ Knudson AG (novembar 2001). "Two genetic hits (more or less) to cancer". Nature Reviews. Cancer. 1 (2): 157–62. doi:10.1038/35101031. PMID 11905807. S2CID 20201610.
- ^ Fearon ER, Vogelstein B (juni 1990). "A genetic model for colorectal tumorigenesis". Cell. 61 (5): 759–67. doi:10.1016/0092-8674(90)90186-I. PMID 2188735. S2CID 22975880.
- ^ Belikov, Aleksey V. (22. 9. 2017). "The number of key carcinogenic events can be predicted from cancer incidence". Scientific Reports. 7 (1): 12170. Bibcode:2017NatSR...712170B. doi:10.1038/s41598-017-12448-7. PMC 5610194. PMID 28939880.
- ^ Belikov, Aleksey V.; Vyatkin, Alexey; Leonov, Sergey V. (6. 8. 2021). "The Erlang distribution approximates the age distribution of incidence of childhood and young adulthood cancers". PeerJ (jezik: engleski). 9: e11976. doi:10.7717/peerj.11976. ISSN 2167-8359.
- ^ Croce CM (januar 2008). "Oncogenes and cancer". The New England Journal of Medicine. 358 (5): 502–11. doi:10.1056/NEJMra072367. PMID 18234754.
- ^ Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM (februar 2005). "Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs". Nature. 433 (7027): 769–73. Bibcode:2005Natur.433..769L. doi:10.1038/nature03315. PMID 15685193. S2CID 4430576.
- ^ Balaguer F, Link A, Lozano JJ, Cuatrecasas M, Nagasaka T, Boland CR, Goel A (august 2010). "Epigenetic silencing of miR-137 is an early event in colorectal carcinogenesis". Cancer Research. 70 (16): 6609–18. doi:10.1158/0008-5472.CAN-10-0622. PMC 2922409. PMID 20682795.
- ^ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (septembar 2005). "MGMT promoter methylation and field defect in sporadic colorectal cancer". Journal of the National Cancer Institute. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
- ^ a b Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (oktobar 2011). "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbeck's Archives of Surgery. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, et al. (novembar 2010). "Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers". Gut. 59 (11): 1516–26. doi:10.1136/gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ a b c Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). "Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer". Journal of Visualized Experiments (41): 1931. doi:10.3791/1931. PMC 3149991. PMID 20689513.
- ^ Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (februar 2011). "Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa". Oral Oncology. 47 (2): 104–7. doi:10.1016/j.oraloncology.2010.11.006. PMID 21147548.
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (oktobar 2009). "Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma". Otolaryngology–Head and Neck Surgery. 141 (4): 484–90. doi:10.1016/j.otohns.2009.07.007. PMID 19786217. S2CID 8357370.
- ^ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). "Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene". American Journal of Otolaryngology. 32 (6): 528–36. doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ^ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (novembar 2009). "Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions". Human Pathology. 40 (11): 1534–42. doi:10.1016/j.humpath.2009.01.029. PMID 19695681.
- ^ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). "Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley" (PDF). Asian Pacific Journal of Cancer Prevention. 13 (8): 4177–81. doi:10.7314/APJCP.2012.13.8.4177. PMID 23098428.
- ^ Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). "Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma". International Journal of Clinical and Experimental Pathology. 5 (5): 382–96. PMC 3396065. PMID 22808291. Review.
- ^ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (septembar 1996). "Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years". Gut. 39 (3): 449–56. doi:10.1136/gut.39.3.449. PMC 1383355. PMID 8949653.
- ^ Hanahan D, Weinberg RA (januar 2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9. PMID 10647931.
- ^ Cho RW, Clarke MF (februar 2008). "Recent advances in cancer stem cells". Current Opinion in Genetics & Development. 18 (1): 48–53. doi:10.1016/j.gde.2008.01.017. PMID 18356041.
Dopunska literatura
uredi- Tokar EJ, Benbrahim-Tallaa L, Waalkes MP (2011). "Chepter 14. Metal Ions in Human Cancer Development". u Astrid Sigel, Helmut Sigel and Roland K. O. Sigel (ured.). Metal ions in toxicology: effects, interactions, interdependencies. Metal Ions in Life Sciences. 8. RSC Publishing. str. 375–401. doi:10.1039/9781849732116-00375. ISBN 978-1-84973-091-4.
- Dixon K, Kopras E (decembar 2004). "Genetic alterations and DNA repair in human carcinogenesis". Seminars in Cancer Biology. 14 (6): 441–8. doi:10.1016/j.semcancer.2004.06.007. PMID 15489137.
- Kleinsmith LJ (2006). Principles of cancer biology. San Francisco: Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- Sarasin A (novembar 2003). "An overview of the mechanisms of mutagenesis and carcinogenesis". Mutation Research. 544 (2–3): 99–106. doi:10.1016/j.mrrev.2003.06.024. PMID 14644312.
- Schottenfeld D, Beebe-Dimmer JL (2005). "Advances in cancer epidemiology: understanding causal mechanisms and the evidence for implementing interventions". Annual Review of Public Health. 26: 37–60. doi:10.1146/annurev.publhealth.26.021304.144402. PMID 15760280.
- Tannock I, Hill R, Bristow R, Harrington L (2005). The basic science of oncology (4th izd.). New York: McGraw-Hill. ISBN 978-0-07-138774-3.
- Wicha MS, Liu S, Dontu G (februar 2006). "Cancer stem cells: an old idea--a paradigm shift". Cancer Research. 66 (4): 1883–90, discussion 1895–6. doi:10.1158/0008-5472.CAN-05-3153. PMID 16488983.