Homocistinurija
Homocistinurija ili HCU[2] je nasljedni poremećaj metabolizma aminokiseline metionina, zbog nedostatka cistationin beta-sintaze ili metionin-sintaze.[3] To je naslijedno autosomno recesivno svojstvo, što znači da dijete treba naslijediti kopiju oštećenog gena od oba roditelja da bi bilo pogođeno. Simptomi homocistinurije mogu biti uzrokovani i nedostatkom vitamina B6, B12 ili folata.
| Homocistinurija (Nedostatak cistationin beta-sintaze) (Nedostatak CBS)[1] 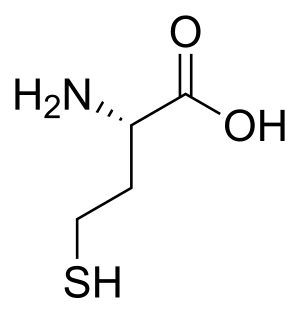 | |
|---|---|
| Klasifikacija i vanjski resursi | |
| ICD-10 | E72.1 |
| ICD-9 | 270.4 |
| OMIM | 236200 |
| DiseasesDB | 5991 |
| MedlinePlus | 001199 |
| eMedicine | derm/708 |
| MeSH | D006712 |
| GeneReviews | Homocistinurija uzrokovana nedostatkom cistationina u beta-sintazi |
Znaci i simptomi
urediOvaj nedostatak dovodi do višesistemskog poremećaja vezivnog tkiva, mišića, centralnog nervnog sistema (CNS) i kardiovaskularnog sistema. Homocistinurija predstavlja skupinu nasljednih metaboličkih poremećaja koje karakterizira akumulacija aminokiseline homocisteina u serumu i povećano izlučivanje homocisteina u urinu. Čini se da su novorođenčad normalna, a rani simptomi, ako postoje, nejasni su. Znakovi i simptomi homocistinurije koji se mogu vidjeti uključuju sljedeće:
- Porodična historija homocistinurije [4]
- Ispiranje preko obraza
- Mišićno-koštani
- Visoka, tanka građa nalik na marfanoidni habitus [1]
- Dugi udovi (dolihostenomelija)
- Visoko zasvođena stopala (pes cavus)
- Klecanje koljenima (genu valgum)
- Pectus excavatum i Pectus carinatum
- Intelektualna invalidnost
- Napadi
- Psihijatrijska bolest
- Očne anomalje:
- Ectopia lentis – za razliku od Marfanovog sindroma koji ima ectopia lentis prema gore, dislokacija prema dolje tipski je nalaz homocistinurije[5] ili subluksacija leća
- Miopija (kratkovidnost)
- Glaukom
- Optička atrofija
- Odvajanje mrežnjače[6]
- Katarakti
- Vaskularna bolest
- Homocistein se veže za endotel krvnih sudova i aktivira signalne puteve koji dovode do oslobađanja proupalnih molekula. To može uzrokovati sljedeće:
- Opsežna formacija ateroma u mladosti koja pogađa mnoge arterije, ali ne i koronarne arterije
- Intravaskularna tromboza
Uzrok
urediObično je uzrokovana nedostatkom enzima cistationin beta-sintaza, mutacijama drugih srodnih enzima kao što je metionin-sintaza ili nedostatak folne kiseline, vitamina B12 i/ili piridoksina (vitamina B6).[3]
Dijagnoza
urediPojam homocistinurija opisuje povećano izlučivanje tiola aminokiseline homocisteina mokraćom (i slučajno, također povećanu koncentraciju u plazme). Izvor ovog povećanja može biti jedan od mnogih metaboličkih faktora, od kojih je samo jedan nedostatak DZS-a. Ostali uključuju nedostatke ponovne metilacije (kobalamin nedostaci, metionin nedostatak sintaze, MTHFR) i nedostaci vitamina (nedostatak kobalamina (vitamin B12), nedostatak folata (vitamin B9) , nedostatak riboflavina (vitamin B2), piridoksal-fosfata (vitamin B6)). U svjetlu ovih informacija, za postizanje diferencijalne dijagnoze potreban je kombinirani pristup laboratorijskoj dijagnozi.
Nedostatak CBS-a može se dijagnosticirati rutinskom metaboličkom biohemijskom analizom. U prvom slučaju, analiza aminokiselina u plazmi ili urinu često će pokazati povišenje metionina i prisustvo homocisteina. Mnogi neonatalni skrining-programi uključuju metionin kao metabolit. Poremećaj se može razlikovati od defekata remetilacije (npr. MTHFR, nedostatak metionin-sintaze ili nedostaci kobalamina) umjesto povišene koncentracije metionina.[7] Pored toga, analiza organskih kiselins ili kvantitativno određivanje metilmalonske kiseline trebale bi pomoći u isključivanju nedostataka kobalamina (vitamina B12) i nedostatka vitamina B12, što daje diferencijalnu dijagnozu.[8]
Laboratorijska analiza samog homocisteina je komplicirana, jer je većina homocisteina (moguće iznad 85%) vezana za druge tiol-aminokiseline i proteine u obliku disulfida (npr. cistein u cistin-homocisteinu, homocistein u homocistein-homocisteinu) putem disulfidne veze. Budući da je kao ravnotežni postupak udio slobodnog homocistena promjenjiv, prava vrijednost ukupnog homocisteina (slobodni + vezani) korisna je za potvrđivanje dijagnoze, a posebno za praćenje učinkovitosti liječenja. U tu svrhu pametno je izvršiti analizu ukupni/e homocisten(e) u kojoj su sve disulfidne veze podvrgnute redukciji prije analize, obično putem HPLC –a, nakon derivatizacija fluorescentnim agensima, čime se daje pravi odraz količine homocisteina u uzorku plazme.[9]
Liječenje
urediNije otkriven specifičan lijek za homocistinuriju; međutim, mnogi ljudi liječe se visokim dozama vitamina B6 (poznat i kao piridoksin).[10] Nešto manje od 50% reagira na ovaj tretman i treba uzimati dodatni vitamin B6 do kraja života. Oni koji ne reagiraju trebaju dijetu s malo sumpora (posebno praćenje metionina), a većini će trebati liječenje s trimetilglicinom. Normalna doza dodatka folne kiseline i povremeno dodavanje cisteina u ishranu mogu biti od pomoći, jer se glutation sintetizira iz cisteina (tako da dodavanje cisteina može biti važno za smanjenje oksidativni stres).
Betain (N, N, N-trimetilglicin) koristi se za smanjenje koncentracija homocisteina, promoviranjem konverzije homocisteina natrag u metionin, tj. povećanjem protoka putem remetilacije, neovisno o derivatima folata (koji je uglavnom aktivan u jetri i bubrezima). Reformirani metionin se zatim postupno uklanja, ugradnjom u tjelesne proteine. Metionin koji se ne pretvori u protein pretvara se u S-adenozil-metionin, koji nastavlja da ponovo stvara homocistein. Betain je, prema tome, efikasan samo ako je količina metionina koju treba ukloniti mala. Zato tretman uključuje i betain i prehranu s malo metionina. U klasičnoj homocistinuriji (CBS ili nedostatak cistation beta-sintaze), nivo metionina u plazmi obično se povećava iznad normalnog raspona od 30 mikromola/L, a koncentracije treba nadzirati, kao potencijalno toksični nivoi (više od 400 mikromola/L) ne dostignu.
Preporučena dijeta
urediZa ovaj poremećaj preporučuje se hrana sa malo proteina, koja zahtijeva prehrambene proizvode s niskim sadržajem određenih aminokiselina (npr. metionina).[11]
Prognoza
urediOčekivani životni vijek pacijenata sa homocistinurijom smanjuje se samo ako se ne liječi. Poznato je da prije 30. godine života gotovo četvrtina pacijenata umire od trombotičkih komplikacija (npr. srčani udar.
Društvo i kultura
urediJedna teorija sugerira da je Ehnaton, faraon iz osamnaeste egipatske dinastije, možda bolovao od homocistinurije.[12]
Također pogledajte
urediReference
uredi- ^ a b OMIM: 236200
- ^ https://www.nhs.uk/conditions/homocystinuria/
- ^ a b Tao, Le (2. 1. 2020). First aid for the USMLE step 1 2020 : a student-to-student guide. Bhushan, Vikas,, Sochat, Matthew,, Kallianos, Kimberly,, Chavda, Yash,, Zureick, Andrew H. (Andrew Harrison), 1991-, Kalani, Mehboob. New York. ISBN 9781259837630. OCLC 948547794.
- ^ Maillot F, Kraus JP, Lee PJ (2008). "Environmental influences on familial discordance of phenotype in people with homocystinuria: a case report". J Med Case Rep. 2 (1): 113. doi:10.1186/1752-1947-2-113. PMC 2377250. PMID 18423051.
- ^ Peter Nicholas Robinson; Maurice Godfrey (2004). Marfan syndrome: a primer for clinicians and scientists. Springer. str. 5–. ISBN 978-0-306-48238-0. Pristupljeno 12. 4. 2010.
- ^ Goldman, Lee (2011). Goldman's Cecil Medicine (24th izd.). Philadelphia: Elsevier Saunders. str. 1362. ISBN 978-1437727883.
- ^ (eds.), N. Blau ... (2003). Physician's guide to the laboratory diagnosis of metabolic diseases; with 270 tables (2. izd.). Berlin [u.a.]: Springer. ISBN 978-3540425427.CS1 održavanje: dodatni tekst: authors list (link)
- ^ Refsum, Helga; A. David Smith; Per M. Ueland; Ebba Nexo; Robert Clarke; Joseph McPartlin; Carole Johnston; Frode Engbaek; Jørn Schneede; Catherine McPartlin; John M. Scott (2004). "Facts and Recommendations about Total Homocysteine Determinations: An Expert Opinion". Clinical Chemistry. 50 (1): 3–32. doi:10.1373/clinchem.2003.021634. PMID 14709635.
- ^ Carducci, Claudia; M. Birarelli; M. Nola; I. Antonozzi (1999). "Automated high-performance liquid chromatographic method for the determination of homocysteine in plasma samples". Journal of Chromatography A. 846 (1–2): 93–100. doi:10.1016/S0021-9673(98)01091-7. PMID 10420601.
- ^ Bakker, R. C.; Brandjes, D. P. (juni 1997). "Hyperhomocysteinaemia and associated disease". Pharmacy World & Science : PWS. 19 (3): 126–132. doi:10.1023/A:1008634632501. PMID 9259028.
- ^ YAP, SUFIN; NAUGHTEN, EILEEN R.; WILCKEN, BRIDGET; WILCKEN, DAVID E.L.; BOERS, GODFRIED H.J. (1. 1. 2000). "Vascular Complications of Severe Hyperhomocysteinemia in Patients with Homocystinuria Due to Cystathionine β-Synthase Deficiency: Effects of Homocysteine-Lowering Therapy". Seminars in Thrombosis and Hemostasis (jezik: engleski). 26 (3): 335–340. doi:10.1055/s-2000-8100. ISSN 0094-6176. PMID 11011851.
- ^ Cavka M, Kelava T (Mar 2010). "Homocystinuria, a possible solution of the Akhenaten's mystery". Coll Antropol. 34: 255–58. PMID 20402329.