Glikozidna veza
Glikozidna veza ili glikozidno vezanje je tip kovalentne veze koja spaja molekulu ugljikohidrata (šećera) s drugom grupom, koja može, ali ne mora biti drugi ugljikohidrat.
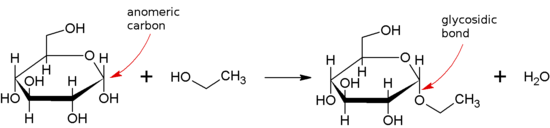
. Supstanca koja sadrži glikozidnu vezu je glikozid.
Termin 'glikozid' je sada proširen tako da pokrije i spojeve sa vezama formiranim između hemiacetatnih (ili hemiketonskih) grupa šećera i nekoliko hemijskih grupa osim hidroksila, kao što su –SR (tioglikozidi), –SeR (selenoglikozidi), –NR 1R2 (N-glikozidi) ili čak – CR1R2R3 (C-glikozidi).
Posebno u prirodnim glikozidima, spoj ROH iz kojeg je uklonjen ostatak ugljikohidrata često se naziva aglikonom, a sam ostatak ugljikohidrata ponekad se naziva 'glikon'.
S–, N–, C – i O-glikozidne veze
urediGlikozidne veze u formi o kojoj je gore raspravljano poznate su kao O-glikozidne veze, u odnosu na glikozidni kisik koji povezuje glikozid sa aglikonom ili redukcijskim završnim šećerom. Analogno, razmatraju se i S-glikozidne veze (koje formiraju tioglikozide), gdje je kisik glikozidne veze zamijenjen atomom sumpora. Na isti način, N-glikozidne veze, imaju glikozidnu vezu gdje je kisik zamijenjen sa dušikom. Supstance koje sadrže N-glikozidne veze poznate su i kao glikozilamini. C-glikozil veze imaju glikozidni kisik zamenjen sa ugljikom; prema IUPAC-u, termin "C-glikozid" je pogrešan i ne preporučuje se.[1] Sve ove modificirane glikozidne veze imaju različitu osjetljivost na hidrolizu, a u slučaju C-glikozilnih struktura, obično su otpornije na hidrolizu.
Numerisanje i α/β različitih glikozidnih veza
urediKada je anomerni centar uključen u glikozidnu vezu (kao što je uobičajeno u prirodi), onda se mogu razlikovati između α- i β-glikozidna veza, prema relativnoj stereohemijskim svojstvima anomernog položaja i najudaljenijem stereocentru C1 u saharidu.[2]
Farmakolozi često spajaju supstance sa glukuronskom kiselinom preko glikozidnih veza, kako bi povećali njihovu topivost u vodi; ovo je poznato kao glukuronidacija. Mnogi drugi glikozidi imaju važne fiziološke funkcije.
Hemijski pristupi
urediNüchter et al. (2001) pokazali su novi pristup Fischerovoj glikozidaciji.[3][4][5] Koristeći mikrovalnu pećnicu opremljenu aparatom za refluks u rotorskom reaktoru sa bombama pod pritiskom, Nüchter et al. (2001) uspjeli su postići 100% prinos α– i β-D-glukozida. Ovaj metod može se izvesti na vagi od više kilograma.
- Vishal Y Joshijeva metoda
Joshi et al. (2006.)[6] predlažu Koenigs-Knorrov metod u stereoselektivnoj sintezi alkil D-glukopiranozida putem glikozilacija, s izuzetkom upotrebe litij-karbonata koji je jeftiniji i toksičan od konvencijskog metoda upotrebe srebra ili živinih soli. D-glukoza je prvo zaštićena formiranjem peracetata dodatkom anhidrida sirćetne kiseline u acetatnoj kiselini, a zatim dodatkom bromovodika koji bromira na poziciji 5. Dodatkom alkohola ROH i litijum karbonata, OR zamjenjuje brom, a uklanjanjem zaštite acetiliranih hidroksila sintetizira se proizvod relativno visoke čistoće. Joshi et al. (2001) predložili su da litij djeluje kao nukleofil koji napada ugljik na poziciji 5 i kroz prelazno stanje alkohol zamjenjuje bromnu grupu. Prednosti ovog metoda kao i njegova stereoselektivnost i niska cijena litijeve soli uključuju to što se može raditi na sobnoj temperaturi i njen prinos je relativno dobar u poređenju sa konvenciskim Koenigs-Knorrovim metodom.[7]
Glikozidne hidrolaze
urediGlikozidne hidrolaze (ili glikozidaze) su enzimi koji razbijaju glikozidne veze. Glikozidne hidrolaze tipski mogu djelovati ili na α– ili na β-glikozidne veze, ali ne i na obje. Ova specifičnost omogućava istraživačima da dobiju glikozide u velikom epimernom višku; jedan primjer je Wen-Ya Lu-ova konverzija D-glukoze u etil β-D-glukopiranozid, koristeći glukozidazu prirodnog porijekla. Vrijedi napomenuti da je Wen-Ya Lu koristio glukozidazu na obrnut način, suprotno biološkoj funkcionalnosti enzima:[8]
Glikoziltransferaze
urediPrije nego što se monosaharidne jedinice ugrade u glikoproteine, polisaharide ili lipide u živim organizmima, one se obično prvo "aktiviraju", spajanjem glikozidne veze na fosfatnu grupu nukleotida kao što su uridin-difosfat (UDP), gvanozin-difosfat (GDP), timidin-difosfat (TDP) ili citidin-monofosfat (CMP). Ovi aktivirani biohemijski intermedijeri poznati su kao nukleotidi šećera ili donori šećera. Mnogi putevi biosinteze koriste mono– ili oligosaharide aktivirane difosfatnom vezom za lipide, kao što je dolikol. Ovi aktivirani donori su tada supstrati za enzime poznate kao glikoziltransferaze, koji prenose šećernu jedinicu od aktiviranog donora do prihvatajućeg nukleofila (akceptorskog supstrata).
Disaharidne fosforilaze
urediPosljednjih desetljeća razvijeni su različiti biokatalitski pristupi sintezi glikozida, koji korištenjem “glikoziltransferaza” i “glikozid hidrolaze” spadaju među najčešće katalize. Prvi često zahtijeva skupe materijale, a drugi često pokazuje niske prinose, De Winter et al.[10] Istraživali su upotrebu celobioza-fosforilaza (CP) za sintezu alfa-glikozida u ionskim tekućinama. Utvrđeno je da je najbolji uslov za upotrebu CP u prisustvu IL AMMOENG 101 i etil-acetata.
Usmjerene glikozilacije
urediPostoji više hemijskih pristupa kojima se podstiče selektivnost α– i β-glikozidnih veza. Priroda selektivnosti koja je vrlo specifična za supstrat i ukupna aktivnost piranozida može stvoriti velike sintetske poteškoće. Ukupna specifičnost glikozilacije može se poboljšati korištenjem pristupa koji uzimaju u obzir relativna prijelazna stanja kojima anomerni ugljik može proći tokom tipske glikozilacije. Najznačajnije, prepoznavanje i inkorporacija Felkin-Ahn-Eisensteinovog modela u logični hemijski dizajn može općenito pružiti pouzdane rezultate, pod uvjetom da transformacija može proći ovaj tip konformacijske kontrole u prijelaznom stanju.
Glikozilacije usmjerene fluorom predstavljaju ohrabrujuće sredstvo i za B-selektivnost i za uvođenje neprirodne biomimetičke C2 funkcionalnosti na ugljikohidrate. Jedan inovativan primjer dali su Bucher et al. pružajući način za korištenje fluoro-oksonijskih iona i trihloracetimidata za podsticanje B-stereoselektivnosti putem Gaucheovog efekta.[11] Ova razumna stereoselektivnost je jasna kroz vizualizaciju Felkin-Ahnovog modela mogućih oblika stolice.
Ovaj metod predstavlja ohrabrujući način za selektivnost inkorporiranja B-etil, izopropil i drugih glikozida sa tipskom hemijom trikloracetimidata.
O-vezani glikopeptidi i farmaceutska upotreba O-glikozilovanih peptida
urediNedavno se pokazalo da glikopeptidi vezani za O pokazuju odličnu permeabilnost i efikasnost CNS-a u višestrukim životinjskim modelima s bolesnim stanjima. Uz to, jedan od najintrigantnijih aspekata toga je sposobnost O-glikozilacije da produži poluživot, smanji klirens i poboljša PK/PD aktivnog peptida izvan povećanja penetracije u CNS. Urođena upotreba šećera kao solubilizirajućih dijelova u fazi II i III metabolizma (glukuronske kiseline) je uveliko omogućila evolucijsku prednost u tome što enzimi sisara nisu direktno evoluirani da razgrade O-glikozilirane proizvode na većim dijelovima.
Posebna priroda O-vezanih glikopeptida je da postoje brojni primjeri koji prodiru u CNS. Smatra se da temeljna osnova ovog efekta uključuje "preskakanje membrane" ili "difuziju hmelja". Smatra se da se proces "difuzije hmelja" vođen nebrownoviskim kretanjem javlja zbog diskontinuiteta plazmamembrana. "Hmeljna difuzija" posebno kombinuje slobodnu difuziju i međukomparmentne prelaze. Nedavni primjeri posebno uključuju visoku permeabilnost analoga met-enkefalina među ostalim peptidima. Pun mOR agonist pentapeptid DAMGO je također penetrant u CNS nakon uvođenja glikozilacije.[12][13][14]
N-glikozidne veze u DNK
urediMolekule DNK sadrže 5-člane ugljične prstenove zvane riboze koji su direktno vezani za dvije fosfatne grupe i nukleobazu koja sadrži amino grupe. Atomi dušika iz amino grupe u nukleotidima su kovalentno povezani sa anomernim ugljikom strukture šećera riboze preko N-glikozidne veze. Povremeno, nukleobaze vezane za ribozu prolaze kroz deaminaciju, alkilaciju ili oksidaciju, što rezultira citotoksičnim lezijama duž DNK kičme. Ove modifikacije ozbiljno ugrožavaju kohezivnost molekula DNK, što dovodi do razvoja bolesti kao što je rak. DNK glikozilaze su enzimi koji kataliziraju hidrolizu N-glikozidne veze, kako bi se oslobodila oštećena ili modificirana nukleobaza iz DNK, cijepanjem ugljik-dušik glikozidne veze na 2' ugljiku, nakon čega započinju put popravka bazne ekscizije (BER).
Monofunkcionalne glikozilaze kataliziraju hidrolizu N-glikozidne veze putem postupnog, SN1 mehanizma, ili usklađenog mehanizma sličnog SN2. U postupnoj funkciji, nukleobaza djeluje kao odlazeća grupa, prije nego što molekula vode napadne anomerni ugljik, stvarajući kratkotrajni nestabilan oksokarbenijski ionski intermedijer. Ovaj intermedijer brzo reaguje sa obližnjim molekulom vode da bi zamenio N-glikozidnu vezu riboze i nukleobazu O-glikozidnom vezom sa hidroksi grupom. Usklađujući mehanizam, voda djeluje kao nukleofil i napada anomerni ugljik prije nego što nukelobaza počne djelovati kao odlazeća grupa. Proizvedeni međuprodukt je sličan oksakarbenijskom ionu, gdje su i hidroksi grupe i nukleobaza još uvijek vezane za anomerni ugljik. Oba mehanizma teorijski daju isti proizvod. Većina ribonukleotida se hidrolizira preko usklađenog SN2 mehanizma, dok većina dezoksiribonukleotida prolazi kroz stepenasti mehanizam. Ove reakcije su praktično nepovratne. Zbog činjenice da cijepanje N-glikozidne veze iz DNK okosnice može dovesti do štetnih mutagenih i citotoksičnih odgovora u organizmu, imaju sposobnost da kataliziraju i sintezu N-glikozidnih veza putem abaznog DNK mjesta i specifične nukleobaze.[15]
Reference
uredi- ^ "Nomenclature of Carbohydrates (Recommendations 1996)". Department of Chemistry, Queen Mary University of London.
- ^ Bertozzi C, Rabuka D (2009). "Structural Basis of Glycan Diversity". Essentials of Glycobiology. NCBI (2nd izd.). National Center for Biotechnology Information, U.S. National Library of Medicine. ISBN 9780879697709.
- ^ Fischer, Emil (1893). "Ueber die Glucoside der Alkohole". Berichte der deutschen chemischen Gesellschaft. 26 (3): 2400–2412. doi:10.1002/cber.18930260327.
- ^ Fischer, Emil (1895). "Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen". Berichte der Deutschen Chemischen Gesellschaft (jezik: engleski). 28 (1): 1145–1167. doi:10.1002/cber.189502801248. ISSN 1099-0682.
- ^ Nüchter, Matthias; Ondruschka, Bernd; Lautenschläger, Werner (2001). "Microwave-Assisted Synthesis of Alkyl Glycosides". Synthetic Communications. 31 (9): 1277–1283. doi:10.1081/scc-100104035. ISSN 0039-7911. S2CID 93986043.
- ^ Vishal Y Joshi, Manohar R Sawant (2006). "A convenient stereoselective synthesis of β-D-glucopyranosides". Indian Journal of Chemistry. 45B: 461–465.
- ^ Koenigs W, Knorr E (1901). "Ueber einige Derivate des Traubenzuckers und der Galactose". Berichte der Deutschen Chemischen Gesellschaft. 34 (1): 957–981. doi:10.1002/cber.190103401162.
- ^ a b Lu WY, Lin GQ, Yu HL, Tong AM, Xu JH (2009-12-09). Whittall J, Sutton PW (ured.). Practical Methods for Biocatalysis and Biotransformations. John Wiley & Sons. str. 236–239. ISBN 978-0-470-74859-6.
- ^ Bucher C, Gilmour R (November 2010). "Fluorine-directed glycosylation". Angewandte Chemie International Edition. 49 (46): 8724–8. doi:10.1002/anie.201004467. PMID 20886497.
- ^ De Winter K, Van Renterghem L, Wuyts K, Pelantová H, Křen V, Soetaert W, Desmet T (2015). "Chemoenzymatic Synthesis of β-D Glucosides using Cellobiose Phosphorylase from Clostridium thermocellum". Advanced Synthesis & Catalysis. 357 (8): 1961–1969. doi:10.1002/adsc.201500077. ISSN 1615-4150.
- ^ Durantie, Estelle; Bucher, Christoph; Gilmour, Ryan (16 May 2012). "Fluorine-Directed β-Galactosylation: Chemical Glycosylation Development by Molecular Editing". Chemistry – A European Journal. 18 (26): 8208–8215. doi:10.1002/chem.201200468. Arhivirano s originala, 21. 9. 2022. Pristupljeno 24 April 2022.
- ^ Egleton RD, Mitchell SA, Huber JD, Janders J, Stropova D, Polt R, et al. (October 2000). "Improved bioavailability to the brain of glycosylated Met-enkephalin analogs". Brain Research. 881 (1): 37–46. doi:10.1016/S0006-8993(00)02794-3. PMID 11033091. S2CID 18102579.
- ^ Polt R, Dhanasekaran M, Keyari CM (September 2005). "Glycosylated neuropeptides: a new vista for neuropsychopharmacology?". Medicinal Research Reviews. 25 (5): 557–585. doi:10.1002/med.20039. PMID 16075406. S2CID 38798797.
- ^ Egleton, Richard D.; Bilsky, Edward J.; Tollin, Gordon; Dhanasekaran, Muthu; Lowery, John; Alves, Isabel; Davis, Peg; Porreca, Frank; Yamamura, Henry I. (2005-01-10). "Biousian glycopeptides penetrate the blood–brain barrier". Tetrahedron: Asymmetry. Carbohydrate Science. Part 1. 16 (1): 65–75. doi:10.1016/j.tetasy.2004.11.038.
- ^ Drohat AC, Maiti A (November 2014). "Mechanisms for enzymatic cleavage of the N-glycosidic bond in DNA". Organic & Biomolecular Chemistry. 12 (42): 8367–8378. doi:10.1039/c4ob01063a. PMC 4238931. PMID 25181003.
- Marco Brito-Arias, "Synthesis and Characterization of Glycosides", second edition, Editorial Springer 2016.
Vanjski linkovi
uredi- Definition of glycosides, from the IUPAC Compendium of Chemical Terminology, the "Gold Book"
- Varki A et al. Essentials of Glycobiology. Cold Spring Harbor Laboratory Press; 1999. Searchable online