Presenilin
Presenilini su porodica srodnih višeprolaznih transmembranskih proteina koji čine katalitske podjedinice gama-sekretaza proteinskog kompleksa intramembranskih proteaza. Prvi put ih je identificirao Peter St George-Hyslop u Centru za istraživanje neurodegenerativnih bolesti na Univerzitetu u Torontu, na skrininzima za mutacije koje uzrokuju rane oblike porodične Alzheimerove bolesti, a sada i na Univerzitetu u Cambridgeu.[1] Kičmenjaci imaju dva presenilinska gena, zvana PSEN1 (koji se nalaze na hromoomu 14 kod ljudi) koji kodiraju presenilin 1 (PS-1) i PSEN2 (na hromosomu 1 kod ljudi) koji kodira presenilin 2 (PS-2).[2] Oba gena pokazuju konzerviranost među vrstama, s malom razlikom između presenilina pacova i čovjeka. Crv nematoda C. elegans ima dva gena koji nalikuju presenilinima i izgleda da su funkcionalno slični, sel-12 i hmelj-1.[3]
| Presenilin | |
|---|---|
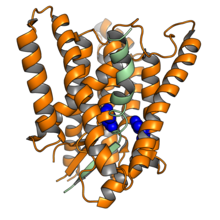 Krioelektronska mikroskopija strukture ljudskog presenilin-1 (narandžasta) u kompleksu sa fragmentom jednog od njegovih proteinskih supstrata, zarezni (zelena). Dva katalitska mjesta prikazana su plavom bojom. Prema 6IDF | |
| Identifikatori | |
| Simbol | Presenilin |
| Presenilin 1 (Alzheimerova bolest 3) | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | PSEN1 | ||||||
| Alt. simboli | AD3 | ||||||
| NCBI gen | 5663 | ||||||
| HGNC | 9508 | ||||||
| OMIM | 104311 | ||||||
| RefSeq | NM_000021 | ||||||
| UniProt | P49768 | ||||||
| Ostali podaci | |||||||
| EC broj | 3.4.23.- | ||||||
| Lokus | Hrom. 14 q24.3 | ||||||
| |||||||
| Presenilin 2 (Alzheimerova bolest 4) | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | PSEN2 | ||||||
| Alt. simboli | AD4 | ||||||
| NCBI gen | 5664 | ||||||
| HGNC | 9509 | ||||||
| OMIM | 600759 | ||||||
| RefSeq | NM_000447 | ||||||
| UniProt | P49810 | ||||||
| Ostali podaci | |||||||
| EC broj | 3.4.23.- | ||||||
| Lokus | Hrom. 1 q31-q42 | ||||||
| |||||||
Presenilini prolaze kroz cijepanje u alfa-heliksnoj regiji jedne od citoplazmatskih petlji kako bi nastali veliki N-terminalni i manji C-terminalni fragmenti, koji zajedno čine dio funkcionalnog proteina.[4] Cijepanje presenilina 1 može se spriječiti pomoću mutacije koja uzrokuje gubitak egzona 9 i rezultira gubitkom funkcije. Presenilini imaju ključnu ulogu u modulaciji unutarćelijskog Ca2+, uključenog u presinapsno oslobađanje neurotransmitera i indukciju dugotrajnog potenciranja.[5]
Struktura
urediPresenilini su transmembranski proteini s devet alfa-heliksa. Riješene su strukture sklopljenog kompleksa gama-sekretaza pomoću krioelektronske mikroskopije, pokazujući značajnu konformacijsku fleksibilnost u strukturi kompleksa presenilinske podjedinice, kao odgovor na vezivanje liganda ili inhibitora.[6][7] Presenilini se podvrgavaju autokatalitičkoj proteolitičkoj obradi nakon ekspresije, cijepajući područje citoplazmatske petlje između šeste i sedme zavojnice dajući veliki N-terminal i manji C-terminal fragment. Dva fragmenta ostaju u kontaktu jedni s drugima u zrelom proteinu. Dva katalitička aspartat aktivno mjesto ostatka potrebna za aktivnost aspartil proteaza nalaze se u šestoj i sedmoj zavojnici.
Struktura i topologija membrane presenilina prvotno je bila kontroverzna, kada su prvi put otkriveni. Predviđeno je da gen PSEN1 sadrži deset transmembranskih domena; modeli su se složili oko očekivane topologije N-terminalnog fragmenta, ali struktura C-terminala bila je sporna. Studija iz 2006. godine predložila je transmembransku topologiju s devet prolaza s cijepanjem i skupljanjem u gama-sekretazni kompleks prije insercije u plazmamembranu.[8] Studije NMR rastvora C-terminalnog fragmenta pokazale su tri spirale koje će vjerojatno proći kroz membranu,[4][9] dok kristalografske studije homologa arheja,[10] kao i krioelektronska mikroskopija kompleksa ljudske gama-sekretaze, ukazuju na devet transmembranskih spirala.[6][7]
Reference
uredi- ^ Sherrington R, Rogaev EI, Liang Y, Rogaeva EA, Levesque G, Ikeda M, et al. (juni 1995). "Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease". Nature. 375 (6534): 754–60. Bibcode:1995Natur.375..754S. doi:10.1038/375754a0. PMID 7596406. S2CID 4308372.
- ^ Levy-Lahad E, Wasco W, Poorkaj P, Romano DM, Oshima J, Pettingell WH, et al. (august 1995). "Candidate gene for the chromosome 1 familial Alzheimer's disease locus". Science. 269 (5226): 973–7. Bibcode:1995Sci...269..973L. doi:10.1126/science.7638622. PMID 7638622. S2CID 27296868.
- ^ Smialowska A, Baumeister R (2006). "Presenilin function in Caenorhabditis elegans". Neuro-Degenerative Diseases. 3 (4–5): 227–32. doi:10.1159/000095260. PMID 17047361. S2CID 9695127.
- ^ a b Sobhanifar S, Schneider B, Löhr F, Gottstein D, Ikeya T, Mlynarczyk K, et al. (maj 2010). "Structural investigation of the C-terminal catalytic fragment of presenilin 1". Proceedings of the National Academy of Sciences of the United States of America. 107 (21): 9644–9. Bibcode:2010PNAS..107.9644S. doi:10.1073/pnas.1000778107. PMC 2906861. PMID 20445084.
- ^ Zhang C, Wu B, Beglopoulos V, Wines-Samuelson M, Zhang D, Dragatsis I, et al. (juli 2009). "Presenilins are essential for regulating neurotransmitter release". Nature. 460 (7255): 632–6. Bibcode:2009Natur.460..632Z. doi:10.1038/nature08177. PMC 2744588. PMID 19641596.
- ^ a b Bai XC, Rajendra E, Yang G, Shi Y, Scheres SH (decembar 2015). "Sampling the conformational space of the catalytic subunit of human γ-secretase". eLife. 4: e11182. doi:10.7554/eLife.11182. PMC 4718806. PMID 26623517.
- ^ a b Yang G, Zhou R, Zhou Q, Guo X, Yan C, Ke M, et al. (januar 2019). "Structural basis of Notch recognition by human γ-secretase". Nature. 565 (7738): 192–197. doi:10.1038/s41586-018-0813-8. PMID 30598546. S2CID 57189683.
- ^ Spasic D, Tolia A, Dillen K, Baert V, De Strooper B, Vrijens S, Annaert W (septembar 2006). "Presenilin-1 maintains a nine-transmembrane topology throughout the secretory pathway". The Journal of Biological Chemistry. 281 (36): 26569–77. doi:10.1074/jbc.M600592200. PMID 16846981.
- ^ PDB 2KR6; Doetsch V (2010). "Solution structure of presenilin-1 CTF subunit". To be Published. doi:10.2210/pdb2kr6/pdb.
- ^ Li X, Dang S, Yan C, Gong X, Wang J, Shi Y (januar 2013). "Structure of a presenilin family intramembrane aspartate protease". Nature. 493 (7430): 56–61.
Vanjski linkovi
uredi- The MEROPS online database for peptidases and their inhibitors: Presenilin 1 A22.001 Arhivirano 15. 2. 2006. na Wayback Machine, Presenilin 2 A22.002[mrtav link]
- Dominantly Inherited Alzheimer Network (DIAN)
- Dominantly Inherited Alzheimer Network (DIAN) Expanded Registry
- Presenilins na US National Library of Medicine Medical Subject Headings (MeSH)