Katepsin C
Katepsin C (CTSC) – poznat i kao dipeptidil peptidaza I (DPP-I) – je lizosomna egzocistein proteaza koja pripada familiji C1 peptidaza.[5][6][7][8][9]
Funkcija
urediKatepsin C se javlja kao centralni koordinator aktivacije mnogih serin proteaza u imuno/upalnim ćelijama. Katepsin C katalizira eksciziju dipeptida iz N-kraja proteinske i peptidne podloge, osim ako (1) je blokirana amino grupa N-kraja, (2) mjesto cijepanja na obje strane prolinskog ostatka ili je (3) ostatak N-kraja lizin ili arginin ili (4) struktura peptida ili proteina sprečava dalje razlaganje iz N-kraja
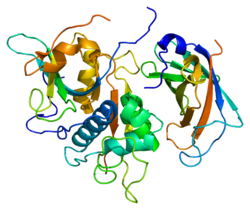
Struktura
urediU cDNK kodiranju pacova, čovjeka, miša, goveda, psa, klonirana su dva shistosoma (kategorirana) katepsina Cs, koji pokazuju da je enzim vrlo očuvan. Za ljudski i pacovski katepsin C, cDNK kodira prekursor (prepro-katepsin C) koji se sastoji od signalnih peptida od 24 ostatka, pro-regije 205 (pacovski katepsin C ) ili 206 (ljudski katepsin C) ostataka i katalitske domene od 233 ostatka koji sadrže katalitske ostatke, te da ima 30-40% identičnih sekvenci zrelih aminokiselina papaina i niz drugih katepsina, uključujući i katepsine B, H, K i L i S.[12]
Prevedeni prepro-katepsin C se obrađuje u zreli oblik u najmanje četiri podjele lanca polipeptida. Ovaj signalni peptid je uklonjen tokom translokacija ili lučenjem pro-enzima (pro-katepsina C) i velikog proregijskog fragmenta fragmenta N-kraja (poznat i kao domena isključenja), koji se zadržava u zrelom enzimu, odvojen od katalitiske domene ekscizijom (isijecanjem) nezrele pro-regija C-kraja, što se zove aktiviranje peptida. U rascjepu katalitske domene stvaraju se teški lanac od oko 164 ostatka i lahki, od oko 69 ostataka.
Za razliku od drugih članova papainske porodice, zreli katepsin C sastoji se od četiri podjedinice, od kojih je svaka sastavljen od N-kraja proregionskog fragmenta, teškoh i lahkog lanca. Pro-regije fragment i teškog lanca su glikozilirani. [13][14][15]
Također pogledajte
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000109861 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000030560 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Cornish-Bowden A. (2004): Fundamentals of enzyme kinetics, 3rd Ed. Portland Press. ISBN 9781855781580; ISBN 1855781581.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Graeme K. Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London, ISBN 0-12-361811-8.
- ^ Nelson D. L., Michael M. Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman, 2013.ISBN 978-1-4641-0962-1.
- ^ "Entrez Gene: CTSC cathepsin C".
- ^ Paris A., Strukelj B., Pungercar J., Renko M., Dolenc I., Turk V. (august 1995). "Molecular cloning and sequence analysis of human preprocathepsin C". FEBS Letters. 369 (2–3): 326–30. doi:10.1016/0014-5793(95)00777-7. PMID 7649281.CS1 održavanje: upotreba parametra authors (link)
- ^ Kominami E, Ishido K, Muno D, Sato N (juli 1992). "Primarna struktura i distribuciju tkiva katepsin C". Biological Chemistry Hoppe-Seyler. 373 (7): 367–73. doi:10.1515/bchm3.1992.373.2.367. PMID 1515062.CS1 održavanje: upotreba parametra authors (link).
- ^ Hola-Jamriska L, Tort JF, Dalton JP, Day SR, Fan J, Aaskov J, Brindley PJ (august 1998). "Cathepsin C from Schistosoma japonicum--cDNA encoding the preproenzyme and its phylogenetic relationships". European Journal of Biochemistry / FEBS. 255 (3): 527–34. doi:10.1046/j.1432-1327.1998.2550527.x. PMID 9738890.CS1 održavanje: upotreba parametra authors (link)
- ^ Kominami E, Ishido K, Muno D, Sato N (juli 1992). "The primary structure and tissue distribution of cathepsin C". Biological Chemistry Hoppe-Seyler. 373 (7): 367–73. doi:10.1515/bchm3.1992.373.2.367. PMID 1515062.CS1 održavanje: upotreba parametra authors (link)
- ^ Turk D, Janjić V, Stern I, Podobnik M, Lamba D, Dahl SW, Lauritzen C, Pedersen J, Turk V, Turk B (decembar 2001). "Structure of human dipeptidyl peptidase I (cathepsin C): exclusion domain added to an endopeptidase framework creates the machine for activation of granular serine proteases". The EMBO Journal. 20 (23): 6570–82. doi:10.1093/emboj/20.23.6570. PMC 125750. PMID 11726493.CS1 održavanje: upotreba parametra authors (link)