Hemijski element
Hemijski element je vrsta čiste hemijske supstance koja se ne može podijeliti na dvije ili više čiste supstance običnim hemijskim metodama.[1] Hemijski elementi se sastoje od samo jedne vrste atoma, koji se razlikuju po svom atomskom broju, tj. broju protona u atomskom jezgru. Elementi se dijele na metale, metaloide i nemetale. Najpoznatiji primjeri hemijskih elemenata su ugljik, dušik, kisik, silicij, arsen, aluminij, željezo, bakar, zlato, živa i olovo.
 | |
 | |
  | |
  | |
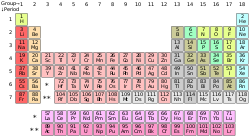
| gore: Periodni sistem hemijskih elemenata. ispod: primjeri određenih hemijskih elemenata. Sa lijeva na desno: vodik, barij, bakar, uranij, brom i helij. |
Najlakši hemijski elementi, među kojima su vodik, helij i manje količine litija, berilija i bora, nastali su različitim kosmičkim procesima tokom Velikog praska i djelovanjem kosmičkih zraka. Nastanak težih elemenata, počev od ugljika do najtežih elemenata, desio se putem nukleosinteze u zvijezdama, a pri nastanku Sunčevog sistema i formiranjem njegovog planetarnog sistema iz planetarnih maglina i supernova, koje su izbacivale ove elemente u svemir.[2]
Velika rasprostranjenost kisika, silicija i željeza za Zemlji odaje njihovo zajedničko porijeklo u takvim zvijezdama. Dok je većina elemenata uglavnom stabilno, postoji mali broj prirodnih nuklearnih transformacija iz jednog elementa u drugi, a koje se također dešavaju pri raspadu radioaktivnih elemenata kao i u drugim prirodnim nuklearnim procesima.
Danas je poznato 118 elemenata, od čega se 91 hemijski element može naći u prirodi, a ostali su proizvedeni u laboratoriji. U hemiji, svaki element ima svoj jedinstveni hemijski simbol. On se sastoji iz jednog ili dva slova, obično izvedena iz imena tog elementa. Naprimjer simbol za ugljik (karbon) je C, dok je simbol za aluminij Al. Ponekad su simboli izvedeni iz latinskih imena elemenata ili iz nekog njegovog spoja.
Dijeljenjem tvari (u idealnom slučaju) došli bi do atoma tog hemijskog elementa.
Historija
urediPojam hemijskog elementa nastao je od 17. vijeka, nakon što je sve više postajalo jasno, da pojam elementa iz alhemije nije pogodan za naučno objašnjenje raznovrsnosti osobina supstanci i njihovih reakcija.[3] Jedan značajan iskorak učinio je Etienne de Clave koji je 1641. dao definiciju elemenata kao najjednostavnijih supstanci od čijih su mješavina sastavljeni spojevi i čiji se spojevi mogu ponovno razložiti na te supstance. Robert Boyle je 1661. objavio rad pod naslovom The Sceptical Chymist vrlo utjecajnu kritiku mahana i nedostataka alhemije. Osim toga, dalje je naveo da se pod pojmom hemijskog elementa trebaju podrazumijevati primitivne supstance, koje nisu nastale iz drugih supstanci ili jedni iz drugih, već čine osnovne sastojke iz kojih se sastoje miješane supstance.
Oba naučnika su se tako postavili nasuprot tada vladajućeg učenja alhemičara o četiri elementa, po kojem su sve supstance zapravo nastale različitim miješanjem vatre, vode, zraka i zemlje, te su tako učinile pojam elementa općenito bližem eksperimentalnom naučnom istraživanju. Međutim i pored naprednog razmišljanja, i dalje su ostali "vjerni" alhemiji, jer su smatrali da takvi elementi u prirodi ne postoje, jer je istovremeno svaka realna supstanca istovremeno i mješavina određenih elemenata. Boyle je izražavao sumnju da takvih elemenata uopće ima. Potpuno u duhu tada važeće mehanike, on je zauzimao stav da supstance koje naoko izgledaju monolitno, zapravo se sastoje iz mnogo sićušnih istovrsnih dijelića (korpuskula) a koji se dalje opet mogu dijeliti na još sitnije. Također je objašnjavao raznovrsnost supstanci i njihovih reakcija preko bezbrojnih načina u kojima ovi sićušni djelići mogu spajati karakteristično različito za svaku supstancu. Kao rezultat takvog mišljenja, smatrao je mogućom takozvanu transmutaciju u alhemiji kojom bi se takvi djelići supstance mogli presložiti iz jednog elementa (npr. olova) u drugi (npr. zlato).
Ipak, Boyle je na taj način pripremio put za istraživanja Lavoisiera, koji je odbacio teoriju djelića (korpuskula) kao metafizičku špekulaciju, ali je već 1789. u svoju definiciju hemijskog elementa ugradio njihovu osobinu da se oni ne mogu razložiti u druge supstance. Preciznije, svi materijali bi trebali biti svrstani u elemente, osim ako ne postoji otkrivena metoda za daljnje odvajanje pojedinih komponenti.[4]
Na osnovu ove definicije, Lavoisier je započeo izuzetno precizna posmatranja hemijskih i fizičkih transformacija materijala u modernoj hemiji. Posebno se ističe njegovo otkriće zakona o očuvanju ukupne mase svih transformacija supstanci i utvrdio tačan maseni omjer u kojima čisti elementi reagiraju jedan s drugim. Tako je i John Dalton izveo i zakon o umnoženim proporcijama, te 1803. naučno mogao potvrditi postojanje nepromjenjivih i neuništivih najmanjih čestica materije, atoma. Prema Daltonu, element je definiran kao uniformni skup istovrsnih atoma koji se mogu spajati sa drugim atomima prema stalnim, nepromjenjivim pravilima. Različito ponašanje elemenata je objašnjavano činjenicom da se atomi razlikuju po svojoj masi, veličini i mogućnosti spajanja sa drugim atomima. Iz toga je proizašla mogućnost da se odrede atomske mase različitih elemenata (barem odnos jednih prema drugim), te su atomi po prvi put postali predmet proučavanja eksperimentalne nauke.
Otkrića elemenata
urediOd antičkih vremena pa sve do Srednjeg vijeka ljudi su živjeli u uvjerenju, da se svijet sastoji iz četiri elementa: zemlje, vode, zraka i vatre.
Od elemenata u današnjem smislu te riječi u antici je bilo poznato samo njih nekoliko u čistom obliku, koji su se dobijali istopljeni iz ruda ili su pronađeni samorodni: ugljik, sumpor, željezo, bakar, cink, srebro, kalaj, zlato, živa i olovo.
U toku srednjovjekovne historije rudarstva, naročito u njemačkom rudnom gorju Erzgebirge, pronađene su rude koje su sadržavale male primjese do tad nepoznatih metala a koji su dobili imena po duhovima iz rudnika: kobalt, nikl i volfram. Hennig Brand otkrio je 1669. fosfor čime je započelo doba otkrivanja većine elemenata, te zaključno sa 1789. godinom kada je Klaproth otkrio uranij u rudi uraninitu.
Od 1751. bili su poznati sljedeći prijelazni elementi: željezo, kobalt, nikl, bakar, cink, srebro, platina, zlato i živa, te elementi glavne grupe periodnog sistema ugljik, fosfor, sumpor, arsen, kalaj, antimon, olovo i bizmut.[5]
Nakon 1751. pa sve do 1800. pronađeni su i vodik, titanij, hrom, mangan, itrij, cirkonij, molibden, volfram, uranij, a kasnije i dušik, kisik, hlor i telur.[6]
U periodu od 1800. do 1830. otkrivena su ukupno 22 nova elemente i to iz sporedne grupe elemenata: vanadij, tantal, rodij, paladij, kadmij, osmij, iridij te metal iz grupe rijetkih zemalja torij, kao i elementi iz glavne grupe: litij, berilij, natrij, magnezij, kalij, kalcij, stroncij, barij, bor, aluminij, silicij, selen, jod i brom.[7]
Daljnih 11 elemenata otkriveno je u periodu između 1830. i 1869. godine. Oni su također bili i određena prekretnica u tehničko-naučnom stanju razvoja, kojom je postignuto otkriće i opis nekih vrlo rijetkih elemenata kojih je do tada bilo vrlo teško ili gotovo nemoguće naći. Bili su to helij, rubidij, cezij, indij, talij, niobij, rutenij, kao i lantan, cerij, terbij i erbij.[8]
Prvi transuranijski element (tj. element sa atomskim brojem većim od 92) koji je otkriven 1940. godine bio je neptunij. Počev od 1999. sva otkrića novih elemenata razmatra posebna zajednička komisija u sklopu IUPACa i IUPAPa. Do juna 2017. za svih 118 elemenata je potvrđeno otkriće od strane IUPACa. Naprimjer, otkriće elementa 112 je objavljeno 2009. te mu je predloženo ime kopernicij i hemijski simbol Cn.[9] Ime i simbol IUPAC je zvanično prihvatio 19. februara 2010. godine.[10] Do danas smatra se da je najteži element koji je uspješno sintetiziran element 118, oganeson, 9. oktobra 2006. u Dubni, Rusija gdje su ga sintetizirali naučnici u Flerovljevoj laboratoriji za nuklearne reakcije.[11][12] Tenesin, element 117, je do danas posljednji otkriveni element čije je otkriće objavljeno 2009. godine.[13] Dana 28. novembra 2016. naučnici pri IUPACu su zvanično objavili imena četiri najnovija hemijska elementa sa atomskim brojevima 113, 115, 117 i 118.[14][15]
Porijeklo i nastanak
urediSamo oko 4% ukupne mase svemira sačinjavaju atomi ili ioni, a koje predstavljaju pojedini hemijski elementi. Ova masa čini oko 15% ukupne mase cjelokupne materije, dok ostatak materije (85%) čini takozvana tamna materija. Priroda tamne materije nije poznata, međutim ona nije sastavljena iz atoma hemijskih elemenata jer ne sadrži protone, neutrone niti elektrone. Preostali dio nematerijalne mase svemira sastavljen je iz, još misterioznije, tamne energije.
Za prirodna 94 hemijska elementa koji se nalaze u svemiru smatra se da su nastali putem najmanje četiri kosmička procesa. Najveći dio vodika i helija u svemiru nastao je u prvih nekoliko minuta nakon Velikog praska. Putem tri druga procesa, koji su se počeli odvijati kasnije, nastali su ostali elementi. Zvjezdana nukleosinteza kao proces koji se stalno odvija, proizveo je sve elemente od ugljika do željeza prema rastućem atomskom broju, ali vrlo malo litija, berilija i bora. Elementi teži od željeza po atomskom broju, kao što su teški uranij i plutonij, nastali su putem eksplozivne nukleosinteze u supernovama i drugim katastrofalnim kosmičkim događajima. Raspadanje djelovanjem kosmičkih zraka (fragmentacija) ugljika, dušika i kisika je važna za nastanak litija, berilija i bora.
Tokom rane faze Velikog praska, pri nukleosintezi jezgara vodika došlo je do nastanka izotopa vodika protija (1H), te helija-4 (4He), kao i manjih količina deuterija (2H) i vrlo malih količina litija i berilija (reda veličine 10−10). U Velikom prasku nastale su veoma male količine bora, jer je on uočen kod nekih vrlo starih zvijezda, a u njima nije bilo ugljika.[16] Naučnici se uglavnom slažu u pretpostavci da tokom Velikog praska nisu nastali elementi po atomskom broju teži od bora. Rezultat toga je da se primodijalni sastav atoma ili iona sastoji iz oko 75% 1H, 25% 4He i 0,01% deuterija, uz tragove litija, berilija i možda bora.[17] Naknadno obogaćivanje galaktičkog sferoida desilo se usljed zvjezdane nukleosinteze i nukleosinteze tokom supernovi.[18] Međutim, zastupljenost elemenata u međugalaktičkom prostoru i dalje je vrlo slična primordijalnim uslovima, osim ako nije obogaćena nekim drugim procesima.
Na Zemlji, između ostalog, i danas nastaju određeni elementi u vrlo malim količinama kao proizvod procesa nuklearne transmutacije drugih elemenata. To uključuje neke elemente koji nastaju djelovanjem kosmičkih zraka ili drugih nuklearnih reakcija, dok neki elementi nastaju kao proizvod radioaktivnog raspada dugoživućih primordijalnih nuklida.[19] Naprimjer, vrlo male količine ugljika-14 (14C), kontinuirano nastaju u atmosferi u procesu u kojem kosmički zraci padaju na atome dušika, ili primjer kada kontinuirano nastaje argon-40 (40Ar) procesom raspada primordijalnog ali nestabilnog kalija-40 (40K). Također, tri primordijalna ali radioaktivna aktinoida: torij, uranij i plutonij raspadaju se u nizu raspada kojim stalno nastaju nestabilni radioaktivni elementi poput radija i radona, a koji su uvijek prisutni u bilo kojem uzorku ovih metala, njihovih ruda ili spojeva. Druga tri radioaktivna elementa: tehnecij, prometij i neptunij javljaju se samo sporadično u prirodnim materijalima, a nastaju kao zasebni atomi putem nuklearne fisije atomskih jezgara raznih težih elemenata ili u nekim drugim rijetkim nuklearnim procesima.
Ljudskom tehnologijom nastali su raznih drugi vještački elementi koji su po atomskom broju teži od prvih 94, a među kojim je do danas najteži element sa atomskim brojem 118.
Rasprostranjenost
urediNa donjem prikazu (na logaritamskoj skali) prikazana je rasprostranjenost elemenata u Sunčevom sistemu. Tabela pokazuje dvanaest najčešćih elemenata u našoj galaksiji (procijenjeno na osnovu spektroskopije), tako što su mjerene mase elemenata u miliontim dijelovima.[20] Susjedne galaksije koje su se razvijale na sličan način kao i Mliječni put imaju odgovarajuće obogaćenje elemenata težih od vodika i helija. Međutim, udaljenije galaksije koje zbog velike udaljenosti posmatramo onako kako su izgledale u prošlosti, tako i njihov sastav elemenata izgleda dosta sličnije kako je izgledala i primordijalna smjesa. Kako se fizički zakoni i procesi ponavljaju širom vidljivog svemira, naučnici smatraju da su sve galaksije razvile elemente u sličnim omjerima i količinama.
| Elementi u našoj galaksiji |
Udio u milion atoma po masi |
|---|---|
| Vodik | 739.000 |
| Helij | 240.000 |
| Kisik | 10.400 |
| Ugljik | 4.600 |
| Neon | 1.340 |
| Željezo | 1.090 |
| Dušik | 960 |
| Silicij | 650 |
| Magnezij | 580 |
| Sumpor | 440 |
| Kalij | 210 |
| Nikl | 100 |
Rasprostranjenost elemenata u Sunčevom sistemu u skladu je sa njegovim porijeklom od nukleosinteze tokom Velikog praska i brojnih zvijezdi koje su postale supernove. Vrlo rasprostranjeni su helij i vodik kao proizvodi Velikog praska, ali su sljedeća tri elementa rijetka jer su imala vrlo malo vremena da se kreiraju tokom Velikog praska a ne nastaju ni u zvijezdama (međutim nastaju u malim količinama tokom raspada težih elemenata u međuzvjezdanoj prašini kao rezultat djelovanja kosmičkih zraka). Počev od ugljika, ostali elementi nastaju u zvijezdama tako što se spajaju iz alfa čestica (jezgara helija), što rezultira neznatno većim udjelom onih elemenata koji imaju parne atomske brojeve (a koji su ujedno i stabilniji). Općenito, svi elementi zaključno sa željezom kreirani su u velikim zvijezdama koje postepeno postaju supernove. Izotop željeza-56 je naročito čest, jer je to najstabilniji element koji vrlo lahko nastaje iz alfa čestica (a proizvod je raspada radioaktivnog nikla-56, a konačno nastaje iz 14 jezgara helija). Elementi koji su po atomskom broju teži od željeza nastali su u procesima koji zahtijevaju apsorbiranje energije u zvijezdi, pa njihova rasprostranjenost u svemiru (i na Zemlji) općenito opada rastom njihovog atomskog broja.
Rasprostranjenost hemijskih elemenata na Zemlji varira od zraka preko Zemljine kore do okeana, te u različitim oblicima života. Udio elemenata u Zemljinoj kori razlikuje se od onog u Sunčevom sistemu (kako je izmjereno na Suncu i težim planetama kao što je Jupiter) uglavnom u selektivnom gubitku najlakših elemenata (vodika i helija), a također i lahko pokretnih neona, ugljika (u vidu ugljikovodika), dušika i sumpora, kao rezultata sunčevog zagrijavanja u doba formiranja Sunčevog sistema. Kisik, kao najčešći element na Zemlji po masi, ostao je na Zemlji u kombinaciji sa silicijem. Aluminij sa 8% udjela po masi je dosta češći u Zemljinoj kori nego u svemiru i Sunčevom sistemu, ali je sastav daleko čvršćeg omotača Zemljinog jezgra sastavljenog od magnezija i željeza koje zamjenjuje aluminij (a kojeg tamo ima samo 2% po masi) mnogo bliže oslikava elementarni sastav Sunčevog sistema, s razlikom od spomenutog gubitka lahkih elemenata izgubljenih u svemiru, te gubitka željeza koje je potonulo dublje prema Zemljinom jezgru.
Za razliku od ovog, sastav ljudskog organizma, pobliže slijedi sastav morske vode, s razlikom da ljudsko tijelo ima dodatne količine ugljika i dušika potrebne za izgradnju bjelančevina i nukleinskih kiselina, zajedno s fosforom u DNK i RNK te ATP, molekulom za prijenos energije u tijelu (adenozin-trifosfat) prisutnom u ćelijama svih živih organizama.
Za određene vrste organizama neophodni su određeni dodatni elementi, naprimjer magnezij za hlorofil u zelenim biljkama, kalcij u školjkama te željezo za hemoglobin u crvenim krvnim ćelijama kod kičmenjaka.
Također pogledajte
urediReference
uredi- ^ William L. Masterton, Cecile N. Hurley, Edward J. Neth (2012): Chemistry: Principles and Reactions, 7. izd., Brooks/Cole, Cengage Learning, str. 2, ISBN 978-1-111-42710-8
- ^ E. M. Burbidge, G. R. Burbidge, W. A. Fowler, F. Hoyle (1957). "Synthesis of the Elements in Stars". Reviews of ModernPhysics. 29 (4): 547–650.CS1 održavanje: više imena: authors list (link) doi:10.1103/RevModPhys.29.547
- ^ Marie Boas: Robert Boyle and the seventeenth century chemistry. Cambridge University Press, Cambridge 1958. ISBN 978-0527092504
- ^ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1992.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim prije 1751.[mrtav link]
- ^ "Grafički prikaz periodnog sistema sa elementima poznatim do 1800". Arhivirano s originala, 1. 2. 2012. Pristupljeno 7. 4. 2015.
- ^ "Grafički prikaz periodnog sistema sa elementima poznatim do 1830". Arhivirano s originala, 7. 9. 2017. Pristupljeno 7. 4. 2015.
- ^ "Grafički prikaz periodnog sistema sa elementima poznatim do 1869". Arhivirano s originala, 7. 9. 2017. Pristupljeno 7. 4. 2015.
- ^ "IUPAC Announces Start of the Name Approval Process for the Element of Atomic Number 112" (PDF). IUPAC. 20. 7. 2009. Pristupljeno 27. 8. 2009.
- ^ "IUPAC (International Union of Pure and Applied Chemistry): Element 112 is Named Copernicium". IUPAC. 20. 2. 2010. Arhivirano s originala, 24. 2. 2010.
- ^ Schewe P.; Stein B. (17. 10. 2000). "Elements 116 and 118 Are Discovered". Physics News Update. American Institute of Physics. Arhivirano s originala, 1. 1. 2012. Pristupljeno 19. 10. 2006.CS1 održavanje: više imena: authors list (link)
- ^ Oganessian Yu. Ts.; Utyonkov V.; Lobanov Yu.; Abdullin F. (2006). "Evidence for Dark Matter" (PDF). Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Arhivirano s originala (PDF), 13. 2. 2021. Pristupljeno 14. 6. 2017.CS1 održavanje: više imena: authors list (link)
- ^ Greiner W. "Recommendations" (PDF). 31st meeting, PAC for Nuclear Physics. Joint Institute for Nuclear Research. Arhivirano s originala (PDF), 14. 4. 2010.
- ^ urednici (30. 11. 2016). "IUPAC Announces the Names of the Elements 113, 115, 117, and 118". IUPAC. Pristupljeno 1. 12. 2016.
- ^ St. Fleur Nicholas (1. 12. 2016). "Four New Names Officially Added to the Periodic Table of Elements". New York Times. Pristupljeno 1. 12. 2016.
- ^ Wilford J. N. (14. 1. 1992). "Hubble Observations Bring Some Surprises". New York Times.
- ^ Wright E. L. (12. 9. 2004). "Big Bang Nucleosynthesis". UCLA, Division of Astronomy. Pristupljeno 22. 2. 2007.
- ^ Wallerstein George; Iben Icko; Parker Peter; Boesgaard Ann (1999). "Synthesis of the elements in stars: forty years of progress" (PDF). Reviews of Modern Physics. 69 (4): 995–1084. Bibcode:1997RvMP...69..995W. doi:10.1103/RevModPhys.69.995. Arhivirano s originala (PDF), 28. 9. 2006.CS1 održavanje: više imena: authors list (link)
- ^ Earnshaw A.; Greenwood N. (1997). Chemistry of the Elements (2. izd.). Butterworth-Heinemann.CS1 održavanje: više imena: authors list (link)
- ^ Croswell K. (1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5.
Vanjski linkovi
uredi- Hemijski element na Wikimedia Commonsu