Cistična fibroza
Cistična fibroza jest genetički poremećaj koji najviše pogađa pluća, ali i gušteraču, jetru, bubrege i crijeva.[1][2] Dugoročni problemi uključuju otežano disanje i iskašljavanje sluzi, kao posljedica čestih infekcija pluća.[1] Ostali znakovi i simptomi mogu uključivati infekcije sinusa, slab rast, masnu stolicu, klabiranje prstiju na rukama i nogama i neplodnost kod većine muškaraca.[1] Mogu imati različite stepene simptoma.[1]
| Cistična fibroza (Mukoviscidoza) 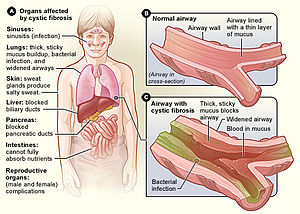 | |
|---|---|
| Klasifikacija i vanjski resursi | |
| ICD-10 | E84 |
| ICD-9 | 277.0 |
| OMIM | 219700 |
| DiseasesDB | 3347 |
| MedlinePlus | 000107 |
| eMedicine | article/1001602 |
| MeSH | D003550 |
| GeneReviews | CFTR-Related Disorders |
CF se nasljeđuje na autosomno recesivno svojstvo.[1] Uzrokovana je prisustvom mutacija u obje kopije gena za regulaciju proteinske transmembranske provodljivosti cistične fibroze (CFTR).[1] Oni koji imaju jednu aktivnu kopiju nositelji su i inače uglavnom zdravi.[3] Gen CFTR je uključen u proizvodnju znoja, probavne tečnosti i sluzi.[4] Kada CFTR nije funkcionalan, izlučevine koje su obično rijetke postaju guste.[5] Stanje se dijagnosticira pomoću testiranja znoja i genetičkog testiranja.[1] U nekim dijelovima svijeta, obavlja se skrining dojenčadi pri rođenju.[1]
Ne postoji poznati lijek za cističnu fibrozu.[3] Infekcije pluća liječe se antibioticima, koji se mogu davati intravenozno, udisati ili oralno.[1] Ponekad se dugoročno koristi antibiotik azitromicin.[1] Udisanje fiziološkog rastvora i salbutamol također može biti korisno.[1] Transplantacija pluća može biti opcija ako se funkcija pluća i dalje pogoršava.[1] Zamjena enzima pankreasa i vitamini topivi u mastima su važni, posebno kod mladih.[1] Tehnika uklanjanja sluzi, kao što je fizioterapija grudnog koša imaju neke kratkoročne koristi, ali dugoročni učinci su nejasni.[6] Prosječni životni vijek u razvijenim zemljama je između 42 i 50 godina.[7][8] 80% smrtnih slučajeva od cistične fibroze uzrokovano je plućnim komplikacijama.[1]
CF je najčešća među ljudima sjevernoevropskog porijekla i pogađa oko jedno od svakih 3.000 novorođenčadi.[1] Otprilike jedna od 25 osoba je nositelj.[3] Najmanje je uobičajena kod Afrikanaca i Azijata.[1] Bolest je 1938. godine otkrila Dorothy Andersen, sa simptomima koji su se poklapali s bolešću od 1595., ako ne i ranije.[2] Naziv "cistična fibroza" odnosi se na karakteristike fibroza i cista koje nastaju u pankreasu.[2][9]
Znaci i simptomi
urediGlavni znaci i simptomi su koža slanog okusa[10] slab rast i loše debljanje, uprkos normalnom unosu hrane,[11] nakupljanje guste, ljepljive sluzi,[12] česte infekcije grudnog koša i kašalj ili otežano disanje.[13] Muškarci mogu biti neplodni zbog urođebnog nesostatka vaas deferens.[14] Simptomi se često javljaju u beba i u djetinjstvu, kao što je opstrukcija crijeva zbog meconium ileus u novorođene djece.[15]
Kako djeca rastu, vježbaju kako bi oslobodili sluzi u alveolama.[16] Epitelne ćelije kod osoba koje imaju mutirani protein koji dovodi do abnormalno viskozne proizvodnje sluzi.[12] Loš rast kod djece obično predstavlja nemogućnost dobijanja na težini ili visini stope svojih vršnjaka i povremeno se ne dijagnosticira dok se ne pokrene istraga zbog slabog rasta. Uzroci zatajenja rasta su višestruki i uključuju hroničnu infekciju pluća, slabu apsorpciju hranjivih sastojaka kroz gastrointestinalni trakt i povećanu metaboličku potražnju zbog hroničnih bolesti.[11] U rijetkim slučajevima cistična fibroza može se manifestirati kao poremećaj koagulacije. Vitamin K se normalno apsorbuje iz majčinog mlijeka, adaptiranog mleka i kasnije čvrste hrane. Ova apsorpcija oslabljena je kod nekih pacijenata sa CF. Mala djeca posebno su osjetljiva na poremećaje malapsorpcije vitamina K, jer samo vrlo mala količina vitamina K prolazi kroz placentu, što djetetu ostavlja vrlo male rezerve i ograničenu sposobnost apsorpcije vitamina K iz prehrambenih izvora nakon rođenja. Budući da su faktori zgrušavanja II, VII, IX i X ovisni o vitaminu K, nizak nivo vitamina K može rezultirati problemima zgrušavanja. Slijedom toga, kada dijete ima neobjašnjive modrice, može se opravdati procjena zgrušavanja kako bi se utvrdilo je li prisutna osnovna.[17]
Uzroci
urediCF je uzrokovana mutacijom u genu regulacije transmembranske provodljivosti cistične fibroze (CFTR). Najčešća mutacija, ΔF508, jest delecija (Δ koja označava deleciju) tri nukleotida što rezultira gubitkom aminokiseline fenilalanin (F) na 508. poziciji na proteinu.[18][19] Ova mutacija čini dvije trećine (66–70%) slučajeva CF u cijelom svijetu i 90% slučajeva u Sjedinjenim Državama; međutim, čak preko 1.500 drugih mutacija može proizvesti CF.[20] Iako većina ljudi ima dvije aktivne kopije ('alela') gena CFTR , samo jedna je potrebna za prevenciju cistične fibroze. CF se razvija kada ni jedan alel ne može proizvesti funkcionalni protein CFTR. Dakle, CF se smatra autosomno recesivnom bolešču.
Gen CFTR , pronađen na lokusu q31.2 hromozoma 7, dugačak je 230.000 baznih parova i stvara protein koji je dug 1.480 aminokiselina. Preciznije, lokacija je između baznih parova 117,120,016 i 117,308.718, na dugom kraku hromosoma 7, regija 3, traka 1, potpojas 2, predstavljena kao 7q31.2. Strukturno, CFT je tip gena poznat kao ABC gen. Proizvod ovog gena (CFTR protein) je hloridni ionski kanal, važan u stvaranju znoja, probavnih sokova i sluzi. Ovaj protein posjeduje dva ATP-hidrolizna domena, što omogućava proteinu da koristi energiju u obliku ATP-a. Sadrži i dva domena koji se sastoje od po šest alfa-heliksa, koji omogućavaju proteinu da pređe ćelijsku membranu. Regulatorno mjesto vezanja na proteinu omogućava aktiviranje fosforilacijom, uglavnom cAMP-ovisne protein-kinaze. Karboksil terminal proteina je usidren na citoskelet, interakcijom domena PDZ.[21] Većinu CFTR u plućnim prolazima proizvode rijetke ćelije koje transportuju ione i reguliraju svojstva sluzi.[22]
Pored toga, povećavaju se dokazi da, osim CFTR, i genetički modifikatori moduliraju učestalost i težinu bolesti. Jedan od primjera je lektin koji veže manan, uključen u urođenu imunost, olakšavanjem fagocitoze mikroorganizama. Polimorfizmi u jednom ili oba alela koja vežu manan i koji rezultiraju nižim nivoima cirkulacije proteina povezani su s trostruko većim rizikom od završne faze pluća, kao i povećanim teretom hroničnih bakterijske infekcije.
Nosioci gena
urediDo 1/25 osoba sjevernoevropskih porijekla smatra se genetičkim nositeljem. Bolest se pojavljuje samo kada bračni parovu od njih imaju djecu, jer svaka trudnoća između njih ima 25% šanse da rodi dijete s tom bolešću. Iako samo jedno od svakih 3.000 kavkazoidne novorođenčadi ima CF, poznato je više od 900 mutacija gena koji uzrokuje CF. Dosadašnji testovi traže najčešće mutacije.[23]
Mutacije potvrđene testom razlikuju se u zavisnosti od etničke grupe osobe ili zbog pojave CF koja je već u porodici. Više od 10 miliona Amerikanaca, uključujući 1/25 kavkazosidnih, nositelji su jedne mutacije gena CF. CF je prisutan u drugim rasama, iako ne tako često kao kod ovakvih osoba. Otprilike 1/46 Latinoamerikanaca, 1/65 Afroamerikanaca i 1/90 Amerikanaca Azije nosi mutaciju gena CF.
Patofiziologija
urediKada CFTR protein djeluje ispravno, ioni slobodno ulaze i izlaze iz ćelija. Međutim, kada CFTR protein ne radi pravilno, ovi ioni ne mogu isticati iz ćelije zbog blokiranog kanala. To uzrokuje cističnu fibrozu, koju karakterizira nakupljanje guste sluzi u plućima.
Može se dogoditi nekoliko mutacija u genu CFTR, a različite mutacije uzrokuju različite nedostatke u CFTR proteinu, ponekad uzrokujući blažu ili težu bolest. Ovi proteinski nedostaci također su meta za lijekove koji ponekad mogu vratiti njihovu funkciju. ΔF508-CFTR, koji se javlja kod >90% pacijenata u SAD-u, stvara protein koji se presavijaju normalno i nisu na odgovarajući način transportirani do ćelijske membrane, što rezultira njihovim degradacijama.
Druge mutacije rezultiraju prekratkim proteinima (skraćenim) jer proizvodnja prerano završava. Druge mutacije proizvode proteine koji normalno ne koriste energiju (u obliku ATP), ne dopuštaju hloridu, jodidu i tiocijanatu da odgovarajuće prođu membranu,[24] i razgrađuju se većom brzinom od uobičajene. Mutacije mogu dovesti i do stvaranja manje kopija CFTR proteina.[25]
Protein stvoren ovim genom usidren je na vanjskoj membrani ćelija u znojnim žlijezdama, plućima, pankreasu i svim ostalim preostalim egzokrinim žlijezdama u tijelu.
Protein se proteže kroz ovu membranu i deluje kao kanal koji povezuje unutrašnji dio ćelije (citoplazma sa okolnom tečnosti). Ovaj kanal primarno je odgovoran za kontrolu kretanja halogenidnih aniona, iznutra prema vani ćelije; međutim, u znojnim kanalima olakšava kretanje hlorida iz znojnog kanala u citoplazmu. Kada CFTR protein ne resorbuje ione u znojnim kanalima, hlorid i tiocijanat[26] oslobođeni iz znojnih žlijezda zadržavaju se unutar kanala i ispumpavaju do kože.
Pored toga, ne može se proizvesti hipotiocijanit, OSCN, sistem imunske odbrane.[27][28] Budući da je hlorid negativno nabijen, to modificira električni potencijal unutar i izvan ćelije, zbog čega kationi prelazu u ćeliju. Natrij je najčešći kation u vanćelijskom prostoru. Višak hlorida u znojnim kanalima sprečava resorpciju natrija epitelnim natrijevim kanalima, a kombinacija natrija i k+hlorida stvara so, koja se u velikim količinama gubi u znoju osoba sa CF. Ova izgubljena so čini osnovu za test znoja.[25]
Većina oštećenja kod CF nastaje zbog začepljenja uskih prolaza zahvaćenih organa zgusnutim sekretom. Te blokade dovode do remodeliranja i infekcije u plućima, oštećenja nakupljenim probavnih enzimima u gušterači, začepljenja crijeva gustim izmetom itd. Postavljeno je nekoliko teorija o tome kako defekti u proteinima i ćelijskoj funkciji uzrokuju kliničke efekte. Najsuvremenija teorija sugerira da neispravan transport iona dovodi do dehidracije epitela dišnih puteva, zgušnjavanja sluzi. U epitelnim ćelijama disajnih puteva, treplje postoje između apikalne površine ćelije i sluzi u sloju poznatom kao površinska tečnost disajnih puteva (ASL). Protok iona iz ćelije i u ovaj sloj određen je ionskim kanalima, kao što je CFTR. CFTR ne samo da dopušta iznošenje hloridnih iona iz ćelije u ASL, već regulira i drugi kanal zvani ENac, koji omogućava natrijevim ionima da napuste ASL i uđu u respiratorni epitel. CFTR normalno inhibira ovaj kanal, ali ako je CFTR neispravan, natrij slobodno teče iz ASL-a i dolazi u ćeliju.
Kako voda prati natrij, dubina ASL će se iscrpljivati, a treplje će ostati u sluzničkom sloju.[29] Kako se treplje ne mogu efikasno kretati u gustom, viskoznom okruženju, nedostaje mukocilijskii klirens i dolazi do nakupljanja sluzi, što začepljuje male dišne puteve.[30] Nakupljanje viskozne sluzi bogate hranjivim sastojcima, u plućima omogućava bakterijama da se sakriju od imunskog sistema, što uzrokuje ponovljene respiratorne infekcije. Prisustvo istih CFTR proteina u kanalu gušterače i znojnim žlijezdama na koži također uzrokuju simptome u ovim sistemima.
Diagnoza
urediCistična fibroza može se dijagnosticirati različitim metodima, uključujući skrining novorođenčadi, testiranje znoja i genetičko testiranje.[31] Od 2006. godine u Sjedinjenim Državama, 10% slučajeva dijagnosticira se ubrzo nakon rođenja, kao dio programa skrininga novorođenčadi. Za novorođenče, u početku mjeri se povišena koncentracija imunoreaktivnog tripsinogena u krvi.[32] Da bi potvrdila dijagnoza CF, za dojenčad s abnormalnim skriningom za novorođenčad, potreban je test znoja,
U mnogim slučajevima, roditelj postavlja dijagnozu jer je dojenče slanog okusa.< Imunoreaktivni nivoi tripsina mogu se povećati kod osoba koje imaju jednu mutiranu kopiju gena CFTR (nositelji) ili rijetki slučajevi, kod osoba sa dvije normalne kopije gena CFTR . Zbog ovih lažno pozitivnih slučajeva, skrining kod novorođenčadi može biti kontroverzan.[33][34]
Osobe s CF mogu biti uvedene u registar bolesti, koji omogućava istraživačima i ljekarima da prate zdravstvene rezultate i identificiraju kandidate za klinička ispitivanja.[35]
Upravljanje
urediIako nisu poznati lijekovi za CF, koristi se nekoliko metoda liječenja. Upravljanje CF značajno se poboljšalo tokom proteklih 70 godina. Dok bi novorođenčad rođena s njim prije 70 godina bilo malo vjerojatno da će živjeti dalje od svoje prve godine, dojenčad će danas vjerojatno živjeti i do odrasle dobi. Nedavni napredak u liječenju cistične fibroze značio je da takve osobe sa mogu živjeti punijim životom manje opterećeni svojim stanjem. Temelji upravljanja su proaktivni tretman infekcija dišnih puteva i podsticanje dobre prehrane i aktivnog načina života. Plućna rehabilitacija kao upravljanje CF-om nastavlja se tokom čovjekova života i usmjerena je na maksimiziranje funkcije organa, a time i na kvalitet života. Radni terapeuti koriste tehnike uštede energije (ECT) u procesu rehabilitacije pacijenata sa cističnom fibrozom.[36] Examples of energy conservation techniques are ergonomic principles, pursued lip breathing, and diaphragmatic breathing.[37] Pacijenti sa CF imaju umor i dispneju zbog hroničnih plućnih infekcija, pa smanjenje količine energije potrošene tokom aktivnosti može im pomoći da se osjećaju bolje i steknu veću neovisnost. U najboljem slučaju, sadašnji tretmani odgađaju pad funkcije organa. Zbog širokih razlika u simptomima bolesti, liječenje se obično odvija u specijalističkim multidisciplinarnim centrima i prilagođeno je pojedincu. Ciljevi za terapiju su pluća, gastrointestinalni trakt (uključujući dodatke enzima gušterače), reproduktivni organi (uključujući pomoćnu reproduktivnu tehnologiju) i psihološka podrška.
Najdosljedniji aspekt terapije kod CF je ograničavanje i liječenje oštećenja pluća uzrokovanih gustom sluzi i infekcijama, s ciljem održavanja kvaliteta života. Intravenska, inhalacija i oralni antibiotici koriste se za liječenje hroničnih i akutnih infekcija. Mehanički uređaji i inhalacijski lijekovi koriste se za izmjenu i pročišćavanje zgusnute sluzi. Ove terapije, iako su učinkovite, mogu izuzetno dugo trajati. Terapija kisikom kod kuće preporučuje se onima sa značajnim niskim nivoom kiseika.[38] Mnogi ljudi sa CF koriste probiotike, za koje se smatra da mogu ispraviti crijevnu disbiozu i upale, ali dokazi iz kliničkih ispitivanja u vezi sa efikasnošću probiotika za smanjenje pogoršanja pluća kod osoba sa CF nisu sigurni.[39]
Transplantacija
urediTransplantacija pluća može postati neophodna za osobe sa CF kako opadaju plućna funkcija i tolerancija vježbanja. Iako je pojedinačna transplantacija pluća moguća i kod drugih bolesti, osobama sa CF moraju se zamijeniti oba plućna krila, jer preostala pluća mogu sadržavati bakterije koje mogu inficirati presađeno pluće. Transplantacija gušterače ili jetre može se izvesti istovremeno za ublažavanje bolesti jetre i/ili dijabetesa.[40] Transplantacija pluća uzima se u obzir kada funkcija pluća opadne do te mjere da je potrebna pomoć mehaničkih uređaja ili je nečije preživljavanje ugroženo.[41] Prema Merckovom priručnik za dijagnozu i terapiju, "bilateralna transplantacija pluća za teške bolesti pluća postaje sve rutinskija i uspješnija sa iskustvom i poboljšanim tehnikama. Među odraslima s CF, medijana preživljavanja nakon transplantacije je oko 9 godina.[42]
Prognoza
urediPrognoza za cističnu fibrozu poboljšala se zbog ranije dijagnoze kroz skrining i bolji tretman i pristup zdravstvenoj zaštiti. Godine 1959. srednja dob preživljavanja djece sa CF u Sjedinjenim Državama bila je šest mjeseci.[43] U 2010. godini procjenjeno se da će preživljavanje za žene biti 37 godina, a za muškarce 40.[44]
U SAD-u, od onih s CF, koji imaju više od 18 godina od 2009. godine, 92% je završilo srednju školu, 67% je imalo barem neko fakultetsko obrazovanje, 15% je bilo invalidno, 9% je bilo nezaposleno, 56% bilo je samaca , a 39% je bilo u braku ili živi s partnerom.[45]
Epidemiologija
uredi| Mutcija | Frekvencija (svjetska)[46] |
|---|---|
| ΔF508 | 66%–70% |
| G542X | 2,4% |
| G551D | 1,6% |
| N1303K | 1,3% |
| W1282X | 1,2% |
| Sve ostale | 27,5% |
Cistična fibroza je najčešća autosomno recesivna bolest, koja ograničava život među ljudima evropskog naslijeđa.[47] U Sjedinjenim Državama oko 30.000 osoba ima CF; većini se dijagnosticira sa šest mjeseci života. U Kanadi oko 4.000 ljudi ima CF.[48] Otprilike 1/25 ljudi evropskog porijekla i 1/30 evropeidnih Amerikanaca,[49] je nositelj CF mutacije. Iako je CF rjeđi u ovim skupinama, otprilike 1/46 Latinoamerikanaca, 1/65 Afroamerikanaca i 1/90 azijatskog porijekla nosi barem jednu abnormalnost gena CFTR.[50][51] Ireland has the world's highest prevalence of CF, at one in 1353.[52]
Iako je tehnički rijetka bolest, CF se svrstava među najrasprostranjenije genetičke bolesti koje skraćuju život. Najčešća je u zemljama zapadnog svijeta. Izuzetak je Finska, gdje samo svaka od 80 osoba nosi CF mutaciju.[53] Prema Svjetskoj zdravstvenoj organizaciji : "U Evropskoj uniji utvrđeno je da je jedno od 2000-3000 novorođenčadi pogođeno CF-om".[54] In the United States, one in 3,500 children is born with CF.[55] U 1997. otprilike 1/3.300 evropeidne djece u Sjedinjenim Državama rođeno je s CF. Suprotno tome, samo jedno od 15.000 afroameričke djece patilo je od toga, a kod azijskih Amerikanaca stopa je bila čak i niža na jedno od 32.000.[56]
Cistična fibroza pogađa podjednako i muškarce i žene. Iz razloga koji ostaju nejasni, podaci su pokazali da muškarci imaju duži životni vijek od žena,[57][58] iako nedavne studije sugeriraju da ova rodna razlika možda više i ne postoji, možda zbog poboljšanja u zdravstvenim ustanovama.[59][60] Nedavno istraživanje iz Irske utvrdilo je vezu između ženskog hormona estrogena i lošijih ishoda kod CF.[61]
Distribucija alela CF razlikuje se među populacijama. Učestalost nositelja ΔF508 procijenjena je na 1/200 u sjevernoj Švedskoj, 1/143 u Litvaniji i 1/38 u Danskoj. Nije pronađen nijedan nositelj ΔF508 među 171 Finaca i 151 pripadnika Saami naroda.[62] ΔF508 se javlja u Finskoj, ali tamo je manjinski alel. Poznato je da se u Finskoj CF javlja u samo 20 porodica (rodoslova).[63]
Reference
uredi- ^ a b c d e f g h i j k l m n o p O'Sullivan BP, Freedman SD (maj 2009). "Cystic fibrosis". Lancet. 373 (9678): 1891–904. doi:10.1016/s0140-6736(09)60327-5. PMID 19403164. S2CID 46011502.
- ^ a b c Hodson M, Geddes D, Bush A, ured. (2012). Cystic Fibrosis (3rd izd.). London: Hodder Arnold. str. 3. ISBN 978-1-4441-1369-3. Arhivirano s originala, 8. 9. 2017.
- ^ a b c Massie J, Delatycki MB (decembar 2013). "Cystic fibrosis carrier screening". Paediatric Respiratory Reviews. 14 (4): 270–5. doi:10.1016/j.prrv.2012.12.002. PMID 23466339.
- ^ Buckingham L (2012). Molecular Diagnostics: Fundamentals, Methods and Clinical Applications (2nd izd.). Philadelphia: F.A. Davis Co. str. 351. ISBN 978-0-8036-2975-2. Arhivirano s originala, 8. 9. 2017.
- ^ Yankaskas JR, Marshall BC, Sufian B, Simon RH, Rodman D (januar 2004). "Cystic fibrosis adult care: consensus conference report". Chest. 125 (1 Suppl): 1S–39S. CiteSeerX 10.1.1.562.1904. doi:10.1378/chest.125.1_suppl.1S. PMID 14734689.
- ^ Warnock L, Gates A (decembar 2015). "Chest physiotherapy compared to no chest physiotherapy for cystic fibrosis". The Cochrane Database of Systematic Reviews (12): CD001401. doi:10.1002/14651858.CD001401.pub3. PMC 6768986. PMID 26688006.
- ^ Ong T, Ramsey BW (septembar 2015). "Update in Cystic Fibrosis 2014". American Journal of Respiratory and Critical Care Medicine. 192 (6): 669–75. doi:10.1164/rccm.201504-0656UP. PMID 26371812.
- ^ Nazareth D, Walshaw M (oktobar 2013). "Coming of age in cystic fibrosis - transition from paediatric to adult care". Clinical Medicine. 13 (5): 482–6. doi:10.7861/clinmedicine.13-5-482. PMC 4953800. PMID 24115706.
- ^ Andersen DH (1938). "Cystic fibrosis of the pancreas and its relation to celiac disease: a clinical and pathological study". Am. J. Dis. Child. 56 (2): 344–99. doi:10.1001/archpedi.1938.01980140114013.
- ^ Quinton PM (juni 2007). "Cystic fibrosis: lessons from the sweat gland". Physiology. 22 (3): 212–25. doi:10.1152/physiol.00041.2006. PMID 17557942. S2CID 7921681.
- ^ a b Hardin DS (august 2004). "GH improves growth and clinical status in children with cystic fibrosis -- a review of published studies". European Journal of Endocrinology. 151 Suppl 1 (Suppl 1): S81-5. doi:10.1530/eje.0.151S081. PMID 15339250.
- ^ a b De Lisle RC (septembar 2009). "Pass the bicarb: the importance of HCO3- for mucin release". The Journal of Clinical Investigation. 119 (9): 2535–7. doi:10.1172/JCI40598. PMC 2735941. PMID 19726878.
- ^ O'Malley CA (maj 2009). "Infection control in cystic fibrosis: cohorting, cross-contamination, and the respiratory therapist" (PDF). Respiratory Care. 54 (5): 641–57. doi:10.4187/aarc0446. PMID 19393108. Arhivirano (PDF) s originala, 15. 7. 2011.
- ^ Makker K, Agarwal A, Sharma R (april 2009). "Oxidative stress & male infertility" (PDF). The Indian Journal of Medical Research. 129 (4): 357–67. PMID 19535829. Arhivirano s originala (PDF), 5. 7. 2010. Pristupljeno 10. 4. 2010.
- ^ Blackman SM, Deering-Brose R, McWilliams R, Naughton K, Coleman B, Lai T, et al. (oktobar 2006). "Relative contribution of genetic and nongenetic modifiers to intestinal obstruction in cystic fibrosis". Gastroenterology. 131 (4): 1030–9. doi:10.1053/j.gastro.2006.07.016. PMC 1764617. PMID 17030173.
- ^ Ratjen FA (maj 2009). "Cystic fibrosis: pathogenesis and future treatment strategies" (PDF). Respiratory Care. 54 (5): 595–605. doi:10.4187/aarc0427. PMID 19393104. Arhivirano (PDF) s originala, 15. 7. 2011.
- ^ Reaves J, Wallace G (2010). "Unexplained bruising: weighing the pros and cons of possible causes". Consultant for Pediatricians. 9: 201–2. Arhivirano s originala, 22. 2. 2020. Pristupljeno 12. 6. 2021.
- ^ Guimbellot J, Sharma J, Rowe SM (novembar 2017). "Toward inclusive therapy with CFTR modulators: Progress and challenges". Pediatric Pulmonology. 52 (S48): S4–S14. doi:10.1002/ppul.23773. PMC 6208153. PMID 28881097.
- ^ Sharma J, Keeling KM, Rowe SM (august 2020). "Pharmacological approaches for targeting cystic fibrosis nonsense mutations". European Journal of Medicinal Chemistry. 200: 112436. doi:10.1016/j.ejmech.2020.112436. PMC 7384597. PMID 32512483. Provjerite vrijednost datuma u parametru:
|pmc-embargo-date=(pomoć) - ^ Bobadilla JL, Macek M, Fine JP, Farrell PM (juni 2002). "Cystic fibrosis: a worldwide analysis of CFTR mutations--correlation with incidence data and application to screening". Human Mutation. 19 (6): 575–606. doi:10.1002/humu.10041. PMID 12007216. S2CID 35428054.
- ^ Short DB, Trotter KW, Reczek D, Kreda SM, Bretscher A, Boucher RC, et al. (juli 1998). "An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton". The Journal of Biological Chemistry. 273 (31): 19797–801. doi:10.1074/jbc.273.31.19797. PMID 9677412.
- ^ Travaglini KJ, Krasnow MA (august 2018). "Profile of an unknown airway cell". Nature. 560 (7718): 313–314. Bibcode:2018Natur.560..313T. doi:10.1038/d41586-018-05813-7. PMID 30097657.
- ^ Edwards QT, Seibert D, Macri C, Covington C, Tilghman J (novembar 2004). "Assessing ethnicity in preconception counseling: genetics--what nurse practitioners need to know". Journal of the American Academy of Nurse Practitioners. 16 (11): 472–80. doi:10.1111/j.1745-7599.2004.tb00426.x. PMID 15617360. S2CID 7644129.
- ^ Childers M, Eckel G, Himmel A, Caldwell J (2007). "A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates". Medical Hypotheses. 68 (1): 101–12. doi:10.1016/j.mehy.2006.06.020. PMID 16934416.
- ^ a b Rowe SM, Miller S, Sorscher EJ (maj 2005). "Cystic fibrosis". The New England Journal of Medicine. 352 (19): 1992–2001. doi:10.1056/NEJMra043184. PMID 15888700.
- ^ Xu Y, Szép S, Lu Z (decembar 2009). "The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases". Proceedings of the National Academy of Sciences of the United States of America. 106 (48): 20515–9. Bibcode:2009PNAS..10620515X. doi:10.1073/pnas.0911412106. PMC 2777967. PMID 19918082.
- ^ Moskwa P, Lorentzen D, Excoffon KJ, Zabner J, McCray PB, Nauseef WM, et al. (januar 2007). "A novel host defense system of airways is defective in cystic fibrosis". American Journal of Respiratory and Critical Care Medicine. 175 (2): 174–83. doi:10.1164/rccm.200607-1029OC. PMC 2720149. PMID 17082494.
- ^ Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M (januar 2007). "The lactoperoxidase system links anion transport to host defense in cystic fibrosis". FEBS Letters. 581 (2): 271–8. doi:10.1016/j.febslet.2006.12.025. PMC 1851694. PMID 17204267.
- ^ Verkman AS, Song Y, Thiagarajah JR (januar 2003). "Role of airway surface liquid and submucosal glands in cystic fibrosis lung disease". American Journal of Physiology. Cell Physiology. 284 (1): C2-15. doi:10.1152/ajpcell.00417.2002. PMID 12475759. S2CID 11790119.
- ^ Marieb EN, Hoehn K, Hutchinson M (2014). "22: The Respiratory System". Human Anatomy and Physiology. Pearson Education. str. 906. ISBN 978-0805361179.
- ^ Mishra A, Greaves R, Massie J (novembar 2005). "The relevance of sweat testing for the diagnosis of cystic fibrosis in the genomic era". The Clinical Biochemist. Reviews. 26 (4): 135–53. PMC 1320177. PMID 16648884.
- ^ Davies JC, Alton EW, Bush A (decembar 2007). "Cystic fibrosis". BMJ. 335 (7632): 1255–9. doi:10.1136/bmj.39391.713229.AD. PMC 2137053. PMID 18079549.
- ^ Ross LF (septembar 2008). "Newborn screening for cystic fibrosis: a lesson in public health disparities". The Journal of Pediatrics. 153 (3): 308–13. doi:10.1016/j.jpeds.2008.04.061. PMC 2569148. PMID 18718257.
- ^ Assael BM, Castellani C, Ocampo MB, Iansa P, Callegaro A, Valsecchi MG (septembar 2002). "Epidemiology and survival analysis of cystic fibrosis in an area of intense neonatal screening over 30 years". American Journal of Epidemiology. 156 (5): 397–401. doi:10.1093/aje/kwf064. PMID 12196308.
- ^ Freudenheim M (22 Dec 2009). "Tool in Cystic Fibrosis Fight: A Registry". The New York Times. str. D1. Arhivirano s originala, 24. 5. 2013. Pristupljeno 21 Dec 2009.
- ^ "Abstracts from the 25th Italian Congress of Cystic Fibrosis and the 15th National Congress of Cystic Fibrosis Italian Society : Assago, Milan. 10 - 12 October 2019". Italian Journal of Pediatrics. 46 (Suppl 1): 32. april 2020. doi:10.1186/s13052-020-0790-z. PMC 7110616. PMID 32234058.
- ^ Wingårdh AS, Göransson C, Larsson S, Slinde F, Vanfleteren LE (2020). "Effectiveness of Energy Conservation Techniques in Patients with COPD". Respiration; International Review of Thoracic Diseases (jezik: english). 99 (5): 409–416. doi:10.1159/000506816. PMC 7265758. PMID 32272478.CS1 održavanje: nepoznati jezik (link)
- ^ Hayes D, Wilson KC, Krivchenia K, Hawkins SM, Balfour-Lynn IM, Gozal D, et al. (februar 2019). "Home Oxygen Therapy for Children. An Official American Thoracic Society Clinical Practice Guideline". American Journal of Respiratory and Critical Care Medicine. 199 (3): e5–e23. doi:10.1164/rccm.201812-2276ST. PMC 6802853. PMID 30707039.
- ^ Coffey MJ, Garg M, Homaira N, Jaffe A, Ooi CY (januar 2020). "Probiotics for people with cystic fibrosis". The Cochrane Database of Systematic Reviews. 1: CD012949. doi:10.1002/14651858.CD012949.pub2. PMC 6984633. PMID 31962375.
- ^ Fridell JA, Vianna R, Kwo PY, Howenstine M, Sannuti A, Molleston JP, et al. (oktobar 2005). "Simultaneous liver and pancreas transplantation in patients with cystic fibrosis". Transplantation Proceedings. 37 (8): 3567–9. doi:10.1016/j.transproceed.2005.09.091. PMID 16298663.
- ^ Belkin RA, Henig NR, Singer LG, Chaparro C, Rubenstein RC, Xie SX, et al. (mart 2006). "Risk factors for death of patients with cystic fibrosis awaiting lung transplantation". American Journal of Respiratory and Critical Care Medicine. 173 (6): 659–66. doi:10.1164/rccm.200410-1369OC. PMC 2662949. PMID 16387803.
- ^ "Cystic Fibrosis - Pediatrics". Merck Manuals Professional Edition (jezik: engleski). Pristupljeno 12. 8. 2020.
- ^ Davis PB (mart 2006). "Cystic fibrosis since 1938". American Journal of Respiratory and Critical Care Medicine. 173 (5): 475–82. doi:10.1164/rccm.200505-840OE. PMID 16126935. S2CID 1770759.
- ^ MacKenzie T, Gifford AH, Sabadosa KA, Quinton HB, Knapp EA, Goss CH, Marshall BC (august 2014). "Longevity of patients with cystic fibrosis in 2000 to 2010 and beyond: survival analysis of the Cystic Fibrosis Foundation patient registry". Annals of Internal Medicine. 161 (4): 233–41. doi:10.7326/m13-0636. PMC 4687404. PMID 25133359.
- ^ "Cystic Fibrosis Patient Registry Annual Data Report 2009" (PDF). Cystic Fibrosis Foundation. 2009. Arhivirano s originala (PDF), 5. 1. 2012.
- ^ Araújo FG, Novaes FC, Santos NP, Martins VC, Souza SM, Santos SE, Ribeiro-dos-Santos AK (januar 2005). "Prevalence of deltaF508, G551D, G542X, and R553X mutations among cystic fibrosis patients in the North of Brazil". Brazilian Journal of Medical and Biological Research. 38 (1): 11–5. doi:10.1590/S0100-879X2005000100003. PMID 15665983.
- ^ Tobias E (2011). Essential Medical Genetics. John Wiley & Sons. str. 312. ISBN 978-1-118-29370-6. Arhivirano s originala, 17. 4. 2016.
- ^ "The Canadian Facts & Figures on Cystic Fibrosis". cysticfibrosis.ca. Arhivirano s originala, 16. 6. 2013.
- ^ "Genetic Carrier Testing". Cystic Fibrosis Foundation. 2007. Arhivirano s originala, 23. 3. 2010.
- ^ Rosenstein BJ, Cutting GR (april 1998). "The diagnosis of cystic fibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel". The Journal of Pediatrics. 132 (4): 589–95. doi:10.1016/S0022-3476(98)70344-0. PMID 9580754.
- ^ Hamosh A, FitzSimmons SC, Macek M, Knowles MR, Rosenstein BJ, Cutting GR (februar 1998). "Comparison of the clinical manifestations of cystic fibrosis in black and white patients". The Journal of Pediatrics. 132 (2): 255–9. doi:10.1016/S0022-3476(98)70441-X. PMID 9506637.
- ^ Farrell P, Joffe S, Foley L, Canny GJ, Mayne P, Rosenberg M (septembar 2007). "Diagnosis of cystic fibrosis in the Republic of Ireland: epidemiology and costs". Irish Medical Journal. 100 (8): 557–60. PMID 17955689. Arhivirano s originala, 3. 12. 2013.
- ^ Hytönen M, Patjas M, Vento SI, Kauppi P, Malmberg H, Ylikoski J, Kere J (decembar 2001). "Cystic fibrosis gene mutations deltaF508 and 394delTT in patients with chronic sinusitis in Finland". Acta Oto-Laryngologica. 121 (8): 945–7. doi:10.1080/000164801317166835. PMID 11813900.
- ^ "WHO | Genes and human disease". Who.int. 7. 12. 2010. Arhivirano s originala, 20. 10. 2012. Pristupljeno 23. 1. 2013.
- ^ Russell P (2011). Biology: the dynamic science (2nd izd.). Belmont, CA: Brooks/Cole, Cengage Learning. str. 304. ISBN 978-0-538-49372-7. Arhivirano s originala, 17. 4. 2016.
- ^ "Genetic testing for cystic fibrosis Genetic Testing for Cystic Fibrosis". Consensus Development Conference Statement. National Institutes of Health. April 14–16, 1997. Arhivirano s originala, 27. 3. 2009.
- ^ Rosenfeld M, Davis R, FitzSimmons S, Pepe M, Ramsey B (maj 1997). "Gender gap in cystic fibrosis mortality". American Journal of Epidemiology. 145 (9): 794–803. doi:10.1093/oxfordjournals.aje.a009172. PMID 9143209.
- ^ Coakley RD, Sun H, Clunes LA, Rasmussen JE, Stackhouse JR, Okada SF, et al. (decembar 2008). "17beta-Estradiol inhibits Ca2+-dependent homeostasis of airway surface liquid volume in human cystic fibrosis airway epithelia". The Journal of Clinical Investigation. 118 (12): 4025–35. doi:10.1172/JCI33893. PMC 2582929. PMID 19033671.
- ^ Verma N, Bush A, Buchdahl R (oktobar 2005). "Is there still a gender gap in cystic fibrosis?". Chest. 128 (4): 2824–34. doi:10.1378/chest.128.4.2824. PMID 16236961.
- ^ Moran A, Dunitz J, Nathan B, Saeed A, Holme B, Thomas W (septembar 2009). "Cystic fibrosis-related diabetes: current trends in prevalence, incidence, and mortality". Diabetes Care. 32 (9): 1626–31. doi:10.2337/dc09-0586. PMC 2732133. PMID 19542209.
- ^ "CF worse for women 'due to effect of estrogen'". The Irish Times. 8. 8. 2010. Arhivirano s originala, 11. 8. 2010.
- ^ Wennberg C, Kucinskas V (1994). "Low frequency of the delta F508 mutation in Finno-Ugrian and Baltic populations". Human Heredity. 44 (3): 169–71. doi:10.1159/000154210. PMID 8039801.
- ^ Kere J, Savilahti E, Norio R, Estivill X, de la Chapelle A (septembar 1990). "Cystic fibrosis mutation delta F508 in Finland: other mutations predominate". Human Genetics. 85 (4): 413–5. doi:10.1007/BF02428286. PMID 2210753. S2CID 38364780.
Vanjski linkovi
uredi- Cistična fibroza na Curlie
- cf na NIH/UW GeneTests
- Search GeneCards for genes involved in cystic fibrosis
- Cystic Fibrosis Mutation Database
- "Cystic Fibrosis". MedlinePlus. U.S. National Library of Medicine.