PCCB
Propionil-CoA karboksilaza jest enzim koji je kod ljudi kodiran genom PCC Katalizira reakcije karboksilacija propionil CoA u mitohondrijskom matriksu. Enzim je biotin-zavisan. Produkt reakcije je (S)-metilmalonil CoA. Propionyl CoA je krajnji proizvod metabolizma neparnih masnih kiselina, a također je i metabolit većine metil-razgranatih masnih kiselina. Također je glavni metabolit valina, a zajedno sa acetil-CoA, je metabolit izoleucina, kao i metioninski metabolit. Propionil-CoA je stoga od velike važnosti kao prekursor glukoze. (S)-Metilmalonil-CoA se ne može direktno koristiti kod životinja; na njega djeluje racemaza, dajući (R)-metilmalonil-CoA. Potonji se pretvara pomoću metilmalonil-CoA mutaze (jedan od rijetkih enzima zavisnih od vitamina B12) da se dobije sukcinil-CoA. Ovaj se pretvara u oksaloacetat, a zatim malat u Krebsovom ciklusu. Eksport malata u citosol dovodi do stvaranja oksaloacetata, fosfoenol piruvataa i drugih glukoneogenih intermedijera.
| PCCB | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Aliasi | |||||||
| Vanjski ID-jevi | GeneCards: [1] | ||||||
| Ortolozi | |||||||
| Vrste | Čovjek | Miš | |||||
| Entrez |
|
| |||||
| Ensembl |
|
| |||||
| UniProt |
| ||||||
| RefSeq (mRNK) |
|
| |||||
| RefSeq (bjelančevina) |
|
| |||||
| Lokacija (UCSC) | n/a | n/a | |||||
| PubMed pretraga | n/a | n/a | |||||
| Wikipodaci | |||||||
| |||||||
| Propionil-CoA karboksilaza | |
|---|---|
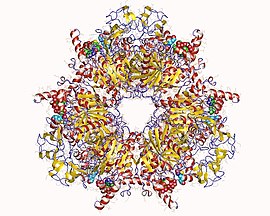 Propionil-CoA karboksilazni heteto-12mer Methylorubrum extorquens | |
| Identifikatori | |
| Simbol | ? |
| CAS broj | |
| Metilmalonil-CoA dekarboksilaza | |
|---|---|
| Identifikatori | |
| Simbol | ? |
| CAS broj | |
- ATP + propionil-CoA + HCO3− <=> ADP + fosfat + (S)-metilmalonil-CoA
Struktura enzima
urediPropionil-CoA karboksilaza (PCC) je alfa(6)-beta(6)-dodekamer od 750 kDa. (Samo oko 540 kDa je prirodni enzim).[1] ) Alfa podjedinice raspoređene su kao monomeri, ukrašavajući centralno beta-6 heksamerno jezgro. Navedeno jezgro je orijentirano kao kratak cilindar sa rupom duž svoje ose.
Alfa podjedinica PCC sadrži domene biotin-karboksilaze (BC) i biotinskog karboksilnog proteina nosača (BCCP). Domen poznat kao BT-domen se također nalazi na alfa podjedinici i od suštinskog je značaja za interakciju sa beta podjedinicom. Osmolančani antiparalelni beta barelni nabor ovog domena je posebno zanimljiv. Beta podjedinica sadrži aktivnost karboksiltransferaze (CT)..[2]
(a) Struktura RpPCCα-RdPCCβ himere, gledano niz trostruku os simetrije. Domeni u α i β podjedinicama u gornjoj polovini strukture imaju različite boje, a one u prvoj α i β podjedinicama su označene. α i β podjedinice u donjoj polovini su obojene u magenta, odnosno zeleno. Crvena strelica pokazuje smjer gledanja panela b.
(b). Struktura RpPCCα-RdPCCβ himere, gledano niz dvostruku osu simetrije. Crveni pravougaonik označava region detaljno prikazan na slici 2a.
(c). Krio-EM rekonstrukcija HsPCC u rezoluciji 15 Å, gledano u istoj orijentaciji kao panel a. Atomski model himere uklopljen je u krio-EM omotač.
(d). Krio-EM rekonstrukcija posmatrana u istoj orijentaciji kao panel b. Strelice pokazuju promjenu u BCCP poziciji koja je potrebna da se uklopi u mapu krio-EM. Sve figure strukture proizvedene su pomoću PyMOL-a (www.pymol.org), a krio-EM figure su proizvedene pomoću Chimera.[3] Ovo pruža jasne dokaze o ključnoj dimernoj interakciji između alfa i beta podjedinica.
BC i CT lokacije su udaljene otprilike 55 Å, što ukazuje na translociranje cijelog BCCP domena tokom katalize karboksilacija propionil-CoA.[3] Ovo pruža jasan dokaz krucijalnosti interakcija dimera između alfa i beta podjedinica.
(a). Relativno pozicioniranje BC i CT aktivnih mjesta u holoenzimu. Prikazane su jedna α podjedinica i β2 dimer (β1 iz jednog i β4 iz drugog sloja), a smjer gledanja je isti kao na slici 1b. Dva aktivna mjesta su označena zvijezdama, razdvojena za 55 Å. Također su prikazane vezane pozicije ADP u kompleksu sa E. coli BC 18 i CoA u kompleksu sa 12S podjedinicom transkarboksilaze 21.
(b). Detalji interakcije između BCCP-biotina i C domena β podjedinice. Interakcije vodikove veze označene su isprekidanim linijama crvenom bojom. N1′ atom biotina označen je kao 1′, vezan vodikovom vezom za karbonil glavnog lanca Phe397.
(c). Molekulska površina CT aktivnog mjesta, koja pokazuje duboki usjek gdje su vezana oba supstrata.
(d) CT aktivne lokacije.[3]
Džep PCC koji vezuje biotin je hidrofoban i visoko konzerviran. Biotin i propionil-CoA se vezuju okomito u aktivnom mjestu koje sadrži oksianionsku rupu. Utvrđeno je da je odnos prirodnog enzima i biotina jedan mol nativnog enzima prema 4 mola biotina.[1] Smatra se da je N1 biotina baza aktivnog mjesta.[2]
Mjesno-usmjerena mutageneza na D422 pokazuje promjenu u specifičnosti supstrata na vezivnom mjestu propionil-CoA, što ukazuje na važnost ovog ostatka u katalitskoj aktivnosti PCC-a.[4] U 1979., inhibicijom fenilglioksalom utvrđeno je da fosfatna grupa iz propionil-CoA ili ATP-a reagira s esencijalnim ostatkom arginina na aktivnom mjestu tokom katalize.[5] Kasnije (2004.) sugerirano je da arginin-338 služi za orijentaciju karboksifosfatnog intermedijera za optimalnu karboksilaciju biotina.[6]
KM vrijednosti za ATP, propionil-CoA i bikarbonat su 0,08 mM, 0,29 mM i 3,0 mM. izoelektrična tačka pada na pH 5,5. Strukturni integritet PCC-a održava se u temperaturnom opsegu od –50 do 37 stepeni Celzijusa i pH opsegu od 6,2 do 8,8. Pokazalo se da je optimalni pH između 7,2 i 8,8 bez vezivanja za biotin.[1] Sa biotinom, optimalni pH je 8,0-8,5.[7]
Enzimski mehanizam
urediNormalni mehanizam katalitske reakcije uključuje karbanionski intermedijer i ne prolazi kroz usklađen proces.[8] Figure 3 shows a probable pathway.
Pokazalo se da je reakcija malo reverzibilna pri niskom fluksu propionil-CoA.[9]
Isozimi
urediLjudi eksprimiraju sljedeća dva propionil-CoA karboksilazna izozima:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Klinički značaj
urediNedostatak PPC povezan je sa propionskom acidemijom.[10][11][12]
Aktivnost PCC-a je najosjetljiviji pokazatelj statusa biotina koji je testiran do sada. U budućim studijama o trudnoći, upotreba podataka o PCC aktivnosti limfocita bi se trebala pokazati vrijednim u procjeni statusa biotina.[13]
Intragenska komplementacija
urediKada više kopija polipeptida kodiranog genom formiraju agregat, ova struktura proteina naziva se multimer. Kada se multimer formira od polipeptida proizvedenih od dva različita mutantna alela određenog gena, miješani multimer može pokazati veću funkcionalnu aktivnost od nepomiješanih multimera formiranih svakim od mutanata posebno. U takvom slučaju, fenomen se naziva intragenska komplementacija.
PCC je heteropolimer sastavljen od α i β podjedinica u strukturi α6β6. Mutacije u PCC, bilo u α podjedinici (PCCα) ili β podjedinici (PCCβ) mogu uzrokovati propionsku acidemiju kod ljudi. Kada su različite ćelijske linije kožnih fibroblasta defektne u PCCβ spojene u parovima, β heteromultimerni protein formiran kao rezultat često je pokazivao viši nivo aktivnosti nego što bi se očekivalo na osnovu aktivnosti roditeljskih enzima.[14] Ovaj nalaz intagene komplementacije ukazuje da multimerna struktura PCC dozvoljava kooperativne interakcije između konstitutivnih PCCβ monomera koji mogu generirati funkcionalniji oblik holoenzima.
Regulacija
urediPropionil-CoA karboksilaze
uredia. Karbamazepin (antiepileptik): značajno snižava nivoe enzima u jetri.[15]
b. šaperoninski proteini E. coli groES i groEL: neophodni za savijanje i sastavljanje ljudskih PCC heteromernih podjedinica [16]
c. Bikarbonat: negativna kooperativnost [6]
d. Mg2+ i MgATP2−: alosterna aktivacija[17]
Pomoću propionil-CoA karboksilaze
uredia. 6-deoksieritronolid B: smanjenje nivoa PCC dovodi do povećane proizvodnje[18]
b. Glukokinaza u beta ćelijama pankreasa: pokazalo se da prekursor beta-PCC smanjuje KM i povećava Vmax; aktivacija [19]
Također pogledajte
urediReference
uredi- ^ a b c Kalousek F, Darigo MD, Rosenberg LE (1980). "Isolation and characterization of propionyl-CoA carboxylase from normal human liver. Evidence for a protomeric tetramer of nonidentical subunits". The Journal of Biological Chemistry. 255 (1): 60–65. PMID 6765947.
- ^ a b Diacovich L, Mitchell DL, Pham H, Gago G, Melgar MM, Khosla C, Gramajo H, Tsai SC (2004). "Crystal Structure of theβ-Subunit of Acyl-CoA Carboxylase: Structure-Based Engineering of Substrate Specificity†,‡". Biochemistry. 43 (44): 14027–14036. doi:10.1021/bi049065v. PMID 15518551.
- ^ a b c Huang CS, Sadre-Bazzaz K, Shen Y, Deng B, Zhou ZH, Tong L (2010). "Crystal structure of the α6β6 holoenzyme of propionyl-coenzyme a carboxylase". Nature. 466 (7309): 1001–1005. doi:10.1038/nature09302. PMC 2925307. PMID 20725044.
- ^ Arabolaza A, Shillito ME, Lin TW, Diacovich L, Melgar M, Pham H, Amick D, Gramajo H, Tsai SC (2010). "Crystal Structures and Mutational Analyses of Acyl-CoA Carboxylase β Subunit of Streptomyces coelicolor". Biochemistry. 49 (34): 7367–7376. doi:10.1021/bi1005305. PMC 2927733. PMID 20690600.
- ^ Wolf B, Kalousek F, Rosenberg LE (1979). "Essential arginine residues in the active sites of propionyl CoA carboxylase and beta-methylcrotonyl CoA carboxylase". Enzyme. 24 (5): 302–306. doi:10.1159/000458679. PMID 510274.
- ^ a b Sloane V, Waldrop GL (2004). "Kinetic characterization of mutations found in propionic acidemia and methylcrotonylglycinuria: evidence for cooperativity in biotin carboxylase". Journal of Biological Chemistry. 279 (16): 15772–15778. doi:10.1074/jbc.M311982200. PMID 14960587.
- ^ Hsia YE, Scully KJ, Rosenberg LE (1979). "Human propionyl CoA carboxylase: Some properties of the partially purified enzyme in fibroblasts from controls and patients with propionic acidemia". Pediatric Research. 13 (6): 746–751. doi:10.1203/00006450-197906000-00005. PMID 481943.
- ^ Stubbe J, Fish S, Abeles RH (1980). "Are carboxylations involving biotin concerted or nonconcerted?". The Journal of Biological Chemistry. 255 (1): 236–242. PMID 7350155.
- ^ Reszko AE, Kasumov T, Pierce BA, David F, Hoppel CL, Stanley WC, Des Rosiers C, Brunengraber H (2003). "Assessing the Reversibility of the Anaplerotic Reactions of the Propionyl-CoA Pathway in Heart and Liver". Journal of Biological Chemistry. 278 (37): 34959–34965. doi:10.1074/jbc.M302013200. PMID 12824185.
- ^ Ugarte M, Pérez-Cerdá C, Rodríguez-Pombo P, Desviat LR, Pérez B, Richard E, Muro S, Campeau E, Ohura T, Gravel RA (1999). "Overview of mutations in thePCCA and PCCB genes causing propionic acidemia". Human Mutation. 14 (4): 275–282. doi:10.1002/(SICI)1098-1004(199910)14:4<275::AID-HUMU1>3.0.CO;2-N. PMID 10502773.
- ^ Desviat LR, Pérez B, Pérez-Cerdá C, Rodríguez-Pombo P, Clavero S, Ugarte M (2004). "Propionic acidemia: Mutation update and functional and structural effects of the variant alleles". Molecular Genetics and Metabolism. 83 (1–2): 28–37. doi:10.1016/j.ymgme.2004.08.001. PMID 15464417.
- ^ Deodato, F.; Boenzi, S.; Santorelli, F. M.; Dionisi-Vici, C. (2006). "Methylmalonic and propionic aciduria". American Journal of Medical Genetics Part C. 142C (2): 104–112. doi:10.1002/ajmg.c.30090. PMID 16602092. S2CID 21114631.
- ^ Stratton SL, Bogusiewicz A, Mock MM, Mock NI, Wells AM, Mock DM (2006). "Lymphocyte propionyl-CoA carboxylase and its activation by biotin are sensitive indicators of marginal biotin deficiency in humans". The American Journal of Clinical Nutrition. 84 (2): 384–388. doi:10.1093/ajcn/84.1.384. PMC 1539098. PMID 16895887.
- ^ Rodríguez-Pombo P, Pérez-Cerdá C, Pérez B, Desviat LR, Sánchez-Pulido L, Ugarte M. Towards a model to explain the intragenic complementation in the heteromultimeric protein propionyl-CoA carboxylase. Biochim Biophys Acta. 2005;1740(3):489-498. doi:10.1016/j.bbadis.2004.10.009
- ^ Rathman SC, Eisenschenk S, McMahon RJ (2002). "The abundance and function of biotin-dependent enzymes are reduced in rats chronically administered carbamazepine". The Journal of Nutrition. 132 (11): 3405–3410. doi:10.1093/jn/132.11.3405. PMID 12421859.
- ^ Kelson TL, Ohura T, Kraus JP (1996). "Chaperonin-mediated assembly of wild-type and mutant subunits of human propionyl-CoA carboxylase expressed in Escherichia coli". Human Molecular Genetics. 5 (3): 331–337. doi:10.1093/hmg/5.3.331. PMID 8852656.
- ^ McKeon C, Wolf B (1982). "Magnesium and magnesium adenosine triphosphate activation of human propionyl CoA carboxylase and beta-methylcrotonyl CoA carboxylase". Enzyme. 28 (1): 76–81. doi:10.1159/000459088. PMID 6981505.
- ^ Zhang H, Boghigian BA, Pfeifer BA (2010). "Investigating the role of native propionyl-CoA and methylmalonyl-CoA metabolism on heterologous polyketide production inEscherichia coli". Biotechnology and Bioengineering. 105 (3): 567–573. doi:10.1002/bit.22560. PMID 19806677. S2CID 659042.
- ^ Shiraishi A, Yamada Y, Tsuura Y, Fijimoto S, Tsukiyama K, Mukai E, Toyoda Y, Miwa I, Seino Y (2000). "A novel glucokinase regulator in pancreatic beta cells: precursor of propionyl-CoA carboxylase beta subunit interacts with glucokinase and augments its activity". Journal of Biological Chemistry. 276 (4): 2325–2328. doi:10.1074/jbc.C000530200. PMID 11085976.
Vanjski linkovi
uredi- Propionyl-CoA Carboxylase na US National Library of Medicine Medical Subject Headings (MeSH)
Šablon:Enzimi lipidnog metabolizma