Nervno-mišićna veza
Nervno-mišićna veza (ili mionervna veza / neuromišićna veza / neuromišićna spojnica) je hemijska sinapsa koja se formira u kontaktu između motornog neurona i mišićnih vlakana. To je neuromišićna spojnica koja motornom neuronu omogućava prijenos signala do mišićnih vlakana, uzrokujući mišićnu kontrakciju.[1][2]
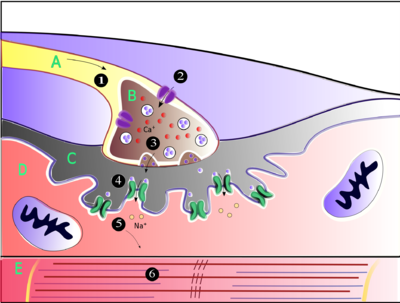
(1) akcijski potencijal stiže na vrh aksona.
(2) Prekidač koji zavisi od kalcija otvara „vrata“, omogućavajući kalciju ulazak u aksonski terminal.
(3) Osigurač neurotransmiterske vezikule sa presinapsne membrane omogućava da i acetilholin (ACh) uđe u sinapsnu pukotinu putem egzocitoze.
(4) ACh se veže za postsinapsne receptore na sarkolemi.
(5) Ova veza uzrokuje izmjenu iona i otvaranje ionskih kanala i omogućava natrijevim ionima da teku kroz membranu u mišićnu ćeliju. (6) Protok natrijevih iona kroz membranu u mišićnu ćeliju generira akcijski potencijal koji putuje u miofibrile i rezultatira kontrakcijom miša.
Oznake: A - Akson motornog neuron; B - Aksonski terminal. C - Sinapsna pukotina. D - Mišićne ćelije. E - Dio miofibrila
Pregled
urediZa normalnu funkciju, mišićima je potreban odgovarajući signal, čak i za samo održavanje tonusa mišića, izbjegavajući atrofiju. Sinapsne transmisije na neuromišićnoj vezi počinju kada akcioni potencijal dostigne presinapsni terminal motornog neurona, čije aktiviranje napona zavisi od kalcijevog kanala kako bi se ionima kalcija omogućio ulazak u neuron. Kalcijevi ioni se vezuju za proteine senzora (sinaptotagmin) na sinaptičkim vezikulama, što je izaziva da se one spoje sa ćelijskom membranom i naknadno oslobađaju neurotransmitere iz motornog neurona u sinapsnu pukotinu. U kičmenjaka, motorni neuroni otpuštaju acetilholin (ACh), malu molekulu neurotransmitera, koji se raspršuje preko sinapsne pukotina i vezuje za nikotinski acetilholin receptora (nAChRs) na ćelijskoj membrani mišićnih vlakana, poznatoj I kao sarkolema. Ionotropni receptori su nAChRs, što znači da služe kao ligand-kontrolisani ionski kanali. Vezivanje ACH za receptor može depolariziraati mišićna vlakna, uzrokujući kaskadu koja na kraju rezultira mišićnom kontrakcijom.[1][3][4][5]
Bolesti neuromišićnih veza mogu biti genetičkog i autoimunog porijekla. Genetički poremećaja, kao što je Duchenne mišićna distrofija, mogu nastati zbog prisustva mutiranih strukturnih proteina koji čine neuromišićne veze, a autoimune bolesti, kao što je ‘’miastenija gravis’’, nastaju kada se proizvode antitijela protiv nikotinskih receptora acetilkolina na sarkolemi
Struktura i funkcija
urediNeuromišićna veza ili spojnica se razlikuje od hemijska sinapsa|hemijskih sinapsi između neurona. Presinaptički motorni akson se završava na 30 nanometara od sarkoleme, ćelijske membrane mišićne ćelije. Ovaj 30-nanometarski prostor čini sinapsnu pukotinu kroz koju se oslobađaju signalne molekule. Sarkolema ima ulegnuće (invaginaciju) pod nazivom postsinapsni nabor, koji povećava površinu membrane izložene sinaptičke pukotina Ovi nabori čine ono što se naziva motorna (krajnja) ploča, koji posjeduju receptore nikotinskog acetilholina (nAChRs), gustoće od 10.000 receptora / mikrometar2 (u skeletnim mišićima).
Presinapsni akson ima ispupčenja zvana terminalna dugmad (ili presinapsni terminal) koji se projicirasju u postveznim naborima sarkoleme. Presinapsni terminali imaju aktivne zone koje sadrže vezikule, kvanti, pune molekula acetilkolina. Ove vezikule mogu biti presinapsni osigurač membrane i ispuštati molekule ACh u sinapsnu pukotinu putem egzocitoze nakon depolarizacije. AChRs su lokalizirane na suprotnoj strani presinaptičkih terminala proteinske skele na postveznim naborima sarkoleme. Distrofin, strukturni protein, povezuje sarkomeru, sarkolemu i komponente vanćelijskog matriksa. Rapsin je još jedan protein koji prihvata AChRs i strukturne proteine u citoskeletu. Također je prisutan receptor tirozin kinaze , proteina MuSK, signalni protein uključen u razvoj neuromišićne spojnice, koja se također održava u mjestu pri rapsinu.[6][7]
Mehanizam djelovanja
urediNeuromišićne veze su ondje gdje neuron aktivira kontrakciju mišića. Po dolasku na akcijski potencijal u presinapsnom neuronskom terminalu, o naponu ovisni kalcijevi kanali se otvaraju i Ca2+ ioni iz vanćelijske tečnosti i protiču u presinapsni neuron u citosolu. Ovaj priliv Ca2+ uzrokuje da sinapsne vezikule koje sadrže neurotransmiter da omoguće da i osigurač dopusti prolaz kroz ćelijsku membranu presinapsnog neurona putem SNARE proteina. Fuzija mjehurastih membrana rezultatira pražnjenjem presinapsne ćelijske membran, odnosno sadržaja vezikule (sa acetilholinom) u sinapsnu pukotinu, u procesu poznatom kao egzocitoza. Acetilholin difundira u sinapsnu pukotinu i može se, na motornoj ploči, vezati za receptore nikotinskog acetilholina.
Receptori acetilholina i neuromišićna veza
uredi2. Ioni
3. Ligand (acetlholin)
Kada se ligand veže za receptor, ionski kanal receptora se otvara, što omogućava prolaz kroz ćelijsku membranu.
Acetilholin je neurotransmiter sintetiziran iz hrane, odnosno holina i acetil-CoA (ACoA), a uključen je u stimulaciju mišićnog tkiva u kičmenjaka, kao i u nekih beskičmenjaka. Kod kičmenjaka, podtip receptora acetilholina koji se nalazi na neuromišićnoj vezi skeletnih mišića je receptor nikotinskog acetilkolina (nAChR), koji je ligand-kontrolirani ionski kanal. Svaka podjedinica ovog receptora ima karakterističnu "Cys-petlju", koja se sastoji od cisteinskog ostatka u nizu 13 aminokiselinskih i drugih cisteinskih ostataka. Dva cisteinskih ostataka formiraju disulfidnu vezu što rezultira u receptoru "Cys-petlje" koji je sposoban vezati acetilkolin i druge ligande. Ovi receptori Cys-petlje se mogu naći samo u eukariota, ali i prokarioti posjeduju ACh receptore sa sličnim svojstvima.
AChRs na skeletnim neuromišićnim vezama heteromernog oblika sastoje se od dvije α, jedne β, jedne ɛ i jedne δ podjedinice. Kada se jednom ACh ligand veže za jednu od α podjedinica ACH receptora to izaziva konformacijske promjene na granici s drugom ACHR α podjedinicama. Ova konformaciona promjena rezultatira povećanjem afiniteta druge α podjedinice za drugi ACh ligand. AChRs stoga ispoljavaju sigmoidnu krivu disocijacije zbog ovog združenog vezivanja. Prisustvo neaktivne, intermedijarne strukture receptora sa jednostruko vezanim ligandom drži ACh u sinapsi koji bi inače mogao biti izgubljen hidrolizom putem holinesteraze ili difuzije. Upornost ovih ACh liganada u sinapsi može izazvati produženi post-sinapsni odgovor Ne djeluju sve neuromišićne veze na bazi acetilkholina; činjenica je da rakovi imaju glutamatne neuromišićne veze.
Ne djeluju sve neuromišićne veze na bazi acetilkholina; činjenica je da rakovi imaju glutamatne neuromišićne veze.[8]
Razvoj neuromišićnih veza
urediRazvoj neuromišićne veze zahtijeva signalizaciju iz oba terminala motornog neurona i centralne regije mišićne ćelije. Tokom razvoja, mišićne ćelije proizvode receptore acetilholina (AChRs) i ispoljavaju ih u centralnom regijama u procesu koji se zove preobrazba. Smatra se Agrin i heparin proteoglikan, jedna MuSK kinaza poažu u stabilizaciji akumulacije ACHR u centralnim dijelovima miocita. MuSK je receptor tirozin kinaze – što znači da pokreće ćelijsku signalizacija vezivanjem fosfat ne molekule, regijama poput tirozina i za druge mete u citoplazmi . Nakon aktivacije svojom ligandom AGRIN, MuSK signali preko dva proteina pod nazivom "Dok-7" i "rapsin" izazivaju "klasterizaciju" receptora acetilholina.[9]
Oslobađanjem ACh u razvoju motornih neurona proizvodi postsinapsni potencijal u mišićnim ćelijama koje pozitivno ojačavaju lokalizaciju i stabilizaciju razvoja neuromišićne veze.[10][11]
Ovi nalazi su dijelom demonstrirani dijelom kod miša, u "transgenim nokaut" istraživanjima. Miševi koji su deficitarni za bilo AGRIN i MuSk, ne formiraju neuromišićne veze. Nadalje, miševi manjkavi u Dok-7 nisu imali ni klaster acetilholinskih receptora ili neuromišićne sinapse.[12]
Također pogledajte
urediReference
uredi- ^ a b Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Hadžiselimović R., Maslić E. (1999): Osnovi etologije – Biologija ponašanja životinja i ljudi. Sarajevo Publishing, Sarajevo, ISBN 9958-21-091-6.
- ^ Nicholls, John G.,; A. Robert Martin; Paul A. Fuchs; David A. Brown; Matthew E. Diamond; David A. Weisblat (2012). From Neuron to Brain (5th izd.). Sunderland: Sinauer Associates.CS1 održavanje: dodatna interpunkcija (link) CS1 održavanje: više imena: authors list (link)
- ^ Sine SM (juli 2012). "End-plate acetylcholine receptor: structure, mechanism, pharmacology, and disease". Physiol. Rev. 92 (3): 1189–234. doi:10.1152/physrev.00015.2011. PMC 3489064. PMID 22811427. Arhivirano s originala, 14. 12. 2019. Pristupljeno 11. 1. 2016.
- ^ Scuka M, Mozrzymas JW (1992). "Postsynaptic potentiation and desensitization at the vertebrate end-plate receptors". Prog. Neurobiol. 38 (1): 19–33. doi:10.1016/0301-0082(92)90033-B. PMID 1736323.
- ^ Valenzuela D, Stitt T, DiStefano P, Rojas E, Mattsson K, Compton D, Nuñez L, Park J, Stark J, Gies D (1995). "Receptor tyrosine sinase specific for the skeletal muscle lineage: expression in embryonic muscle, at the neuromuscular junction, and after injury". Neuron. 15 (3): 573–84. doi:10.1016/0896-6273(95)90146-9. PMID 7546737.CS1 održavanje: više imena: authors list (link)
- ^ Glass D, Bowen D, Stitt T, Radziejewski C, Bruno J, Ryan T, Gies D, Shah S, Mattsson K, Burden S, DiStefano P, Valenzuela D, DeChiara T, Yancopoulos G (1996). "Agrin acts via a MuSK receptor complex". Cell. 85 (4): 513–23. doi:10.1016/S0092-8674(00)81252-0. PMID 8653787.CS1 održavanje: više imena: authors list (link)
- ^ Witzemann V (novembar 2006). "Development of the neuromuscular junction". Cell Tissue Res. 326 (2): 263–71. doi:10.1007/s00441-006-0237-x. PMID 16819627.
- ^ Okada K, Inoue A, Okada M, Murata Y, Kakuta S, Jigami T, Kubo S, Shiraishi H, Eguchi K, Motomura M, Akiyama T, Iwakura Y, Higuchi O, Yamanashi Y (2006). "The muscle protein Dok-7 is essential for neuromuscular synaptogenesis". Science. 312 (5781): 1802–5. doi:10.1126/science.1127142. PMID 16794080.CS1 održavanje: više imena: authors list (link)