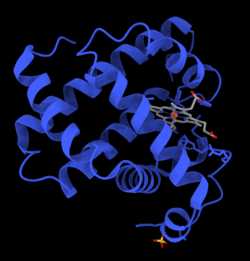
Mioglobin
Mioglobin (grč. μυς - mys = mišić + lat. globus = kugla) je protein sa vezom željezo-kisik, koji se nalazi u mišićnom tkivu kičmenjaka općenito, a osobito sisara. To je citoplazmatski globularni hemoprotein sastavljen od jednog polipeptidnog lanca, koji sadrži 154 aminokiselina. Relativno je mali protein (Mr=17.600) – prisutan najčešće u mišićnim ćelijama srca i oksidativnim vlaknima skeletnih mišića. Karakterizira ga funkcijska sličnost sa hemoglobinom, jer oba dvosmjerno vežu kisik (O2) i tako olakšavaju transport O2 od crvenih krvnih zrnaca do mišićnih mitohondrija tokom pojačane metaboličke aktivnosti ili mogu biti rezervoari O2 za vrijeme hipoksije ili anoksije. Međutim, za razliku od hemoglobina, monomer mioglobina sa jednim O2 vezujućim mjestom, ima hiperboličnu O2-saturacijsku krivu, koja je karakteristična za normalnu Mihaelis-Menten enzimsku kinetiku, pravilniju nego što je sigmoidna kriva koja je svojstvena tetramernom hemoglobinu.[5][6]
Kod ljudi, mioglobin se u krvotoku može naći samo nakon ozljede mišića. To je abnormalan nalaz, a može biti dijagnostički relevantan kada se nađe u krvi.[7]

R grupe podupiru O2-vezujuće mjesto
Mioglobin je primarni biološki pigment prenosnik kisika u mišićnom tkivu. Visoke koncentracije mioglobina u mišićnim ćelijama omogućavuju organizmu da zadrži dah na duži vremenski period. Roneći sisari, kao što su kitovi i delfini, imaju mišiće sa posebno visokim obiljem mioglobina. Mioglobin se u mišićima nalazi kao tip I, tip II A i tipa II B, ali većina izvora smatra da se mioglobina ne može se naći u glatkim mišićima.[8][9]
Mioglobin je bio prvi protein kod kojeg je nađena trodimenzijska struktura putem kristalografije X-zracima.[10] Ovo postignuće je objavio John Kendrew sa saradnicima, u 1958. Za ovo otkriće, John Kendrew i Max Perutz su dobili zajedničku Nobelovu nagradu za hemiju, 1962. Uprkos tome što je jedna od najvažnijih studija proteina u biologiji, fiziološka funkcija mioglobina još uvijek nije pouzdano utvrđena: genetički modificirani miševi kojima nedostaje mioglobina su održivi, ali ispoljavaju smanjenje od oko 30% normalnog volumena krvi koji se pumpa iz srca za vrijeme kontrakcije. Oni su prilagođeni na ovaj nedostatak putem prirodne reakcije na nedovoljan dotok kisika (hipoksiju) i širenje krvnih sudova (vazodilataciju). Kod ljudi mioglobin je kodiran genom sa oznakom MB.[11]
Razlike hemoglobin − mioglobin
urediMioglobin je sličan hemoglobinu po tome što je uključen u transport kisika do ćelija. Postoji mnogo jasnih razlika razdvajaju protein od hemoglobina. Jedan protein ima samo jedan vezujući kisik s jedne hem grupe proteina. Iako mioglobin može vezati samo jedan atom kisika, afinitet za kisik mu je vrlo visok u odnosu na hemoglobin. To je vjerojatno zbog činjenice da hemoglobin transportira 4 kisika u tkivima i mišićima, gdje je uglavnom prisutan mioglobin. Mioglobin uzima kisik iz hemoglobina (zbog Bohrovog efekta) i nosi taj kisik ka mišićnim ćelijama za upotrebu u metaboličkim procesima.
Boja mesa
urediMioglobin sadrži hem grupu, pigment koji je odgovoran za boju crvenog mesa. Boja mesa dijelom određuje stepen oksidacije mioglobina. U svježem mesu atom željeza je u fero obliku, vezan za molekulski kisik (O2). Dobro kuhano meso je smeđe boje, jer je atom željeza tada u feri – oksidiranom stanju (+3), pošto je izgubilo elektron. Ako je meso izloženo nitritima, ono će ostati roze, jer se atom željeza veže za NO, dušik-oksid (važi i za, npr., govedinu ili osušenu šunku). Meso s roštilja također može dobiti pink boju "dimni prsten", koja dolazi od vezivanje željeza za molekulu ugljik-monoksida. Sirovo meso zapakirano u ugljik-monoksidnu atmosferu također ima ovaj isti dimni prsten ("smoke ring") po istim principima. Naime, ružičasta boja na površini ovog sirovog mesa se obično povezuje u pomislima potrošača na svježe meso. Ova umjetno izazvana ružičasta boja i dalje opostaje, navodno do jedne godine. Firme „Hormel“ i „Cargill“ su prijavljene da u pakiranju koriste ovaj proces, a meso tretirano na ovaj način je na tržištu od 2003.[12][13]
Uloga u bolesti
urediMioglobin se ispušta iz oštećenog mišićnog tkiva (rabdomioliza), koje ima vrlo visoke koncentracije mioglobina. Oslobođeni mioglobin se filtrira u bubrezima, ali je toksičan za bubrežni tubulski epitel i tako može izazvati akutne ozljede bubrega. Mioglobin sama po sebi nije otrovan (već je protoksin), ali jeste ferihematni dio, koji se odvoji od mioglobina u kiselom okruženju (npr. kiseli urin, lizosomi).
Mioglobin je osjetljiv marker za ozljede mišića, što ga čini potencijalnim pokazateljem za srčani udar, kod bolesnika koji imaju bol u grudima. Međutim, povišena koncentracija mioglobina ima nisku specifičnost za akutni infarkt miokarda (AIM) pa za postavljanje dijagnoze treba uzeti u obzir CK-MB , cTnT, elektrokardiogram i kliničke znakove.
Funkcije i vezanje
urediOlakšavanje difuzije O2
urediZnačajna uloga mioglobina je u olakšavanje difuzije. Na početku aktiviranja mišića, brzo se desaturira, povećavajući gradijent pritiska kisika od kapilara do citoplazme. Dalje, pretpostavka se da, približavanjem ćelijskoj membrani, veže O2 i difundira do mitohondrija.
NMR eksperimenti pokazuju da saturiranje mioglobina (približno 76%) u izoliranom srcu ostaje nepromijenjeno, uprkos osmostrukom povećanju brzine rada srca. Neinvazivna NMR proučavanja aktivnog mišića u ljudskoj nozi pokazuju 50% otpuštanje kisika od mioglobina, pri čemu parcijalni sarkoplazmatični pritisak iznosi približno 0,32 kPa. S druge strane, rezultati novijih studija srca pokazuju da mioglobin u tom mišiću, pod normalnim uvjetima, može biti deoksigeniran samo 10%.
Difuzija mioglobina
urediRazličitim metodama je utvrđeno da mioglobin može difundirati u homogenoj vodenoj fazi koja, u širokoj oblasti citoplazme. Pritom se ne može razlikovati da li su smetnje u difuziji posljedica trenja između molekula ili začepljenja molekulama ili drugim citoplazmatskim strukturama, što izaziva u vijugav tok difuzije.
Smatralo se da kisik protiče od kapilara naniže, sa konstantnim gradijentom pritiska ka ravni ili cilindru, na pola puta između dvije kapilare, gdje je pritisak kisika minimalan. Taj model cilindra nije u suglasnosti sa današnjim konceptom gradijenta O2 u mišićima. Po suvremenom shvatanju, gradijent pritiska kisika oko kapilara nije konstantan. Visok pritisak opada na zidu kapilara, praćen malim gradijentom kroz sarkoplazmu.
Konstanta brzine disocijacije kisika, zajedno sa difuzijskim koeficijentom, određuje koliko daleko će molekuli mioglobina putovati nasumično, za vrijeme prisustva kisika. Nevjerovatna osobina ovakvog kretanja je da: „čestica koja difundira i koja se nalazi u datom dijelu prostora je određena, luta oko tog dijela izvjesno vrijeme istražujući ga temeljno prije nego što ode zauvijek.“ Ukoliko su difundujuće molekule oksimioglobina pretežno reflektirane od poršinih mitohondrija, posmatrana zapremina će biti između sfernog i diskoidnog oblika. Molekula oksimioglobina će biti premještena dalje u ravni, koja je ograničena površinom mitohondrija, tokom prisustva O2 i bit će ubrzana njegova difuzija.
Uloga citohrom oksidaze
urediSa povećanjem mišićne aktivnosti, smanjuje se koncentracija enzima citohrom oksidaze. Potpuno reducirana, vrlo brzo veže O2 i tako formira kisikov međuproizvod. Ravnoteža u ovom kompleksu je slaba i povratna već na sobnoj temperaturi, ali se nepovratnost može postići brzim transferom elektrona do kisika, za koji se vežu. Konstanta ravnoteže nije nepromjenljiva, već na nju utiču različiti parametri, a linearno je povezana sa fluksom elektrona kroz sistem. Nadmetanje između NO i O2 u vezanju za hemski reakcijski centar – citohrom oksidazu, povećat će vrijednost Km. Brzinu reakcije između citohrom oksidaze i kiseonika može kontrorati sarkoplazmatski pritisak kisika.
Oksimioglobin
urediBudući da djeluje kao skladište bioaktivnih molekula NO, oksimioglobin regulira i korištenja kisika. NO se kontinuirano stvara u miocitima. Oksimioglobin ragira sa NO i formira neškodljiv produkt. Koncentracija NO je određena ravnotežom između ova dva procesa. Zaštitni učinak oksimioglobina na aktivnost citohrom oksidaze je dokazan u eksperimentima, koristeći izolirane ćelije srca, koje su bile pod visokim pritiskom kisika, dovoljnim da unutarćelijski mioglobin oksigenira. Pri ovakvoj raspoloživosti, O2 ne ograničava brzinu disanja, a olakšana difuzija O2 ne doprinosi dodatnom fluksu O2. Progresivno pretvaranje unutarćelijskog mioglobina u CO mioglobin (MbCO) smanjuje potrošnju kisika za trećinu. Sa povećanjem molske frakcije MbCO, količina oksimioglobina se smanjuje linarno.
Genetička regulacija
urediNovorođeni delfini, pingvini i foke imaju manje mioglobina u pokretačkim mišićima nego odrasli. Kako odrastaju i većinu vremena provedu plivajući i roneći, koncentracija mioglobina u njihovim mišićima se povećava. Iako genetička konstitucija ima važnu ulogu u određivanju sadržaju mioglobina u mišićima, razvoj i uslovi sredine kao što su stres, fizička aktivnost, temperatura, raspoloživost O2 imaju također važnu ulogu u određivanju nivoa ovog proteina.
Sintetski analozi
urediSintetizirani su mnogi modeli mioglobina, kao dio širokog interesa za prijelazne komplekse metaliziranih molekula kisika. Dobro poznat je primjer je „ograda“ porfirina, koja se sastoji od obojenih kompleksa sternog glomaznog derivata tetrafenilporfirina. U prisustvu imidazolnog liganda, ovaj obojeni kompleks reverzibilno veže O2. O 2 + supstrat ima savijenu geometriju, zauzimajući šestu poziciju željezovog centra. Ključna osobenost ovog modela je sporo formiranje μ-okso dimera, koji je neaktivan dvostruko feri oblik. U prirodi, kao što su deaktivacijski potisnuti putevi proteinske matrice koja sprečava bliski pristup Fe-porfirinskom kompleksu.[14]
Također pogledajte
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000198125 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000018893 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Borovac I., Ur. (2012): Čovjek - velika ilustrirana enciklopedija. Mozaik knjiga, ISBN 978-953-196-999-4.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger principles of biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1., https://books.google.com/books?id=5Ek9J4p3NfkC&dq=nelson+2000+Lehninger+Principles+of+Biochemistry&q=myoglobin}} (Google books link is the 2008 edition)
- ^ Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ (U.S.) National Science Foundation: Protein Data Bank.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
- ^ McGee H. (2004): On food and cooking: The science and lore of the kitchen. Scribner, New York, 0-684-80001-2.
- ^ http://www.startribune.com/business/11223451.html Arhivirano 25. 12. 2013. na Wayback Machine | title = Meat companies defend use of carbon monoxide, Associated Press, 2007-10-30, Business, Minneapolis Star Tribune.
- ^ Lippard S. J., Berg J. M. (1994): Principles of bioinorganic chemistry. University Science Books, Mill Valley, CA, ISBN 0-935702-73-3.
Vanjski linkovi
uredi- The Myoglobin Protein
- Protein Database featured molecule
- OMIM: 160000 human genetics
- Which Cut Is Older? (It's a Trick Question) New York Times, February 21, 2006 article regarding meat industry use of carbon monoxide to keep meat looking red.
- Stores React to Meat Reports New York Times, March 1, 2006 article on the use of carbon monoxide to make meat appear fresh.
- Mirceta, S.; Signore, A. V.; Burns, J. M.; Cossins, A. R.; Campbell, K. L.; Berenbrink, M. (2013). "Evolution of Mammalian Diving Capacity Traced by Myoglobin Net Surface Charge". Science. 340 (6138): 1234192. doi:10.1126/science.1234192. PMID 23766330.. Also see Proteopedia article about this finding