Luminol
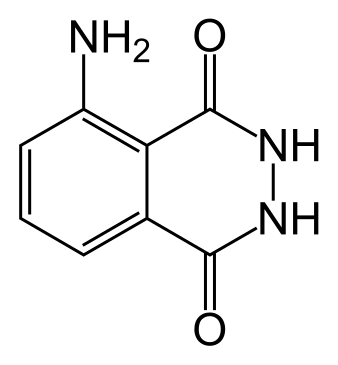
Luminol (C8H7N3O2) je hemijski spoj koji pokazuje luminiscenciju, sa plavim sjajem, kada se pomeša sa odgovarajućim oksidacijskim agensom. Luminol je bijela do blijedo-žuta kristalna čvrsta supstanca koja je rastvorljiva u većini polarnih organskih rastvarača, ali nerastvorljiva u vodi.
Luminol[1]
  | |
|---|---|
| Općenito | |
| Hemijski spoj | Luminol[1]
  |
| Druga imena | = Amino-2,3-dihidroftalazin-1,4-dion, 5-Amino-2,3-dihidro-1,4-ftalazinedion o-Aminoftaloil hidrazid o-Aminoftalil hidrazid 3-Aminoftalhidrazid 3-Aminoftalni hidrazid |
| CAS registarski broj | 521-31-3 |
| SMILES | c1cc2c(c(c1)N)c(=O)[nH] [nH]c2=O |
| InChI | 1/C8H7N3O2/c9-5-3-1-2-4-6(5)8(13)11-10-7(4)12/h1-3H,9H2,(H,10,12)(H,11,13) |
| Osobine1 | |
| Molarna masa | 177,16 g/mol |
| Tačka topljenja | 319 PubChem: 10638 |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Forenzički istražitelji koriste luminol da otkriju količine krvi u tragovima na mjestu zločina, jer reaguje sa gvožđem u hemoglobinu. Biolozi ga koriste u ćelijskim testovima za otkrivanje bakra, gvožđa, cijanida, kao i specifičnih proteina putem Western blottiranja.[2]
Kada se luminol ravnomjerno rasprši po površini, tragovi aktivirajućeg oksidansa čine da luminol emituje plavi sjaj koji se može vidjeti u zamračenoj prostoriji. Sjaj traje samo oko 30 sekundi, ali se može fotografski dokumentovati. Sjaj je jači u područjima koja primaju više spreja; intenzitet sjaja ne ukazuje na količinu krvi ili drugog prisutnog aktivatora.
Sinteza
urediLuminol se sintetiše u procesu od dva koraka, počevši od 3-nitroftalne kiseline.[3][4] Prvo, hidrazin (N2H4) se zagrijava sa 3-nitroftalnom kiselinom u rastvaraču visokog ključanja kao što su trietilen-glikol i glicerol. Dolazi do acilne supstitucijske reakcija kondenzacije, uz gubitak vode, formirajući 3-nitroftalhidrazid. Redukcija nitro grupe u amino grupu sa natrij-ditionitom (Na2S2O4), preko prolaznog hidroksilaminskog intermedijara, proizvodi luminol.
Spoj je prvi put sintetiziran u Njemačkoj 1902,[5] ali nije imenovan kao luminol sve do 1934.[3][6]
Hemiluminescencija
urediDa bi pokazao svoju luminescenciju, luminol mora biti aktiviran oksidansom. Obično je aktivator rastvor koji sadrži vodik-peroksid (H2O2) i hidroksidne ione u vodi. U prisustvu katalizatora kao što su gvožđevi ili periodatni spojevi, vodik-peroksid se razlaže da bi formirao kiseonik i vodu:
- 2 H2O2 → O2 + 2 H2O
- H2O2 + KIO4 → KIO3 + O2 + H2O
Laboratorijske postavke često koriste kalij-fericijanid ili kalij-perjodat kao katalizator. U forenzičkoj detekciji krvi, katalizator je gvožđe prisutno u hemoglobinu.[7] Enzimi u različitim biološkim sistemima također mogu katalizirati razgradnju vodik-peroksida.
Tačan mehanizam hemiluminiscencije luminola je složena reakcija u više koraka, posebno u vodenim uslovima. Nedavno teorijsko istraživanje moglo je razjasniti kaskadu reakcija kao što je prikazano u nastavku.[8] Luminol se prvo deprotonira u baznim uvjetima, a zatim oksidira u anionski radikal. On zauzvrat ima dva dostupna puta za davanje ključnog intermedijara α-hidroksi-peroksida. Nakon ciklizacije do endoperoksida, mono-anion će se podvrgnuti razgradnji bez luminescencije, ako je pH prenizak (< 8,2) za drugu deprotonaciju. Endoperoksidni dianion, međutim, može dati retro-Diels-Alderov proizvod: 1,2-dioksan-3,6-dion dianion. I nakon hemijske ekscitacije pomoću dva jednostruka prijenosa elektrona (SET) daje 3-aminoftalatni dianjon u svom prvom singletnom pobuđenom stanju (S1). Ova vrlo nestabilna molekula se relaksira do osnovnog stanja, čime emituje svjetlost talasne dužine od oko 425 nm (ljubičasto-plava), takozvanu hemiluminiscenciju.
Upotreba u krivičnoj istrazi
urediHistorija
urediGodine 1928., njemački hemičar H. O. Albrecht otkrio je da krv, između ostalih tvari, pojačava luminescenciju luminola u alkalnom rastvoru vodik-peroksida.[9][10] U 1936., Karl Gleu i Karl Pfannstiel potvrdili su ovo poboljšanje u prisustvu hematina, komponente krvi.[11] Zatim je, 1937., njemački forenzičar Walter Specht napravio je opsežne studije o primjeni luminola u otkrivanju krvi na mjestima zločina..[12] Godine 1939. patolozi iz San Francisca, Frederick Proescher i A. M. Moody napravili su tri važna zapažanja o luminolu:[13][14]
- iako je test pretpostavljen, velike površine sumnjivog materijala mogu se brzo ispitati;
- osušena i raspadnuta krv davala je jaču i trajniju reakciju od svježe krvi; i
- ako luminiscencija nestane, može se reproducirati primjenom svježe otopine luminol-vodikovog peroksida; osušene mrlje krvi mogu se tako više puta učiniti luminiscentnim.
Teorija
urediIstražitelji mjesta zločina koriste luminol da pronađu tragove krvi, čak i ako ga je neko očistio ili uklonio. Istraživač prska tragove rastvorom luminola i oksidansa. Gvožđe u krvi katalizuje luminescenciju. Količina katalizatora neophodna za izazivanje reakcije je vrlo mala u odnosu na količinu luminola, što omogućava detekciju čak i tragova krvi. Plavi sjaj traje oko 30 sekundi po aplikaciji. Za otkrivanje sjaja potrebna je prilično mračna prostorija. Svaki otkriveni sjaj može biti dokumentovan dugom ekspozicijom fotografija.
Nedostaci
urediUpotreba luminola u istrazi mjesta zločina donekle je otežana činjenicom da reaguje na spojeve koji sadrže gvožđe i bakar,[15] Primjena luminola na dokazni trag može spriječiti izvođenje drugih testova na njemu; međutim DNK je uspješno ekstrahirana iz uzoraka izloženih luminolu.[16]
Srodne molekule
uredi- Luminol: 5-amino-2,3-dihidro-1,4-ftalazinedion; 3-amino-ftalhidrazid; 1,4-ftalazindion, 5-amino-2,3-dihidro; CAS: [521-31-3]
C8H7N3O2 – MW: 177,16
λabs (u 0,1 N NaOH) λmax 1 : 347 nm & λmax 2 : 300 nm; EC (na λmax 1): 7650 L/mol × cm
λabs / λem (MeOH ): 355/413 nm - Luminol, natrijeva so: natrijev 3-amino-ftalhidrazid; CAS: [20666-12-0]
C8H6N3O2Na – MW: 199.12 - Luminol hemihidrat: hidrat natrij 3-amino-ftalhidrazida; CAS: [206658-90-4]
C8H6N3O2Na hidrat– MW: 217,16 - Luminol hidrohlorid: 3-amino-ftalhidrazid hidrohlorid; CAS: [74165-64-3]
C8H7N3O2 · HCl MW: 213,62 - Izoluminol: 4-aminoftalhidrazid; CAS: [3682-14-1]
C8H7N3O2 – MW: 117,16 (Xi) - Izoluminol monohidrat: 4-aminoftalhidrazid-monohidrat
C8H7N3O2hidrat – MW: 195,15 - Izoluminol ABEI: 4-aminoftalhidrazid monohidrat; CAS: [66612-29-1]
Također pogledajte
urediReference
uredi- ^ Merck Index, 11th Edition, 5470.
- ^ Khan, Parvez; Idrees, Danish; MOxley, Michael A.; et al. (May 2014). "Luminol-Based Chemiluminescent Signals: Clinical and Non-clinical Application and Future Uses". Applied Biochemical Biotechnology. 173 (2): 333–355. doi:10.1007/s12010-014-0850-1. PMC 4426882. PMID 24752935.
- ^ a b Ernest Huntress; Lester Stanley; Almon Parker (1934). "The preparation of 3-aminophthalhydrazide for use in the demonstration of chemiluminescence". Journal of the American Chemical Society. 56 (1): 241–242. doi:10.1021/ja01316a077.
- ^ Synthesis of luminol
- ^ See:
- Aloys Josef Schmitz, "Ueber das Hydrazid der Trimesinsäure und der Hemimellithsäure" Arhivirano 2. 1. 2015. na Wayback Machine (On the hydrazide of trimesic acid [1,3,5-benzenetricarboxylic acid] and of hemimellitic acid [1,2,3-benzenetricarboxylic acid]), Inaugural Dissertation, Heidelberg University, 1902; pp. 17, 39–43. Schmitz calls luminol "1-amino-2,3-phtalsäurehydrazid".
- Note: Gill states that luminol was prepared as early as 1853. See: Steven K. Gill (1983) "New developments in chemiluminescence research," Aldrichimica Acta 16 (3) : 59–61; has footnote 2 on p. 60. Available at: Aldrichimica Acta Arhivirano 8. 1. 2015. na Wayback Machine. However, the sources Gill cites don't mention the preparation of luminol before 1902. Gill probably confused luminol with lophine (2,4,5-triphenyl-1H -imidazole), which the sources he cites do mention. Lophine is also chemiluminescent, and was first prepared in 1844 by Auguste Laurent. (See: Auguste Laurent (1844) "Sur un nouvel alcali organique, la lophine" (On a new organic alkali, lophine), Revue scientifique et industrielle, 18: 272–278.) The chemiluminescence of lophine was first observed by: Radziszewski, Bronisław L. (1877) "Untersuchungen über Hydrobenzamid, Amarin und Lophin" Arhivirano 14. 12. 2015. na Wayback Machine (Investigations of hydrobenzamide, amarine, and lophine), Berichte der Deutschen chemischen Gesellschaft zu Berlin, 10 : 70–75. In 1853, Ludwig Teichmann developed a test for blood, but it did not rely on chemiluminescence. See: L Teichmann (1853) "Ueber die Krystallisation der organischen Bestandtheile des Bluts" (On the crystallization of the organic components of blood), Zeitschrift für rationelle Medicin, new series, 3 : 375–388.
- ^ See also: Ernest H. Huntress, Lester N. Stanley, and Almon S. Parker (March 1934) "The oxidation of 3-aminophthalhydrazide ("luminol") as a lecture demonstration of chemiluminescence," Journal of Chemical Education, 11 (3) : 142–145.
- ^ Ples, Marek. "Chemiluminescence activated by blood". www.weirdscience.eu (jezik: poljski). Arhivirano s originala, 2015-01-03. Pristupljeno 2014-12-23.
- ^ a b Yue, Ling; Liu, Yi-Tong (2020-09-03). "Mechanistic Insight into pH-Dependent Luminol Chemiluminescence in Aqueous Solution". The Journal of Physical Chemistry B. 124 (35): 7682–7693. doi:10.1021/acs.jpcb.0c06301. ISSN 1520-6106. PMID 32790377. S2CID 221125324.
- ^ H. O. Albrecht (1928) "Über die Chemiluminescenz des Aminophthalsäurehydrazids" (On the chemiluminescence of aminophthalic acid hydrazide) Zeitschrift für Physikalische Chemie 136: 321–330.
- ^ Stuart H. James and William G. Eckert, Interpretation of Bloodstain Evidence at Crime Scenes, 2nd ed. (Boca Raton, Florida: CRC Press LLC, 1998), page 154 Arhivirano 15. 2. 2017. na Wayback Machine.
- ^ Gleu, Karl ; Pfannstiel, Karl (1936) "Über 3-aminophthalsaure-hydrazid" Journal für Praktische Chemie 146: 137–150.
- ^ Specht, Walter (1937) "Die Chemiluminescenz des Hämins, ein Hilfsmittel zur Auffindung und Erkennung forensisch wichtiger Blutspuren" (The chemiluminescence of haemin, an aid to the finding and recognition of forensically significant blood traces), Angewandte Chemie 50 (8): 155–157.
- ^ Proescher F. and Moody A.M. (1939) "Detection of blood by means of chemiluminescence," Journal of Laboratory and Clinical Medicine, 24 : 1183–1189.
- ^ James, Stuart; Kish, Paul E.; Sutton, Paulette Sutton (2005). Principles of Bloodstsain Pattern Analysis. Boca Raton, London, New York, Singapore: Taylor and Francis Group. str. 376. ISBN 0-8493-2014-3.
- ^ Ples, Marek. "Chemiluminescence of luminol activated by copper compound". www.weirdscience.eu (jezik: poljski). Arhivirano s originala, 2015-01-03. Pristupljeno 2014-12-23.
- ^ Technical note about Hemaglow Arhivirano 2. 1. 2015. na Wayback Machine