Fosfor-pentasulfid
Ovom članku potrebna je jezička standardizacija, preuređivanje ili reorganizacija. |
Fosfor-pentasulfid ili fosfor-dekasulfid je anorganski spoj s formulom P4S10. Ova žuta čvrtta supstanca je jedan od dva fosfor-sulfida koji imaju komercijalnu vrijednost. Uzorci se često pojavljuju i u zelenkasto-sivoj boji, zbog nečistoća.
| Fosfor-pentasulfid | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Fosfor-pentasulfid |
| Druga imena | Fosfor-sulfid Sumpor-sulfid Fosfor-persulfid Difosfor-pentasulfid Tetrafosfor-dekasulfid Fosfor dekasulfid |
| Molekularna formula | P4S10 |
| CAS registarski broj | 1314-80-3 |
| Kratki opis | Zeleno-siva čvrsta supstanca, sa mirison na truhla jaja |
| Osobine1 | |
| Molarna masa | 444,555 g/mol |
| Agregatno stanje | Čvrsto |
| Gustoća | 2,09 g/cm3 |
| Tačka topljenja | 288 |
| Tačka ključanja | 514 |
| Pritisak pare | 1 mmHg (300°C) |
| Rastvorljivost | Hidrolizira; 0,222 g/100g CS2 (na 17 °C) Nerastvorljiv u C6H6, vrelom ksilenu i vrelom anisolu |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Struktura i sinteza
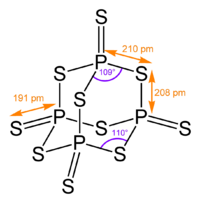
urediNjegova tetraedarska molekulska struktura je slična onoj kod adamantana i gotovo je identična strukturi fosfor-pentoksida [1]
Fosfor-pentasulfid se dobija reakcijom tekućeg bijelog fosfora (P4) sa sumporom, iznad 300 °C. Prvi sintezu P4S10 je izveo Berzelius u 1843. [2][3] Alternativno, P4S10 može se dobiti reakcijom elementarnog sumpora ili pirita, FeS2, s fero-fosforom , sirovim oblikom Fe2 P (nusprodukt P4 proizvodnjom od fosfatne stijene):
- 4 Fe2 P + 18 S → P4S10 + 8 FeS
- 4 Fe2 P + 18 FeS2 + zagrijavanje → P4S10 + 26 FeS
Primjena
urediGodišnje se proizvede oko 150.000 tona P4S10. Spoj se uglavnom prevodi u druge derivate za upotrebu kao aditiva za podmazivanje, npr. cink-ditiofosfata. Također se koristi i u proizvodnji pesticida, kao što su paration i malation [4] To je također sastavni dio nekih amorfnih čvrstih elektrolita (npr. litij2SP2S5) za neke vrste litijskih baterija.
Fosfor-pentasulfid je dvostruko upotrebljiv materijal za proizvodnju raznih insekticida. kao što je Amiton i za proizvodnju povezanog VX nervnih agenasa.
Reaktivnost
urediZbog hidrolize atmosferskom vlagom, P4S10 razvija se H 2S, čime P4S10 povezan s mirisom truhlih jaja. Osim H2S, hidrolizom P4S10 daje fosfornu kiselinu:
- P4S10 + 16 H2O → 4 H3PO4 + 10 H2S
Ostali blagi nukleofili reagiraju s P4S10, uključujući i alkohole i amine. Aromatski spojevi kao što su anisol, ferocen i 1-metoksi naftalen reagiraju kako bi se dobili 1,3,2,4-ditia-2,4-disulfidii, kao što je Lawessonov reagens.
U organskoj hemiji, P4S10 koristi se kao reagens tioniranja. Reakcije ovog tipa zahtijevaju zagrijavanje uz refluksna otapala, kao što su benzen, dioksan ili acetonitril, uz didocijaciju P4S10 u P2S +5. P2S5 može biti zarobljen, na primjer kao u kompleksu piridina. Ketoni se pretvaraju u tioketone. Esterski, imidni i laktonski atomi kisika mogu biti zamijenjeni sumporom. Sa amidima, produkt reakcije je tioamid. Sa 1,4-diketonskim reagens tvori tiofen. U odnosu na poznatiji Lawessonov reagens, P4S10 podložan je smanjenju iskorištenja. [5]
Reference
uredi- ^ Corbridge, D. E. C. (1995). Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology (5th izd.). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- ^ Berzelius, J. (1843). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. 46 (2): 129–154. doi:10.1002/jlac.18430460202.
- ^ Berzelius, J. (1843). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. 46 (3): 251–281. doi:10.1002/jlac.18430460303. (continuation of p. 154 of the same volume)
- ^ Bettermann, G.; Krause, W.; Riess, G.; Hofmann, T. (2002). "Phosphorus Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_527.
- ^ Ozturk, T.; Ertas, E.; Mert, O. (2010). "A Berzelius Reagent, Phosphorus Decasulfide (P4S10), in Organic Syntheses". Chemical Reviews. 110 (6): 3419–3478. doi:10.1021/cr900243d. PMID 20429553.
