Amin (hemija)
Amini obuhvataju grupu organskih spojeva koji u molekulama sadrže najmanje jednu ili više baznih dušikovih atoma. Amini se smatraju izvedenicama amonijaka, a i strukturno su mu sliči. Jedan ili više vodikovih atoma u njima je zamijenjen jednom ili više alkilnih ili arilnih organskih grupa. Najznačajniji amini su: aminokiseline, trimetilamini, i anilini. Neorganski derivati amonijaka se također označavaju kao amini (hloramin (NClH2 i dr.).
Aminima su slični amidi, ali oni su izvedenice karboksilnih kiselina i imaju karbonilnu grupu koja je vezana na amino grupu, kao naprimjer: RC(O)NR2. Amidi i amini imaju različitu strukturu i svojstva, zbog čega je razlikovanje pojmova u nazivima veoma važno.[1][2][3][4][5]
Alifatski amini
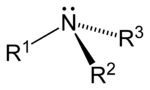
urediPrema broju ugljikovodikovih veza koje su vezane za dušikov atom, umjesto vodika, razlikuju se tri vrste amina: primarni, sekundarni i tercijarni. Slovom R se označava organska (ugljikovodikova) grupa.
| Primarni amin | Sekundarni amin | Tercijarni amin |
|---|---|---|
 |
 |
 |
Aromatski amini
urediAromatski amini na dušičnom atomu imaju vezan aromatski prsten, a obično se zovu anilini, čiji je primjer fenilamin.
U industrijskoj sintezi boja, anilin i njegovi derivati su polazni hemijski spojevi.
Aromatski prsten snižava bazna svojstva amina, ovisno o zamjeni, a prisustvo amino grupe povećava reaktivnost aromatskog prstena, zbog donor elektrona.
Jedna od reakcija aromatskog prstena je Goldbergova reakcija.
Nomenklatura amina
uredi- prefiks N označava supstituciju na atomu dušika (npr.: N,N-dimetiletilamin)
- kao prefiks: "amino-"
- kao sufiks: "-amin"
Kod nižih amina koristi se sufiks –amin, a kod viših: prefiks amino–.
- Primarni amini:
- Metilamin
- Etanolamin ili 2-aminoetanol
- Sekundarni amini:
- Dimetilamin
- Metiletanolamin ili 2-(metilamino)etanol
- Tercijarni amini:
- Trimetilamin
- Dimetiletanolamin ili 2-(dimetilamin)etanol
Fizička svojstva
uredi- Na svojstva amina, značajno utječe njihova vodikova veza, zbog toga im je tačka ključanja viša nego u sličnih alkana, a niža od sličnih alkohola. Zbog veće elektronegativnosti kisika od dušika, amini su više bazni od alkohola i alkala koji su time kiseliji.
- Amini manjih relativnih molekulskih masa (metil–, dimetil–, trimetil– i etilamin), na sobnoj temperaturi su u gasovitom stanju. Amini veće molekulske mase su tečnosti ili čvrste materije (dietilamin ili trietilamin).
- Gasoviti amini imaju neugodan miris, sličan amonijaku, dok tečni imaju miris pokvarene ribe.
- Amini s manjim brojem ugljikovih atoma su dobro rastvorljivi u vodi, stvarajući vodikove veze, a rastvorljivost se smanjuje s povećanjem njihove molekulske mase, odnosno hidrofobnog dijela molekula.
- Alifatski amini dobro su topivi u organskim rastvaračima, posebno s polarnim. Primarni amini reagiraju sa ketonima kao što je aceton.
Neki od amina
urediAlkaloidi
urediAlkaloidi su prirodni amini, osobito u biljnom svijetu. Pretežno nastaju od aminokiselina. Znatan broj alkaloida je otrovan i gorak, s vrlo jakim farmakološkim djelovanjem.
Primjeri alkaloida:
- Kofein – nalazi se u kahvi, čaju, bezalkoholnim pićima; smrtonosna doza kofeina je 10 grama;
- Nikotina ima u lišću duhana, a smrtna doza u krvotoku mu je 500 miligrama;
- Morfin se nalazi u opijumu, osušenom soku iz maka.
Triptamini
urediTriptamini su alkaloidni monoamini. Stvaraju se oko indolnog prstena, a odgovaraju aminokiselini triptofan.
Neki su aktivni kao neurotransmiteri, a neki kao halucinogeni (psihoaktivne droge, psihodelične droge)
Primjeri triptamina:
Ostale vrste triptamina su u porodici (TiHKAL).
Feniletilamini
urediFeniletilamini su alkaloidni monoamini. Odgovaraju aminokiselini fenilalaninu. Supstituirani feniletilamini su spojevi sa mnoštvom funkcija: neurotransmiteri, hormoni, stimulansi, halucinogeni, antidepresivi. Primjeri feniletilamina su:
Ostali feniletilamini su klasificirani u familiju (PiHKAL).
Sinteza
urediAlkilacija
urediVećina industrijski značajnih amina se pripremaju iz amonijaka, putem alkilacije sa alkoholima:
- ROH + NH3 → RNH2 + H2O
Te reakcije zahtijevaju katalizatore, specijalizirane aparate i dodatne mjere za pročišćavanje, pa selektivnost može biti problematična. I amini se isto može pripremiti tretmanom haloalkana sa amonijakom i aminima:
- RX + 2 R′NH2 → RR′NH + [RR′NH2]X
Takve reakcije, koje su najprikladnije za alkil iodide i bromide, rijetko se primjenjuju, zbog toga što je teško kontrolisati stepen alkilacije.[6] Selektivnost može biti dokazana preko delepinske reakcije, iako se to rijetko primjenjuje na industrijskom nivou.
Redukcijski putevi
urediPreko procesa hidrogenacije, nitrili se svode na amine, pomoću vodika u prisustvu niklalskog katalizatora. Reakcije su osjetljive na kisele ili alkalne uslove, što može dovesti do hidrolize -CN grupe. LiAlH4 se češće koriste za redukciju nitrila u laboratorijskoj primjeni. Slično tome, LiAlH4 reducira amide u amine. Mnogi amini se proizvode od aldehida i ketona redukcijskom aminacijom, sa nastavkom koji može biti katalitski ili stoihiometrijski. LiAlH44 reducira amide do amina.
Anilin (C6H5NH2) i njegovi derivativi se dobijaju redukcijom nitroaromatičnih spojeva. U industriji, kao reducent više se koristi vodik, dok se u laboratorijama češće koriste kalaj i željezo.
Specijalizirani postupci
urediDanas postoje mnoge laboratorijske metode za dobijanje amina, od kojih su mnogi dosta specijalizirani.
Također pogledajte
urediReference
uredi- ^ Harrison L. G. (2011): The shaping of life: The generation of biological pattern. Cambridge University Press, ISBN 978-0-521-55350-6; http://books.google.com/books?id=-IPG-vg7Pr8C.
- ^ Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ Alberts B. (2002)ː Molecular biology of the cell. Garland Science, New York, ISBN 0-8153-3218-1.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a02_001. ISBN 3527306730.
- ^ Weiberth, Franz J.; Hall, Stan S. (1986). "Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines". Journal of Organic Chemistry. 51 (26): 5338–5341. doi:10.1021/jo00376a053.
Vanjski linkovi
uredi- [1] Arhivirano 29. 3. 2016. na Wayback Machine