Mišićna atrofija
Mišićna atrofija je gubitak skeletno mišićne mase. Može biti uzrokovana nepokretnošću, starenjem, pothranjenošću, lijekovima ili širokim spektrom ozljeda ili bolesti koje utiču na mišićno-koštani ili nervni sistem. Atrofija mišića dovodi do slabosti mišića i uzrokuje invalidnost.
| Mišićna atrofija | |
|---|---|
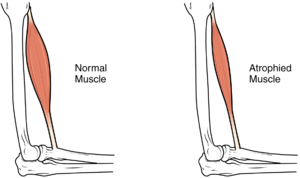 | |
| Smanjuje se veličina mišića, kao posljedica toga dolazi do gubitka snage i pokretljivosti. | |
| Specijalnost | Fizioterapija i rehabilitacija |
| Simptomi | Preovlađujući simptom je pojačana slabost, poteškoće ili nemogućnost obavljanja fizičkih zadataka, u stajanju iz sjedećeg položaja, hodanju ili penjanju uz stepenice i može uzrokovati povećanu učestalost padova. Atrofija mišića grla može uzrokovati poteškoće pri gutanju, a atrofija dijafragme može uzrokovati otežano disanje. |
| Uobičajeno pojavljivanje | Bilo koja dob |
| Uzroci | Mnoge bolesti i stanja mogu dovesti do ove neravnoteže, bilo kroz samu bolest ili kroz promjene apetita povezane s bolešću. Uzroci atrofija mišića, uključuju nepokretnost, starenje, pothranjenost, određene sistemske bolesti (kancer, kongestivna srčana insuficijencija, hronična opstruktivna bolest pluća; AIDS, bolest jetre, itd.), deinervacija, unutrašnja bolest mišića ili lijekovi (kao što su glukokortikoidi); neravnoteže između normalne usklađenosti između sinteze i razgradnje proteina. Ovo uključuje složenu ćelijsku signalizaciju |
| Faktori rizika | Nepokretljivost, dugotrajno ležanje |
| Prognoza | Uz liječenje, normalan život |
Nekorištenje uzrokuje brzu atrofiju mišića i često se javlja tokom ozljede ili bolesti koja zahtijeva imobilizaciju ekstremiteta ili mirovanje u krevetu. Ovisno o trajanju neupotrebe i zdravstvenom stanju pojedinca, ovo se može potpuno poništiti aktivnošću. Pothranjenost prvo uzrokuje gubitak masti, ali u dugotrajnom gladovanju može napredovati do atrofije mišića i može se poništiti nutritivnom terapijom. Nasuprot tome, kaheksija je sindrom iscrpljivanja, uzrokovan osnovnom bolešću kao što je rak koji uzrokuje dramatičnu atrofiju mišića i ne može se potpuno poništiti nutritivnom terapijom. Sarkopenija je mišićna atrofija povezana sa starenjem i može se usporiti vježbanjem. Konačno, bolesti mišića kao što su mišićna distrofija ili miopatija mogu uzrokovati atrofiju, kao i oštećenje nervnog sistema, kao što je povreda kičmene moždine ili moždani udar. Stoga je mišićna atrofija obično nalaz (znak ili simptom) u bolesti, a ne bolest sama po sebi. Međutim, neki sindromi mišićne atrofije su klasifikovani kao spektri bolesti ili entiteti bolesti, a ne samo kao klinički sindromi, kao što su različite spinalne mišićne atrofije.
Mišićna atrofija je posljedica neravnoteže između sinteze i degradacije proteina, iako su mehanizmi nepotpuno shvaćeni i variraju ovisno o uzroku. Gubitak mišića može se kvantificirati naprednim slikovnim studijama, ali se to ne provodi često. Liječenje ovisi o osnovnom uzroku, ali često uključuje vježbanje i adekvatnu prehranu. Anabolički agensi mogu imati određenu efikasnost, ali se ne koriste često zbog nuspojava. Istražuje se više tretmana i suplemenata, ali još uvijek postoje ograničene mogućnosti liječenja u kliničkoj praksi. S obzirom na implikacije atrofije mišića i ograničene mogućnosti liječenja, minimiziranje nepokretnosti je kritično kod ozljeda ili bolesti.
Znakovi i simptomi
urediGlavni znak atrofije mišića je gubitak čiste mišićne mase. Ovu promjenu može biti teško otkriti zbog gojaznosti, promjena u masnoj masi ili edema. Promjene u težini, udovima ili obimu struka nisu pouzdani pokazatelji promjena mišićne mase.[1]
Preovlađujući simptom je pojačana slabost koja može rezultirati poteškoćama ili nemogućnošću obavljanja fizičkih zadataka, ovisno o tome koji su mišići zahvaćeni. Atrofija mišića jezgra ili nogu može uzrokovati poteškoće u stajanju iz sjedećeg položaja, hodanju ili penjanju uz stepenice i može uzrokovati povećanu učestalost padova. Atrofija mišića grla može uzrokovati poteškoće pri gutanju, a atrofija dijafragme može uzrokovati otežano disanje. Mišićna atrofija može biti asimptomska i može proći neotkrivena sve dok se ne izgubi značajna količina mišića.[2]
Uzroci
urediSkeletni mišići služe kao mjesto skladištenja aminokiselina koje se mogu koristiti za proizvodnju energije, kada su zahtjevi visoki ili zalihe niske. Ako metabolički zahtjevi ostanu veći od sinteze proteina, mišićna masa se gubi.[3][4]
Nepokretljivost
urediNekorištenje je čest uzrok atrofije mišića i može biti lokalni (zbog ozljede ili gipsa) ili opći (usmjeravanje u krevetu). Stopa atrofije mišića nakon neupotrebe (10–42 dana) je otprilike 0,5–0,6% ukupne mišićne mase dnevno, iako postoje značajne varijacije među ljudima.[5] Starije osobe su najosjetljivije na dramatičan gubitak mišića s nepokretnošću. Većina utvrđenih istraživanja istraživala je produženu neupotrebu (>10 dana), u kojoj je mišić ugrožen prvenstveno padom u stopi sinteze mišićnih proteina, a ne promjenama u razgradnji mišićnih proteina. Postoje dokazi koji ukazuju na to da može doći do aktivnijeg razlaganja proteina tokom kratkotrajne nepokretnosti (<10 dana).[5]
Kaheksija
urediOdređene bolesti mogu uzrokovati složeni sindrom gubitka mišića poznat kao kaheksija. Često se viđa kod karcinoma, kongestivne srčane insuficijencije, kronične opstruktivne bolesti pluća, kronične bolesti bubrega i AIDS iako je povezan s mnogim procesima bolesti, obično sa značajnim inflamatorna komponenta. Kaheksija uzrokuje kontinuirani gubitak mišića koji nije u potpunosti poništen nutritivnom terapijom.[6] Patofiziološki profil nije u potpunosti shvaćen, ali se smatra da upalni citokini imaju centralnu ulogu. Za razliku od gubitka težine zbog neadekvatnog unosa kalorija, kaheksija uzrokuje pretežno gubitak mišića umjesto gubitka masti i ne reagira tako na nutritivne intervencije. Kaheksija može značajno ugroziti kvalitet života i funkcionalni status i povezana je s lošim ishodima.[7][8]
Sarkopenija
urediSarkopenija je degenerativni gubitak skeletne mišićne mase, kvaliteta i snage, povezan sa starenjem. To uključuje atrofiju mišića, smanjenje broja mišićnih vlakana i pomak ka "sporom trzaju" ili vlakna skeletnih mišića tipa I preko "brzih trzaja" ili vlakana tipa II.[3] Brzina gubitka mišića ovisi o nivou vježbanja, pratećim bolestima, ishrani i drugim faktorima. Postoji mnogo predloženih mehanizama sarkopenije i smatra se da su posljedica promjena u signalnim putevima mišićne sinteze i postepenog neuspjeha u satelitskim ćelijama koje pomažu u regeneraciji vlakana skeletnih mišića, ali je nepotpuno shvaćen.
Sarkopenija može dovesti do smanjenja funkcionalnog statusa i uzrokovati značajnu invalidnost, ali je različito stanje od kaheksije, iako mogu postojati istovremeno.[8][9] Godine 2016. objavljena je ICD kod za sarkopeniju, što je doprinijelo njenom prihvatanju kao entiteta bolesti.[10]
Unutrašnje bolesti mišića
urediBolesti mišića, kao što su mišićna distrofija, amiotrofna lateralna skleroza (ALS) ili miozitis kao miozitis inkluzijskog tijela mogu uzrokovati atrofiju mišića.[11]
Oštećenje centralnog nervnog sistema
urediOštećenje neurona u mozgu ili kičmenoj moždini može uzrokovati izraženu atrofiju mišića. To može biti lokalizirana atrofija mišića i slabost ili paraliza kao što je moždani udar ili povreda kičmene moždine.[12] Raširenija oštećenja kao što su traumatska ozljeda mozga ili cerebralna paraliza mogu uzrokovati generaliziranu atrofiju mišića.[13]
Oštećenje perifernog nervnog sistema
urediPovrede ili bolesti perifernih nerava koji opskrbljuju određene mišiće također mogu uzrokovati mišićnu atrofiju. Ovo se vidi kod ozljede živca uslijed traume ili hirurških komplikacija, uklještenja živaca ili nasljednih bolesti kao što je Charcot–Marie–Toothova bolest.[14]
Lijekovi
urediPoznato je da neki lijekovi uzrokuju atrofiju mišića, obično zbog direktnog djelovanja na mišiće. Ovo uključuje glukokortikoide, koji uzrokuju glukokortikoidnu miopatiju ili lijekove toksične za mišiće kao što je doksorubicin.[15]
Endokrinopatije
urediPoznato je da poremećaji endokrinog sistema kao što su Cushingova bolest ili hipotireoza uzrokuju atrofiju mišića.[16]
Patofiziologija
urediMišićna atrofija nastaje zbog neravnoteže između normalne usklađenosti između sinteze i razgradnje proteina. Ovo uključuje složenu ćelijsku signalizaciju koja nije u potpunosti shvaćena i atrofija mišića je vjerovatno posljedica višestrukih mehanizama koji doprinose.
Mitohondrijska funkcija je ključna za zdravlje skeletnih mišića i štetne promjene na nivou mitohondrija mogu doprinijeti atrofiji mišića.[17] Smanjenje gustine mitohondrija kao i njihovog kvaliteta stalno se viđa kod atrofije mišića zbog neupotrebe.[17]
ATP-zavisni ubikvitin/proteasomski put je jedan mehanizam kojim se proteini razgrađuju u mišićima. Ovo uključuje specifične proteine koji su označeni za uništavanje malim peptidom zvanim ubikvitin koji omogućava prepoznavanje proteasoma da razgradi protein.[18]
Dijagnoza
urediSkrining za atrofiju mišića ograničen je nedostatkom utvrđenih dijagnostičkih kriterija, iako su mnogi predloženi. Mogu se koristiti dijagnostički kriteriji za druga stanja, kao što su sarkopenija ili kaheksija.[3] Ovi sindromi mogu se identifikovati i skrining upitnicima.
Mišićna masa i promjene mogu se kvantificirati na studijama snimanja kao što su CT snimanja ili magnetna rezonanca (MRI). Biomarkeri, kao što je urinska urea mogu se koristiti za grubu procjenu gubitka mišića u okolnostima brzog gubitka mišića.[19] Ostali biomarkeri se još istražuju, ali se ne koriste u kliničkoj praksi.[3]
Tretman
urediAtrofija mišića može se odgoditi, spriječiti i ponekad poništiti liječenjem. Pristupi liječenju uključuju uticaj na signalne puteve koji izazivaju hipertrofiju mišića ili spor razgradnju mišića, kao i optimiziranje nutritivnog statusa.
Fizička aktivnost pruža značajan anabolički stimulans mišića i ključna je komponenta za usporavanje ili preokretanje mišićne atrofije.[3] Još uvijek nije poznato idealno "doziranje" vježbe. Pokazalo se da je vježba s otporom korisna u smanjenju atrofije mišića kod starijih osoba.[20][21] Kod pacijenata koji ne mogu vježbati zbog fizičkih ograničenja kao što je paraplegija, funkcionalna električna stimulacija može se koristiti za vanjsku stimulaciju mišića.[22]
Adekvatne kalorije i proteini su ključni za sprječavanje atrofije mišića. Potrebe za proteinima mogu dramatično varirati u zavisnosti od metaboličkih faktora i stanja bolesti, tako da suplementacija sa visokim sadržajem proteina može biti korisna.[3] Suplementacija proteinima ili aminokiselinama razgranatog lanca, posebno leucinom, može pružiti stimulans za mišićnu sintezu i inhibirati razgradnju proteina, a proučavan je na atrofiju mišića za sarkopeniju i kaheksiju.[3][23] β-Hidroksi β-metilbutirat (HMB), metabolit leucin akoji se prodaje kao dodatak ishrani, pokazao je efikasnost u prevenciji gubitka mišićne mase u nekoliko stanja gubitka mišića u ljudi, posebno sarkopenije.[23][24][25] Na osnovu meta-analiza od sedam randomiziranih kontroliranih studija, objavljenih 2015. godine, suplementacija HMB-om je djelotvorna kao tretman za očuvanje čiste mišićne mase kod starijih osoba.[26] Potrebno je više istraživanja kako bi se utvrdili precizni učinci HMB na snagu i funkciju mišića u različitim populacijama.[26]
U teškim slučajevima mišićne atrofije, upotreba anaboličkog steroida, kao što je metandrostenolon, može se primijeniti kod pacijenata kao potencijalni tretman iako je upotreba ograničena nuspojavama. Nova klasa lijekova, nazvana selektivni modulatori androgenog receptora, istražuje se s obećavajućim rezultatima. Imali bi manje nuspojava, dok bi i dalje promovirali rast i regeneraciju mišićnog i koštanog tkiva. Ovi efekti tek treba da budu potvrđeni u većim kliničkim ispitivanjima.[27]
Ishodi
urediIshodi mišićne atrofije zavise od osnovnog uzroka i zdravlja pacijenta. Nepokretnost ili mirovanje u krevetu u populacijama predisponiranim na atrofiju mišića, kao što su starije osobe ili oni s bolesnim stanjima koja obično uzrokuju kaheksiju, mogu uzrokovati dramatičnu atrofiju mišića i uticati na funkcionalne ishode. Kod starijih osoba to često dovodi do smanjene biološke rezerve i povećane osjetljivosti na stresore poznate kao "sindrom krhkosti".[3] Gubitak nemasne tjelesne mase također je povezan s povećanim rizikom od nastanka bolesti, Infekcija, smanjenja imunosti i slabim zacjeljivanjem rana. Slabost koja prati atrofiju mišića dovodi do većeg rizika od padova, prijeloma, tjelesne invalidnosti, potrebe za institucionalnom njegom, smanjenog kvaliteta života, povećanja mortaliteta i povećanja troškova zdravstvene zaštite.[3]
Ostale životinje
urediNeaktivnost i gladovanje kod sisara dovode do atrofije skeletnih mišića, praćene manjim brojem i veličinom mišićnih ćelija kao i manjim sadržajem proteina.[28] Poznato je da kod ljudi produženi periodi imobilizacije, kao u slučaju odmora u krevetu ili astronauta koji lete u svemir, dovode do slabljenja mišića i atrofije. Takve posljedice su također zabilježene kod malih sisara koji hiberniraju kao što su vjeverica sa zlatnim plaštom i smeđi šišmiši.[29]
Medvjedi su izuzetak od ovog pravila; vrste iz porodice Ursidae poznate su po svojoj sposobnosti da prežive nepovoljne uslove životne sredine niskih temperatura i ograničene dostupnosti ishrane tokom zime putem hibernacije. Za to vrijeme medvjedi prolaze kroz niz fizioloških, morfoloških i bihevioralnih promjena.[30] Njihova sposobnost da održe broj i veličinu skeletnih mišića tokom neupotrebe je od velike važnosti.
Tokom hibernacije, medvjedi provode 4–7 mjeseci neaktivnosti i anoreksije bez atrofije mišića i gubitka proteina.[29] Nekoliko poznatih faktora doprinosi održavanju mišićnog tkiva. Tokom ljeta, medvjedi iskorištavaju dostupnost ishrane i akumuliraju mišićne proteine. Ravnoteža proteina u vrijeme mirovanja također se održava nižim nivoom razgradnje proteina tokom zime.[29] U vrijeme nepokretnosti, gubitak mišića kod medvjeda također je potisnut proteolitskim inhibitorom koji se oslobađa u cirkulaciji .[28] Još jedan faktor koji doprinosi održavanju mišićne snage kod medvjeda koji hiberniraju je pojava periodičnih voljnih i nevoljnih kontrakcija od drhtanja tokom uspavanosti.[31] Tri do četiri dnevne epizode mišićne aktivnosti odgovorne su za održavanje mišićne snage i odgovora kod medvjeda tokom hibernacije.[31]
Također pogledajte
urediReference
uredi- ^ Dev R (januar 2019). "Measuring cachexia-diagnostic criteria". Annals of Palliative Medicine. 8 (1): 24–32. doi:10.21037/apm.2018.08.07. PMID 30525765.
- ^ Cretoiu SM, Zugravu CA (2018). Xiao J (ured.). "Nutritional Considerations in Preventing Muscle Atrophy". Advances in Experimental Medicine and Biology. Springer Singapore. 1088: 497–528. doi:10.1007/978-981-13-1435-3_23. ISBN 9789811314346. PMID 30390267.
- ^ a b c d e f g h i Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (septembar 2016). "Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease". Journal of the American Medical Directors Association. 17 (9): 789–96. doi:10.1016/j.jamda.2016.04.019. PMID 27324808.
- ^ Seene T (juli 1994). "Turnover of skeletal muscle contractile proteins in glucocorticoid myopathy". The Journal of Steroid Biochemistry and Molecular Biology. 50 (1–2): 1–4. doi:10.1016/0960-0760(94)90165-1. PMID 8049126. S2CID 27814895.
- ^ a b Wall BT, Dirks ML, van Loon LJ (septembar 2013). "Skeletal muscle atrophy during short-term disuse: implications for age-related sarcopenia". Ageing Research Reviews. 12 (4): 898–906. doi:10.1016/j.arr.2013.07.003. PMID 23948422. S2CID 30149063.
- ^ Evans WJ, Morley JE, Argilés J, Bales C, Baracos V, Guttridge D, et al. (decembar 2008). "Cachexia: a new definition". Clinical Nutrition. 27 (6): 793–9. doi:10.1016/j.clnu.2008.06.013. PMID 18718696.
- ^ Morley JE, Thomas DR, Wilson MM (april 2006). "Cachexia: pathophysiology and clinical relevance". The American Journal of Clinical Nutrition. 83 (4): 735–43. doi:10.1093/ajcn/83.4.735. PMID 16600922.
- ^ a b Peterson SJ, Mozer M (februar 2017). "Differentiating Sarcopenia and Cachexia Among Patients With Cancer". Nutrition in Clinical Practice. 32 (1): 30–39. doi:10.1177/0884533616680354. PMID 28124947. S2CID 206555460.
- ^ Marcell TJ (oktobar 2003). "Sarcopenia: causes, consequences, and preventions". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 58 (10): M911-6. doi:10.1093/gerona/58.10.m911. PMID 14570858.
- ^ Anker SD, Morley JE, von Haehling S (decembar 2016). "Welcome to the ICD-10 code for sarcopenia". Journal of Cachexia, Sarcopenia and Muscle. 7 (5): 512–514. doi:10.1002/jcsm.12147. PMC 5114626. PMID 27891296.
- ^ Powers SK, Lynch GS, Murphy KT, Reid MB, Zijdewind I (novembar 2016). "Disease-Induced Skeletal Muscle Atrophy and Fatigue". Medicine and Science in Sports and Exercise. 48 (11): 2307–2319. doi:10.1249/MSS.0000000000000975. PMC 5069191. PMID 27128663.
- ^ O'Brien LC, Gorgey AS (oktobar 2016). "Skeletal muscle mitochondrial health and spinal cord injury". World Journal of Orthopedics. 7 (10): 628–637. doi:10.5312/wjo.v7.i10.628. PMC 5065669. PMID 27795944.
- ^ Verschuren O, Smorenburg AR, Luiking Y, Bell K, Barber L, Peterson MD (juni 2018). "Determinants of muscle preservation in individuals with cerebral palsy across the lifespan: a narrative review of the literature". Journal of Cachexia, Sarcopenia and Muscle. 9 (3): 453–464. doi:10.1002/jcsm.12287. PMC 5989853. PMID 29392922.
- ^ Wong A, Pomerantz JH (mart 2019). "The Role of Muscle Stem Cells in Regeneration and Recovery after Denervation: A Review". Plastic and Reconstructive Surgery. 143 (3): 779–788. doi:10.1097/PRS.0000000000005370. PMID 30817650. S2CID 73495244.
- ^ Hiensch AE, Bolam KA, Mijwel S, Jeneson JA, Huitema AD, Kranenburg O, et al. (oktobar 2019). "Doxorubicin-induced skeletal muscle atrophy: elucidating the underlying molecular pathways". Acta Physiologica. 229 (2): e13400. doi:10.1111/apha.13400. PMC 7317437. PMID 31600860.
- ^ Martín AI, Priego T, López-Calderón A (2018). Xiao J (ured.). "Hormones and Muscle Atrophy". Advances in Experimental Medicine and Biology. Springer Singapore. 1088: 207–233. doi:10.1007/978-981-13-1435-3_9. ISBN 9789811314346. PMID 30390253.
- ^ a b Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C (20. 5. 2019). "Mitochondrial Dysfunction in Skeletal Muscle Pathologies". Current Protein & Peptide Science. 20 (6): 536–546. doi:10.2174/1389203720666190402100902. PMID 30947668.
- ^ Sandri M (juni 2008). "Signaling in muscle atrophy and hypertrophy". Physiology. Bethesda, Md. 23 (3): 160–70. doi:10.1152/physiol.00041.2007. PMID 18556469.
- ^ Bishop J, Briony T (2007). "Section 1.9.2". Manual of Dietetic Practice. Wiley-Blackwell. str. 76. ISBN 978-1-4051-3525-2.
- ^ Sayer AA (novembar 2014). "Sarcopenia the new geriatric giant: time to translate research findings into clinical practice". Age and Ageing. 43 (6): 736–7. doi:10.1093/ageing/afu118. PMID 25227204.
- ^ Liu CJ, Latham NK (juli 2009). "Progressive resistance strength training for improving physical function in older adults". The Cochrane Database of Systematic Reviews (3): CD002759. doi:10.1002/14651858.CD002759.pub2. PMC 4324332. PMID 19588334.
- ^ Zhang D, Guan TH, Widjaja F, Ang WT (23. 4. 2007). Functional electrical stimulation in rehabilitation engineering: A survey. Proceedings of the 1st international convention on Rehabilitation engineering & assistive technology: in conjunction with 1st Tan Tock Seng Hospital Neurorehabilitation Meeting. Association for Computer Machinery. str. 221–226. doi:10.1145/1328491.1328546. ISBN 978-1-59593-852-7.
- ^ a b Phillips SM (juli 2015). "Nutritional supplements in support of resistance exercise to counter age-related sarcopenia". Advances in Nutrition. 6 (4): 452–60. doi:10.3945/an.115.008367. PMC 4496741. PMID 26178029.
- ^ Brioche T, Pagano AF, Py G, Chopard A (august 2016). "Muscle wasting and aging: Experimental models, fatty infiltrations, and prevention" (PDF). Molecular Aspects of Medicine. 50: 56–87. doi:10.1016/j.mam.2016.04.006. PMID 27106402.
- ^ Holeček M (august 2017). "Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions". Journal of Cachexia, Sarcopenia and Muscle. 8 (4): 529–541. doi:10.1002/jcsm.12208. PMC 5566641. PMID 28493406.
- ^ a b Wu H, Xia Y, Jiang J, Du H, Guo X, Liu X, et al. (2015). "Effect of beta-hydroxy-beta-methylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis". Archives of Gerontology and Geriatrics. 61 (2): 168–75. doi:10.1016/j.archger.2015.06.020. PMID 26169182.
- ^ Srinath R, Dobs A (februar 2014). "Enobosarm (GTx-024, S-22): a potential treatment for cachexia". Future Oncology. 10 (2): 187–94. doi:10.2217/fon.13.273. PMID 24490605.
- ^ a b Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM (oktobar 2007). "Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy?". Clinical Nutrition. 26 (5): 658–61. doi:10.1016/j.clnu.2007.07.003. PMID 17904252.
- ^ a b c Lohuis TD, Harlow HJ, Beck TD (maj 2007). "Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia". Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 147 (1): 20–8. doi:10.1016/j.cbpb.2006.12.020. PMID 17307375.
- ^ Carey HV, Andrews MT, Martin SL (oktobar 2003). "Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature". Physiological Reviews. 83 (4): 1153–81. doi:10.1152/physrev.00008.2003. PMID 14506303.
- ^ a b Harlow HJ, Lohuis T, Anderson-Sprecher RC, Beck TD (2004). "Body Surface Temperature Of Hibernating Black Bears May Be Related To Periodic Muscle Activity". Journal of Mammalogy. 85 (3): 414–419. doi:10.1644/1545-1542(2004)085<0414:BSTOHB>2.0.CO;2.
Vanjski linkovi
uredi- Muscular atrophy na US National Library of Medicine Medical Subject Headings (MeSH)