Adenozin-deaminaza
Adenozin-deaminaza (znana i kao adenozin-aminohidrolaza ili ADA) je enzim (EC 3.5.4.4) uključen u metabolizam purina. Potreban je za razgradnju adenozina iz hrane i za promet nukleinskih kiselina u tkivima.
| Adenozin/AMP-deaminaza | |
|---|---|
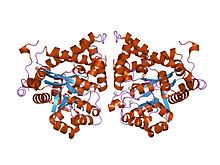 Kristalna struktura adenozin-deaminaze (py02076) Plasmodium yoelii | |
| Identifikatori | |
| Simbol | A_deaminase |
| Domen adenozin-deaminaze (editaze) | |
|---|---|
| Identifikatori | |
| Simbol | A_deamin |
| Adenozin/N-kraj AMP-deaminaze | |
|---|---|
| Identifikatori | |
| Simbol | A_deaminase_N |
Njegova primarna funkcija kod ljudi je razvoj i održavanje imunskog sistema.[5] Međutim, puna fiziološka uloga ADA još nije u potpunosti shvaćena.[6]
Struktura
urediADA postoji i u malom obliku (kao monomer) i u velikom obliku (kao dimer-kompleks) .U monomernom obliku enzim je polipeptidni lanac,[7] presavijen u osam niti paralelnih α / β tubula, koje okružuju središnji duboki džep koji je aktivno mjesto. Pored osam središnjih beta-bačvi i osam perifernih α-heliksa, ADA također sadrži pet dodatnih zavojnica: ostaci 19-76 puta preklopljenih u tri zavojnice, koji se nalaze između β1 i α1 nabora, a dvije antiparalelne karboksi-terminalne spirale nalaze se preko amino-terminala β-tubula.
Aktivno mjesto ADA sadrži cink-ion koji se nalazi u najdubljem udubljenju aktivnog mjesta i koordiniran je s pet atoma iz His15, His17, His214, Asp295 i supstrata. Cink je samo kofactor koji je neophodan za njenu aktivnost.
Supstrat, adenozin, stabiliziran je i vezan za aktivno mjesto pomoću devet vodikovih veza.Karboksilna grupa Glu217, približno koplanarna sa purinskim prstenom supstrata, u položaju je da formira vodikovu vezu sa N1 supstrata. Karboksilna grupa Asp296, također koplanarna sa purinskim prstenom supstrata, tvori vodikovu vezu sa N7 supstrata. NH grupa Gly184 u poziciji je da stvori vodikovu vezu sa N3 supstrata. Asp296 stvara veze kako sa ionom Zn2+, tako i sa 6-OH supstrata. His238 se također vodikom veže za supstrat 6-OH. Riboza 3'-OH supstrata tvori vodikovu vezu sa Asp19, dok 5'-OH tvori vodikovu vezu sa His17. Dvije daljnje vodikove veze stvaraju se na molekulama vode, na otvaranju aktivnog mjesta, pomoću 2'-OH i 3'-OH supstrata.
Zbog uvlačenja aktivnog mjesta unutar enzima, supstrat, nakon što se veže, gotovo je u potpunosti odvojen od rastvarača.Površinska izloženost supstrata rastvaraču kada je vezan je 0,5% površinske izloženosti supstrata u slobodnom stanju.
Reakcije
urediADA nepovratno deaminira adenozin, pretvarajući ga u srodni nukleozid inozin supstitucijom amino grupe keto grupom.
Inozin se zatim može deribozirati (ukloniti iz riboza) pomoću drugog enzima zvanog purinska nukleozid-fosforilaza (PNP), pretvarajući ga u hipoksantin.
Mehanizam katalize
urediPredloženi mehanizam za ADA kataliziranu deaminaciju je stereospecifična adicija-eliminacija putem tetraedarskog intermedijera.[8] Putem oba mehanizma, Zn2+ kao snažni elektrofil aktivira molekulu vode, koju osnovni Asp295 deprotonira, kako bi stvorio napadajući hidroksid. His238 orijentira molekulu vode i stabilizira naboj napadajućeg hidroksida. Glu217 je protoniran da donira proton N1 supstrata.
Reakcija je stereospecifična, zbog lokacije ostataka cinka, Asp295 i His238, koji su okrenuti prema B-strani purinskog prstena supstrata.
Uočena je kompetitivna inhibicija za ADA, gdje proizvod inozin djeluje na kompetitivni inhibitor na enzimsku aktivnost.[9]
Funkcija
urediADA se smatra jednim od ključnih enzima metabolizma purina. Enzim je pronađen u bakterijama, biljkama, beskičmenjacima, kičmenjacima i sisarima, sa visokom konzervacijom aminokiselinske sekvence. Konzerviranje sekvence aminokiselina sugerira ključnu prirodu ADA na putu spašavanja purina.
Prvenstveno, kod ljudi ADA je uključen u razvoj i održavanje imunoskog sistema. Međutim, primijećena je i povezanost ADA sa održavanjem epitelnih ćelija diferencijacijom, neurotransmisijom i gestacijom.[10] Također je predloženo da ADA, pored razgradnje adenozina, stimulira oslobađanje pobuđujuće aminokiseline i neophodna je za spajanje A1 adenozinskih receptora i heterodimernog G-proteina.[6] Nedostatak adenozin deaminaze dovodi do plućne fibroze,[11] što sugerira da hronična izloženost visokim nivoima adenozina može pogoršati reakcije upale, umjesto da ih suzbija. Također je prepoznato da su protein i aktivnost adenozin-deaminaze povećani u mišjim srcima koja prekomjerno izražavaju HIF-1 alfa, što dijelom objašnjava oslabljene nivoe adenozina u srcima koji eksprimiraju HIF-1 alfa tokom ishemijskog stresa.[12]
Patologija
urediNeke mutacije u genu za adenozin-deaminazu uzrokuju da on ne dolazi do ekspresije. Rezultirajući nedostatak jedan je od uzroka teške kombinirane imunodeficijencije (SCID), posebno autosomno recesivnog nasljeđivanja.[13] Deficitni nivo ADA povezan je i s plućnom upalom, smrću timusnih ćelija i neispravnim signaliziranjem T-ćelijskih receptora.[14][15]
Suprotno tome, mutacije zbog kojih ovaj enzim dolazi do prekomjerne ekspresije jedan su od uzroka hemolitske anemije.[16]
Postoje neki dokazi da drugačiji alel (ADA2) može dovesti do autizma.[17]
Izoforme
urediPostoje 2 izoforme ADA: ADA1 i ADA2.
- ADA1 se nalazi u većini tjelesnih ćelija, posebno limfocita i makrofaga, gdje je prisutan ne samo u citosolu i jedru već i kao ektoforma na ćelijskoj membrani vezanoj za dipeptidil peptidazu-4 (aka CD26). ADA1 je uglavnom uključen u unutarćelijsku aktivnost i postoji u malom obliku (monomer) i velikom obliku (dimer).[6] Interkonverzija malih u velike oblike regulisana je „faktorom konverzije“ u plućima.[19]
- ADA2 was first identified in human spleen.[20] Naknadno je pronađen u drugim tkivima, uključujući makrofage, gdje koegzistira s ADA1. Dvije izoforme reguliraju odnos adenozina i dezoksiadenozina, koji potenciraju ubijanje parazita. ADA2 se nalazi pretežno u ljudskoj plazmi i serumu i postoji samo kao homodimer.[21]
Klinički značaj
urediADA2 je dominantni oblik prisutan u ljudskoj plazmi i pojačan je kod mnogih bolesti, posebno onih povezanih s imunsim sistemom: na primjer reumatoidni artritis, psorijaza i sarkoidoza . Izoforma ADA2 u plazmi je također povećana kod većine karcinoma. ADA2 nije sveprisutan, ali koegzistira s ADA1 samo u monocitima-makrofazima.
Ukupni ADA u plazmi može se izmjeriti pomoću tečna hromatografija visoke performans ili enzimskim ili kolorimetrijskim tehnikama. Možda najjednostavniji sistem je merenje amonijaka koji se oslobađa iz adenozina kada se razgradi na inozin. Nakon inkubacije plazme s puferskim rastvorom adenozina, amonijak reagira sa Berthelotovim reagensom dajući plavu boju koja je proporcionalna količini aktivnosti enzima. Za mjerenje ADA2, eritro-9- (2-hidroksi-3-nonil) adenin (EHNA) se dodaje prije inkubacije, kako bi se inhibirala enzimska aktivnost ADA1. Odsustvo ADA1 je ono što uzroci Teške kombinirane imunodeficijencije( SCID).
ADA se također može koristiti u obradi limfocitnih pleurskih izljeva ili peritoneumskim ascitima, tako što takvi uzorci s niskim nivoom ADA u osnovi isključuju tuberkulozu.[22]
Tuberkulozni pleurski izlivi sada se mogu precizno dijagnosticirati povišenim nivoima adenozin-deaminaze pleurskwe tečnosti, iznad 40 U po litru.[23]
Kladribin i Pentostatin su antineoplastična sredstva koja se koriste u liječenju leukemije trepljavih ćelija; njihov mehanizam djelovanja je inhibicija adenozin-deaminaze.
Također pogledajte
urediReference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000196839 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000017697 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Wilson DK, Rudolph FB, Quiocho FA (maj 1991). "Atomic structure of adenosine deaminase complexed with a transition-state analog: understanding catalysis and immunodeficiency mutations". Science. 252 (5010): 1278–1284. doi:10.1126/science.1925539. PMID 1925539.
- ^ a b c Cristalli G, Costanzi S, Lambertucci C, Lupidi G, Vittori S, Volpini R, Camaioni E (Mar 2001). "Adenosine deaminase: functional implications and different classes of inhibitors". Medicinal Research Reviews. 21 (2): 105–128. doi:10.1002/1098-1128(200103)21:2<105::AID-MED1002>3.0.CO;2-U. PMID 11223861.
- ^ Daddona PE, Kelley WN (Jan 1977). "Human adenosine deaminase. Purification and subunit structure". The Journal of Biological Chemistry. 252 (1): 110–115. PMID 13062.
- ^ Losey HC, Ruthenburg AJ, Verdine GL (Jan 2006). "Crystal structure of Staphylococcus aureus tRNA adenosine deaminase TadA in complex with RNA". Nature Structural & Molecular Biology. 13 (2): 153–159. doi:10.1038/nsmb1047. PMID 16415880. S2CID 34848284.
- ^ Saboury AA, Divsalar A, Jafari GA, Moosavi-Movahedi AA, Housaindokht MR, Hakimelahi GH (maj 2002). "A product inhibition study on adenosine deaminase by spectroscopy and calorimetry". Journal of Biochemistry and Molecular Biology. 35 (3): 302–305. doi:10.5483/BMBRep.2002.35.3.302. PMID 12297022.
- ^ Moriwaki Y, Yamamoto T, Higashino K (Oct 1999). "Enzymes involved in purine metabolism--a review of histochemical localization and functional implications". Histology and Histopathology. 14 (4): 1321–1340. PMID 10506947.
- ^ Blackburn MR (2003). "Too much of a good thing: adenosine overload in adenosine-deaminase-deficient mice". Trends in Pharmacological Sciences. 24 (2): 66–70. doi:10.1016/S0165-6147(02)00045-7. PMID 12559769.
- ^ Wu J, Bond C, Chen P, Chen M, Li Y, Shohet RV, Wright G (2015). "HIF-1α in the heart: remodeling nucleotide metabolism". Journal of Molecular and Cellular Cardiology. 82: 194–200. doi:10.1016/j.yjmcc.2015.01.014. PMC 4405794. PMID 25681585.
- ^ Sanchez JJ, Monaghan G, Børsting C, Norbury G, Morling N, Gaspar HB (maj 2007). "Carrier frequency of a nonsense mutation in the adenosine deaminase (ADA) gene implies a high incidence of ADA-deficient severe combined immunodeficiency (SCID) in Somalia and a single, common haplotype indicates common ancestry". Annals of Human Genetics. 71 (Pt 3): 336–47. doi:10.1111/j.1469-1809.2006.00338.x. PMID 17181544.
- ^ a b Blackburn MR, Kellems RE (2005). "Adenosine deaminase deficiency: metabolic basis of immune deficiency and pulmonary inflammation". Advances in Immunology. 86: 1–41. doi:10.1016/S0065-2776(04)86001-2. ISBN 9780120044863. PMID 15705418. journal zahtijeva
|journal=(pomoć) - ^ Apasov SG, Blackburn MR, Kellems RE, Smith PT, Sitkovsky MV (Jul 2001). "Adenosine deaminase deficiency increases thymic apoptosis and causes defective T cell receptor signaling". The Journal of Clinical Investigation. 108 (1): 131–141. doi:10.1172/JCI10360. PMC 209335. PMID 11435465.
- ^ Chottiner EG, Cloft HJ, Tartaglia AP, Mitchell BS (Mar 1987). "Elevated adenosine deaminase activity and hereditary hemolytic anemia. Evidence for abnormal translational control of protein synthesis". The Journal of Clinical Investigation. 79 (3): 1001–5. doi:10.1172/JCI112866. PMC 424261. PMID 3029177.
- ^ Persico AM, Militerni R, Bravaccio C, Schneider C, Melmed R, Trillo S, Montecchi F, Palermo MT, Pascucci T, Puglisi-Allegra S, Reichelt KL, Conciatori M, Baldi A, Keller F (Dec 2000). "Adenosine deaminase alleles and autistic disorder: case-control and family-based association studies". American Journal of Medical Genetics. 96 (6): 784–90. doi:10.1002/1096-8628(20001204)96:6<784::AID-AJMG18>3.0.CO;2-7. PMID 11121182.
- ^ Cowan MJ, Brady RO, Widder KJ (Feb 1986). "Elevated erythrocyte adenosine deaminase activity in patients with acquired immunodeficiency syndrome". Proceedings of the National Academy of Sciences of the United States of America. 83 (4): 1089–1091. doi:10.1073/pnas.83.4.1089. PMC 323016. PMID 3006027.
- ^ Schrader WP, Stacy AR (Sep 1977). "Purification and subunit structure of adenosine deaminase from human kidney". The Journal of Biological Chemistry. 252 (18): 6409–6415. PMID 893413.
- ^ Schrader WP, Pollara B, Meuwissen HJ (Jan 1978). "Characterization of the residual adenosine deaminating activity in the spleen of a patient with combined immunodeficiency disease and adenosine deaminase deficiency". Proceedings of the National Academy of Sciences of the United States of America. 75 (1): 446–50. doi:10.1073/pnas.75.1.446. PMC 411266. PMID 24216.
- ^ Zavialov AV, Engström A (Oct 2005). "Human ADA2 belongs to a new family of growth factors with adenosine deaminase activity". The Biochemical Journal. 391 (Pt 1): 51–57. doi:10.1042/BJ20050683. PMC 1237138. PMID 15926889.
- ^ Jiménez Castro D, Díaz Nuevo G, Pérez-Rodríguez E, Light RW (2003). "Diagnostic value of adenosine deaminase in nontuberculous lymphocytic pleural effusions" (PDF). Eur. Respir. J. 21 (2): 220–4. doi:10.1183/09031936.03.00051603. PMID 12608433.
- ^ Brunicardi, F.; Andersen, Dana; Billiar, Timothy; Dunn, David; Hunter, John; Pollock, Raphael E. (2005). "Chapter 18, question 16". Schwartz's principles of surgery (8th izd.). New York: McGraw-Hill Professional. ISBN 978-0071410908.
Dopunska literatura
uredi- da Cunha JG (1992). "[Adenosine deaminase. A pluridisciplinary enzyme]". Acta Médica Portuguesa. 4 (6): 315–23. PMID 1807098.
- Franco R, Casadó V, Ciruela F, Saura C, Mallol J, Canela EI, Lluis C (Jul 1997). "Cell surface adenosine deaminase: much more than an ectoenzyme". Progress in Neurobiology. 52 (4): 283–94. doi:10.1016/S0301-0082(97)00013-0. PMID 9247966. S2CID 40318396.
- Valenzuela A, Blanco J, Callebaut C, Jacotot E, Lluis C, Hovanessian AG, Franco R (1997). "HIV-1 envelope gp120 and viral particles block adenosine deaminase binding to human CD26". Advances in Experimental Medicine and Biology. 421: 185–92. doi:10.1007/978-1-4757-9613-1_24. ISBN 978-1-4757-9615-5. PMID 9330696.
- Moriwaki Y, Yamamoto T, Higashino K (Oct 1999). "Enzymes involved in purine metabolism--a review of histochemical localization and functional implications". Histology and Histopathology. 14 (4): 1321–40. PMID 10506947.
- Hirschhorn R (1993). "Identification of two new missense mutations (R156C and S291L) in two ADA- SCID patients unusual for response to therapy with partial exchange transfusions". Human Mutation. 1 (2): 166–8. doi:10.1002/humu.1380010214. PMID 1284479.
- Berkvens TM, van Ormondt H, Gerritsen EJ, Khan PM, van der Eb AJ (Aug 1990). "Identical 3250-bp deletion between two AluI repeats in the ADA genes of unrelated ADA-SCID patients". Genomics. 7 (4): 486–90. doi:10.1016/0888-7543(90)90190-6. PMID 1696926.
- Aran JM, Colomer D, Matutes E, Vives-Corrons JL, Franco R (Aug 1991). "Presence of adenosine deaminase on the surface of mononuclear blood cells: immunochemical localization using light and electron microscopy". The Journal of Histochemistry and Cytochemistry. 39 (8): 1001–8. doi:10.1177/39.8.1856451. PMID 1856451.
- Bielat K, Tritsch GL (Apr 1989). "Ecto-enzyme activity of human erythrocyte adenosine deaminase". Molecular and Cellular Biochemistry. 86 (2): 135–42. doi:10.1007/BF00222613. PMID 2770711.
- Hirschhorn R, Tzall S, Ellenbogen A, Orkin SH (Feb 1989). "Identification of a point mutation resulting in a heat-labile adenosine deaminase (ADA) in two unrelated children with partial ADA deficiency". The Journal of Clinical Investigation. 83 (2): 497–501. doi:10.1172/JCI113909. PMC 303706. PMID 2783588.
- Murray JL, Perez-Soler R, Bywaters D, Hersh EM (Jan 1986). "Decreased adenosine deaminase (ADA) and 5'nucleotidase (5NT) activity in peripheral blood T cells in Hodgkin disease". American Journal of Hematology. 21 (1): 57–66. doi:10.1002/ajh.2830210108. PMID 3010705.
- Wiginton DA, Kaplan DJ, States JC, Akeson AL, Perme CM, Bilyk IJ, Vaughn AJ, Lattier DL, Hutton JJ (Dec 1986). "Complete sequence and structure of the gene for human adenosine deaminase". Biochemistry. 25 (25): 8234–44. doi:10.1021/bi00373a017. PMID 3028473.
- Akeson AL, Wiginton DA, Dusing MR, States JC, Hutton JJ (Nov 1988). "Mutant human adenosine deaminase alleles and their expression by transfection into fibroblasts". The Journal of Biological Chemistry. 263 (31): 16291–6. PMID 3182793.
- Glader BE, Backer K (Feb 1988). "Elevated red cell adenosine deaminase activity: a marker of disordered erythropoiesis in Diamond-Blackfan anaemia and other haematologic diseases". British Journal of Haematology. 68 (2): 165–8. doi:10.1111/j.1365-2141.1988.tb06184.x. PMID 3348976.
- Petersen MB, Tranebjaerg L, Tommerup N, Nygaard P, Edwards H (Feb 1987). "New assignment of the adenosine deaminase gene locus to chromosome 20q13 X 11 by study of a patient with interstitial deletion 20q". Journal of Medical Genetics. 24 (2): 93–6. doi:10.1136/jmg.24.2.93. PMC 1049896. PMID 3560174.
- Orkin SH, Goff SC, Kelley WN, Daddona PE (Apr 1985). "Transient expression of human adenosine deaminase cDNAs: identification of a nonfunctional clone resulting from a single amino acid substitution". Molecular and Cellular Biology. 5 (4): 762–7. doi:10.1128/mcb.5.4.762. PMC 366780. PMID 3838797.
- Valerio D, Duyvesteyn MG, Dekker BM, Weeda G, Berkvens TM, van der Voorn L, van Ormondt H, van der Eb AJ (Feb 1985). "Adenosine deaminase: characterization and expression of a gene with a remarkable promoter". The EMBO Journal. 4 (2): 437–43. doi:10.1002/j.1460-2075.1985.tb03648.x. PMC 554205. PMID 3839456.
- Bonthron DT, Markham AF, Ginsburg D, Orkin SH (Aug 1985). "Identification of a point mutation in the adenosine deaminase gene responsible for immunodeficiency". The Journal of Clinical Investigation. 76 (2): 894–7. doi:10.1172/JCI112050. PMC 423929. PMID 3839802.
- Daddona PE, Shewach DS, Kelley WN, Argos P, Markham AF, Orkin SH (Oct 1984). "Human adenosine deaminase. cDNA and complete primary amino acid sequence". The Journal of Biological Chemistry. 259 (19): 12101–6. PMID 6090454.
- Valerio D, Duyvesteyn MG, Meera Khan P, Geurts van Kessel A, de Waard A, van der Eb AJ (Nov 1983). "Isolation of cDNA clones for human adenosine deaminase". Gene. 25 (2–3): 231–40. doi:10.1016/0378-1119(83)90227-5. PMID 6198240.
Vanjski linkovi
uredi- ADA lokacija ljudskog genoma UCSC Genome Browser.
ADA detalji ljudskog genoma u UCSC Genome Browser.
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Adenosine deaminase
- PDBe-KB provides an overview of all the structure information available in the PDB for Mouse Adenosine deaminase