Beta-list
Beta-list ili beta-ravan ili naborana ravan i beta-ploča, uz alfa-heliks je drugi tip sekundarne strukture proteina. Sastoji od ß-lanaca bočno povezanih sa tri ili više vodikovih veza i formira uvijenu nabranu ploču.


ß-lanac je niz od 5-10 aminokiselina čiji su peptidni lanci skoro potpuno izduženi. Povezane ß-ravni učestvuju u formiranju globulastih i nitastnih proteina koji su ispitivani kod mnogih ljudskih bolesti, uključujući Alzheimerovu i bolest ludih krava.
Nomenklatura
urediNajčešće korišćeni termin ß-lanac odnosi se na jednolančani niz aminokiselina, izdužene konfiguracije, obavijen vodikovim vezama, dok se ß-ravan se odnosi na skup lanaca međusobno povezanih vodikovim vezama. Međutim, izraz ß- ravan se ponekad koristi kao sinonim za ß-lanac ili ß-list, kao naprimer, za jedan segment aminokiseline koja je produžena vodikovom vezom.[1]
Historija
uredia) Pogled sprijeda, prikazuje antiparalelne vodikove veze (isprekidane) između peptidnih NH i CO grupa na susjednim lancima. Strelice pokazuju smjer lanca, a konture gustine elektrona ocrtavaju atome koji nisu vodici. Atomi kisika su crvene kuglice, atomi dušika su plavi, a atomi vodika su izostavljeni zbog jednostavnosti; bočni lanci su prikazani samo prema prvom ugljikovom atomu u bočnom lancu (zeleni).
b) Pogled s ruba na centralne dvije β-niti u a, pokazujući desni zaokret i nabor C α i bočnih lanaca koji naizmjenično strše nasuprot uputi s lista.
Prve strukture ß-listova je opisao je William Astbury, 1930. Predložio je ideju o vodikovim vezama između peptidnih veza paralelnih ili antiparalelnih izduženih ß-lanaca. Ipak, nije imao neophodne podatke o geometriji aminokiselindkih veze da bi mogao kreirati tačne modele, posebno zato što nije znao da je peptidna veza polarna. Tačniju verziju predložili su Linus Pauling i Robert Corey, 1915.
Struktura i orijentacija
urediGeometrija
urediVećina ß-lanaca su uređeni tako da u dodiru sa drugim lancima formiraju izduženu mrežu vodikovih veza]] sa susjednim lancima, u kojoj N-H grupe skeleta jednog lanca uspostavljaju vikove veze sa C=O grupama kičme susjednih lanaca. U potpuno izduženom ß-lancu dolazi do sukcesivne promjene bočnih lanaca uspravljanja i spuštanja itd.
Okolni ß-lanci u ß-ravni su raspoređeni tako da su njihovi dodirni atomi Cα i bočni lanci jednako usmjereni. Naboranost ß-lanca je obrazac tetraedarske hemijske veze Cαatoma, npr. kada je bočni lanac usmjeren okomito, kada mora biti blago usmjeren nadolje, jer je njen ugao veze otprilike 109.5°.
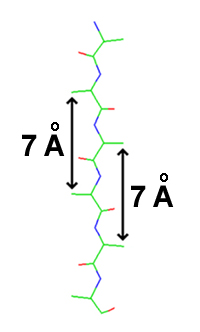
Nabrnost stvara razmak između i koji otprilike iznosi 6 Å, prije nego 7,6Å(2x3.8Å) koji se očekuje od dva potpuno izdužene trans peptidne virtualne veze. “Bočno” rastojanje između susjednih atoma Cα u vodikovoj vezi ß-lanaca je 5 Å.
ß-lanaci su rijetko savršeno izduženi, a češće imaju blagu uvijenost, da bi izbjegli oblik lika u ogledalu svojih saatavnih aminokiselina. Energetski su povoljniji diedarni uglovi (φ, ψ) = (–135°, 135°) (široki, gornji lijevi region nastaje iz potpuno izdužene konfiguracije (φ, ψ) = (–180°, 180°).[2] Zaokret je često povezan sa alternativnim fluktacijama u diedarskim uglovima, da bi spriječili razdvajanja pojedinačnih ß-lanaca u većim listovima. Dobar primjer ovakvog ß-uvijanja ima protein BPTI.(Aprotinin, poznat i pod nazivom goveđi pankreasni inhibitor tripsina BPTI. To je protein koji se koristi kao lijek, prilikom kompliciranih operacija, kao što su operacije [srce|[srca]] i jetre, da bi se smanjilo krvarenje).
Svojstva vodikovih veza
urediBudući da su peptidni lanci u direktnoj vezi preko njihovih N– i C-krajeva, time su povezani i ß-lanci tako. Često su predstavljani u dijagramima topologije proteina sa strelicom koja je usmjerena ka C-kraju. Susjedni ß-lanci mogu imati vodikove veze kao paralelne, antipapalelne i mješovite.
U antiparalelnim, uzatopni ß-lanci mijenjaju pravac, tako da se N-kraj jednog lanca nadovezuje na C-kraj sljedećeg. Ovakvo uređenje stvara najjaču međulančanu stabilnost, jer omogućava da međulančana vodikova veza karbonilnih i vodikovih grupa bude ravna, što je njihova poželjnija orijentacija. Diedrski uglovi peptidne kičme su (φ, ψ)= (–140°, 135°). U ovom slučaju, ako su dva atoma i susjedna u dva ß-lanca, a povezani vodikovim vezama, onda formiraju dvije zajedničke kičme vodikovih veza, pored peptidnih grupa svakog atoma, što je poznato kao “bliski par” vodikovih veza. U paralelnoj formi, svi N-krajevi uzastopnih lanaca su istosmjerni. Zbog nepolarnosti, ova orijentacija je nešto manje stabilna. Diedarsk uglovi u paralelnim pločama (φ, ψ) su otprilike oko (–120°, 115°). Rijetko ima manje od pet paralelnih lanaca, koji se intereaguju u motivu, što ukazuje da je manji broj lanaca možda nestabilan. U ovom slučaju, ako su dva atoma i susjedi u dva ß-lanca povezani vodikovim vezama, onda se međusobno ne vežu takvim vezama, jer se češće jedan bočni kraj veže voikovom vezom za drugi (ali ne i suprotno). Naprimjer, bočni par može oformiti vodikove veze sa bočnim krajevima i ; ovo je poznato kao “široki par” vodikovih veza. Nasuprot tome, bočni par može tvoriti vodikove veze sa svim različitim bočnim grupama ili ni sa jednom.
Konačno, pojedinačni lanci mogu biti sa ibrascem mješavine veza sa paralelnim lancem na jednoj strani i antiparalelnim na drugoj. Ovakvo uređenje je manje uobičajeno nego što bi se pretpostavilo nasumičnom raspodjelom orijentacija, što ukazuje na to da je ova shema manje stabilna od antipapalelne.
Povezivanje ß-lanca vodikovim vezama ne mora biti savršeno; mogu postojati i lokalne smetnje poznate kao ß-ispupčenja.
Vodikovee veze nalaze se približno u površini ravni, sa peptidnim karbonilnim grupama usmjerenim u naizmeničnim pravcima, sa naizmeničnim bočnim grupama. Poređenja radi, uzastopne karbonilne grupe su usmjerene u istom pravcu u alfa-heliksu.
ß-paralelna i ß-antipapalelna strukrura
urediß-paralelna i ß-antipapalelna struktura sastoje se od susjednih polipeptidnih sekvenci ili susjedijeno smještenih dijelova istog polipeptidnog niza, koji su međusobno povezani vodikovim vezama. Konformacija polipeptidne sekvence ova dva oblika ß-strukture nešto se razlikuje od one kod istegnutog polipeptidnog niza (ψ=φ=180°, kada su sve peptidne veze u potpuno istegnutoj, tj. tonus konformaciji), što daje polipeptidnoj sekvenci izgled nabrane strukture. Kod oba oblika ß-struktura, sve N–C i C=O grupe su kolinearne, tako da se između njih formiraju vodikove veze. Bočne grupe su naizmenično postavljene s jedne, odnosno s druge strane ravni peptidne veze, a prosječni razmak između dvije bočne grupe s iste strane polipeptidnog niza iznosi 7 Å. U prosjeku, dužina jednog segmenta ß-strukture iznosi oko 21 Å, a u njoj učestvuje 15 aminokiselinskih ostataka. Dužina ß-strukture nije strogo definirana i u pojedinim proteinima mogu se naći sekvence koje sadrže 2-15 segmenata, odnosno 30-225 aminokiselinskih ostataka.
Paralelna i antiparalelna ß-struktura razlikuje se po orijentaciji vodikom vezanih peptidnih nizova. Kod paralelne strukture, susjedno vezani polipeptidni nizovi su istosmjerni (C– i N-krajevi su jednako usmjereni), dok su kod antiparalelne strukture susjedni nizovi vezani vodikom, polipeptidni nizovi usmjereni (jedan polipeptidni niz ima orijentaciju N– C–, a drugi C– N–, orijentaciju). Oba oblika ß-strukture su približno zastupljena u strukturi proteina, iako je paralelna nešto manje stabilna od antipapalelne. Osim toga, u molekuli proteina se može ostvariti i mješovita paralelno-antiparalelna struktura polipeptidnog niza, ali je znatno rjeđa.
Afiniteti aminokiselina
urediVelike aromatske bočne grupe (Thy, Phe i Trp) i ß-razgranate aminokiseline (Thr, Val, Ile) imaju veću vjerovatnoću da se nađu u okviru ß-lanca u sredini ß-ravni.[3] Interesantno je da se različiti tipovi bočnih grupa (kao što je Prolinska) prvnstveno nalaze na kraju lanca ß-jravni, verovatno da bi izbjegle vezanja između proteina po obrascu “kraj za kraj”, koje može dovesti do grupisanja i amiloidne forme.
Česti strukturni motivi
urediMotivi strukture proteina koji su nastali kombinacijom dvije ili više sekundarnih sutruktura označavaju se kao supersekundarne strukture. Njihovim nastankom, zasnovanom na vodikovim vezama, smanjuje se broj slobodnih mjesta za nove vodikove veze. Zato su ove strukture uglavnom u unutrašnjem, nepolarnom dijelu proteina, daleko od okolne vode, koja zahtijeva slobodna mjesta za stvaranje vodikovih veza.
Određeni dijelovi proteinske molekule mogu formirati specifične domene. Oni su lokalno organizirane strukture proteina, a jezgro svakog od njih sastoji se od serije međusobno povezanih ß-ravni ili α-heliksne strukture; veoma često su kombinirane ove dvije sekundarne sutrukture proteina. Budući da postoji mali broj obrazaca za kombiniranje α– i ß-strukture u globulske strukture, kombinacijom ovih sekundarnih struktura grade se određeni proteinski motivi.
Vrlo jednostavan strukturni motiv kod ß-ravni je ß-ukosnica, u kojoj su dva antiparalelna lanca povezana (ß-okret) kratkom petljom od dva do pet bočnih lanaca, od kojih je jedan najčešće sa glicinom ili prolinom, gdje oba mogu da prihvate neobičnu konfiguraciju dvostrukog ugla potrebnu za oštar zaokret, odnosno formira se oštro savijanje peptidnog lanca. Međutim, pojedinačni lanci se takođe mogu povezati sa dugačkim petljama na složenije načine; petlje mogu imati alfa heliks ili čak cijele proteinske domene.
Motiv grčkog ključa
urediMotiv grčkog ključa se sastoji iz četiri susjedna antiparalelna lanca i njihovih veznih petlji. Sadrži tri antiparalelna lanca spojena ukosnicom, dok se četvrti graniči sa prvim, a sa trećim lancem je spojen je dužom petljom. Ovj tip strukture formira se vrlo lahko, tokom procesa slaganja proteina. Dobio je naziv po čestoj šari na ornamentima starogrčke umjetnosti.[4][5]
β–α–β motiv
urediU ovom motivu sudvije antiparalelne nabrane β-ploče povezane dijelom polipeptida strukture kao & α;-heliks. Sličan motiv zvan β-α-β-αmotiv čini osnovnu komponentu najčešćeg oblika tercijarna strukture proteina, TIM bure.[6]
Motiv psi-petlje
urediMotiv psi-petlje (Ψ-petlje) sastoji se od dva antiparalelna lanca s jednim lancem između, koji je s oba povezan vodikovim vezama.[7] There are four possible strand topologies for single Ψ-loops.[8] Ovaj motiv je rijedak jer ie mala vjerovatnoća da se neće dogoditi da se desi proces preklapanja proteina. Ψ-petlja je prvi put identificirana u porodici asparaginska proteaza.[8]
Ostali motivi
urediVelika raznovrsnost topologije i veza između osnovnih sekundarnih strukturnih elemenata uzrokuje formiranje različitih proteinskih uvijanja. Poznati prijevoji koji sadrže ß-ravni uključuju ß-valjkove, ß-propelere i motive želatinasto-uvijenog prijevoja. Osnovi strukturne klasifikacije proteina uključuju posebnu kategoriju za sve ß-proteine.[9][10]
Struktura proteina sa β-ravnima
urediΒ-ravni se nalaze u svim β, α+β i α/β domenima prema strukturnoj klasifikaciji proteina (Structural Classification of Proteinsand – SCOP) je obiman priručnik, u kojem su klasificirani strukturni domeni proteina, zasnovani na sličnostima dijelova njihovih aminokiselina i trodimenzijske strukture) i mnogih peptida ili malih proteina sa slabo definisarom strukturom. Svi β domeni mogu formirati oblike kao što su β-bure, β-sendvič, β-przma, β-propeler, β-heliks.[11][12]
Strukturna topologija
urediTopologija ß-ravni opisuje raspored vodikovih veza ß-lanaca duž kičme (osnovnog lanca). Naprimjer, prijevoj flavodoksina ima petolančanu, paralelnu ß-ravan sa topologijom 21345; stoga, granični lanci su ß-lanci 2 i ß-lanci 5, duž kičme. Tačnije, ß-lanac 2 je H-vezan sa ß-lancem 1, koji je H-vezan sa ß-lancem 3, a ovaj H-vezan sa ß-lancem 4, koji je također H-vezan sa ß-lancem 5, drugim graničnim lancem. Po istom principu, opisani motiv grčkog ključa ima topologiju 4123. Sekundarna struktura ß-ravni može se grubo opisati tako što se lancima pripisuju brojevi, bilo da su im vodikove veze paralelne ili antiparalelne.
ß-ravni mogu biti otvorene, što znači da imaju dva granična lanca (kao kod prijevoja flavodoksina ili imunoglobulina) ili mogu biti zatvoreni, kao što je ß-bure (TIM bure). Neke otvorene ß-ravni su veoma zakrivljene i savijaju se oko sebe (SH3 domena) ili su potkovičasti (kao kod ribonukleinskih inhibitora). Otvorene ß-ravni mogu se sastaviti „licem u lice“ (kao kod beta-propeler domena ili prijevoja imunoglobulina) ili „kraj sa krajem“, formirajući jednu veliku ravan
Paralelni ß heliksi
urediß heliks se formira od ponavljajućih strukturnih jedinica, koje se sastoje od dva ili tri kratka ß-lanca, povezana kratkim petljama. Ove jedinice se “nagomilavaju“ jedna na drugu u obliku spirale tako da dolazi do uzastopnog ponavljanja istog lanca vodikovih veza, u međusobno paralelnoj orijentaciji. Kod ß-heliksa, sami lanci su skoro planarni, a rezultujuća površina heliksa je skoro ravna, naprimjer, formiranjem oblika trouglaste prizme.[13]
U ljevorukim β-spiralama sami su lanci su prilično ravni i neokrenuti; rezultirajuće zavojne površine su gotovo ravne, formirajući pravilan trokutastu prizmu oblik, kao što je prikazano za arhealnu karbonsku anhidrazu 1QRE desno. Ostali primjeri su enzim za sintezu lipida A LpxA i proteini protiv smrzavanja protiv insekata sa redovnim nizom Thr bočnih lanaca na jednoj strani koji oponašaju strukturu leda. Dvolančani heliks prisutan je u enzimu pektat-lijaza. Ima dvije petlje, dužine od po šest bočnih grupa, a da bi održale integritet strukture vezane su ionima stabilizacijskog kalcija. Složeniji trolančani heliks sadrži tri vezivne petlje, od kojih je jedna duga tačno koliko dvije bočne grupe, a druge variraju. Ova struktura je nađena u bakteriofagu P22 repnovršnog proteina.
Strukture β-nabora napravljene su od proširenih polipeptidnih β-lanaca, sa nitima povezanim sa svojim susjedima vodikovim vezama. Zbog ove produžene konformacije okosnice, β-listovi se opiru istezanju. β-listovi u proteinima mogu izvoditi niskofrekventno gibanje poput harmonike. kako je uočeno Ramanovom spektroskopijom[14] i analizirano prema kvazikontinuiranim modelu[15]
Desnoruka β-spirala, tipizirana enzimom pektat-lijaza prikazanim s lijeve strane ili P22 fag proteinskog kraka, imaju manje pravilni presjek, duži i uvučeni na jednoj od strana; od tri vezne petlje , jedna je dosljedno duga u samo dva ostatka, a druge su promjenjive, često razrađene da tvore veze ili aktivno mjesto.[16]
U nekim bakterijskim metaloproteazama nalazi se dvostrana β-spirala (desnoruka); njihove dvije petlje dugačke su šest ostataka i vežu stabilizirajuće ione kalcija kako bi održale integritet strukture, koristeći okosnicu i Asp bočne lance kisika motiva sekvence GGXGXD.[17]
ß-ravni i patologija
urediNeki proteini koji su poremećeni ili spiralni kao monomeri, kao što je amiloid ß (amiloidi su nerješiva vlakna proteina, grupe koje imaju posebne strukturne osobine) koja mogu da formiraju oligomertne strukture bogate ß-ravnima, što je povezano sa patološkim stanjima. ß-amiloid je proteinska oligomerna forma, predstavljena kao uzročnik Alzheimerove bolesti. Njena struktura još treba da se odredi u potpunosti, ali skorašnji podaci ukazuju na to da može ličiti na neobičan dvostrukolančani ß-heliks.[18] Bočni lanci od ostataka aminokiselina nađeni u strukturi ß-ravni mogu također da budu uređeni tako da mnogi od graničnih bočnih lanaca na jednoj strani ravni budu hidrofobni, dok su mnogi od međusobno susjednih na suprotnoj strani ravni polarni ili naelektrisani (hidrofilni), što može biti korisno ako ravan treba da formira granicu između polarnih/vodnjikstih i nepolarnih/zamućenih okruženja.[19]
Također pogledajte
urediReference
uredi- ^ Cooper, J. "Super Secondary Structure - Part II" Arhivirano 28. 12. 2016. na Wayback Machine, May 31, 1996. Accessed May 25, 2007.
- Structural Classification of Proteins (SCOP) "Open-sided Beta-meander" Arhivirano 4. 2. 2012. na Wayback Machine, October 20, 2006. Accessed May 31, 2007.
- ^ Voet, Donald; Voet, Judith G. (2004). Biochemistry (3rd izd.). Hoboken, NJ: Wiley. str. 227–231. ISBN 0-471-19350-X.
- ^ Richardson JS, Richardson DC (mart 2002). "Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation". Proceedings of the National Academy of Sciences of the United States of America. 99 (5): 2754–9. doi:10.1073/pnas.052706099. PMC 122420. PMID 11880627.
- ^ Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- ^ Hutchinson EG, Thornton JM (april 1993). "The Greek key motif: extraction, classification and analysis". Protein Engineering. 6 (3): 233–45. doi:10.1093/protein/6.3.233. PMID 8506258.
- ^ See sections II B and III C, D in Richardson JS (1981). Anatomy and Taxonomy of Protein Structures. Advances in Protein Chemistry. 34. str. 167–339. doi:10.1016/s0065-3233(08)60520-3. ISBN 0-12-034234-0.
- ^ Hutchinson EG, Thornton JM (februar 1996). "PROMOTIF--a program to identify and analyze structural motifs in proteins". Protein Science. 5 (2): 212–20. doi:10.1002/pro.5560050204. PMC 2143354. PMID 8745398.
- ^ a b Hutchinson EG, Thornton JM (1990). "HERA--a program to draw schematic diagrams of protein secondary structures". Proteins. 8 (3): 203–12. doi:10.1002/prot.340080303. PMID 2281084.
- ^ "SCOP: Fold: WW domain-like". Arhivirano s originala, 4. 2. 2012. Pristupljeno 1. 6. 2007.
- ^ "PPS '96 - Super Secondary Structure". Arhivirano s originala, 28. 12. 2016. Pristupljeno 22. 10. 2020.
- ^ Hubbard TJ, Murzin AG, Brenner SE, Chothia C (januar 1997). "SCOP: a structural classification of proteins database". Nucleic Acids Research. 25 (1): 236–9. doi:10.1093/nar/25.1.236. PMC 146380. PMID 9016544.
- ^ Fox NK, Brenner SE, Chandonia JM (januar 2014). "SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures". Nucleic Acids Research. 42 (Database issue): D304-9. doi:10.1093/nar/gkt1240. PMC 3965108. PMID 24304899.
- ^ Liou YC, Tocilj A, Davies PL, Jia Z (juli 2000). "Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein". Nature. 406 (6793): 322–4. doi:10.1038/35018604. PMID 10917536.
- ^ Painter PC, Mosher LE, Rhoads C (juli 1982). "Low-frequency modes in the Raman spectra of proteins". Biopolymers. 21 (7): 1469–72. doi:10.1002/bip.360210715. PMID 7115900.
- ^ Chou KC (august 1985). "Low-frequency motions in protein molecules. Beta-sheet and beta-barrel". Biophysical Journal. 48 (2): 289–97. doi:10.1016/S0006-3495(85)83782-6. PMC 1329320. PMID 4052563.
- ^ Branden, Carl; Tooze, John (1999). Introduction to Protein Structure. New York: Garland. str. 20–32. ISBN 0-8153-2305-0.
- ^ Baumann U, Wu S, Flaherty KM, McKay DB (septembar 1993). "Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif". The EMBO Journal. 12 (9): 3357–64. PMC 413609. PMID 8253063.
- ^ Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D (juni 2005). "Structure of the cross-beta pine of amyloid-like fibrils". Nature. 435 (7043): 773–8. doi:10.1038/nature03680. PMC 1479801. PMID 15944695.
- ^ Zhang S, Holmes T, Lockshin C, Rich A (april 1993). "Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane". Proceedings of the National Academy of Sciences of the United States of America. 90 (8): 3334–8. doi:10.1073/pnas.90.8.3334. PMC 46294. PMID 7682699.
Dopunska literatura
uredi- Cooper J (31. 5. 1996). "Super Secondary Structure - Part II". Principles of Protein Structure Using the Internet. Arhivirano s originala, 28. 12. 2016. Pristupljeno 25. 5. 2007.
- "Open-sided Beta-meander". Structural Classification of Proteins (SCOP). 20. 10. 2006. Arhivirano s originala, 4. 2. 2012. Pristupljeno 31. 5. 2007.