Srebro-nitrat
Srebro nitrat (Srebro (I) nitrat) je so srebra sa hemijskom formulom AgNO3. Ovaj nitrat srebra je polazna osnova u proizvodnji i dobijanju mnogih drugih spojeva srebra, koji se koriste u industriji fotografskih pomagala, iako je ova so mnogo manje osjetljiva na svjetlost od srebrenih halida (spojeva srebra sa halogenim elementima).
| Srebro nitrat | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Srebro nitrat |
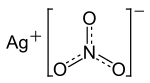
| Molekularna formula | AgNO3 |
| CAS registarski broj | 7761-88-8 |
| Kratki opis | bijeli kristalni prah |
| Osobine1 | |
| Molarna masa | 169,8731 g/mol |
| Agregatno stanje | čvrsto |
| Gustoća | 4,35 g/cm3 |
| Tačka topljenja | 212 °C |
| Tačka ključanja | 444 °C (raspada se) |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Sinteza i struktura
urediKristali srebro nitrata se mogu dobiti rastvaranjem metala srebra u rastvor nitratne kiseline te zatim uparavanjem otopine.
- 3 Ag(s) + 4HNO3(aq) → 3 AgNO3(aq) + 2 H2O (l) + NO(g)
U čvrstom srebro-nitratu, ioni srebra su aranžirani u planarnoj ravni s 3 koordinate (oblik jednakostraničnog trokuta).[1]
Upotreba
urediBaza za dobijanje drugih spojeva srebra
urediSrebro nitrat je najpovoljnija so srebra u smislu troškova industrijske proizvodnje, te nudi brojne prednosti. Nije higroskopna, nasuprot fluoroboratnim i perhloratnim solima. Relativno je stabilna pri izlaganju svjetlosti. Može se rastvoriti u brojnim otapalima. Nitratna funkcionalna grupa se može zamijeniti s mnogim drugim grupama, dajući druge soli srebra. Izlažući srebro-nitrat ionima halida dobija se AgX (gdje je X= Cl, Br, I itd.). U proizvodnji fotografskih filmova, srebro-nitrat reaguje s kalijum ili natrijum halidima te se formira nerastvorljiva so srebro halida u fotografskom želatinu. Zatim se ona nanosi na vrpce tri-acetata ili poliestera. Na sličan način se dobijaju i neki spojevi srebra koji se koriste u pravljenju eksploziva, poput fulminata, azida ili acetilida. Tretiranjem srebro-nitrata sa bazama dobija se srebreni oksid:
- 2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
Organska sinteza
urediSrebro-nitrat se koristi na mnoge načine u sintezama organskih tvari npr. kod deprotekcije ili oksidacije. Ion Ag+ reverzibilno spaja alkene, a srebro-nitrat se koristi kod razvdajanja smjesa alkena putem selektivne apsorpcije. Rezultirajući spoj se može dekompozirati sa amonijakom oslobađajući slobodne alkene.[2]
Medicina i farmakologija
urediUvođenje srebra u medicinu započelo je u 16. vijeku kada je njemački doktor i alhemičar Paracelsus uveo u upotrebu srebro-nitrat u liječenju rana. Ovaj preparat, poznat kao „lapis“, nalazi se u svakodnevnoj upotrebi kod zaustavljanja krvarenja nastalog kod brijanja te kod opskrbe pupka novorođenčeta (tzv. “lapiziranje pupka„). U drugoj polovici 19. stoljeća njemački ginekolog Carl Siegmund Franz Crede otkrio je da 1% otopina srebrenog nitrata ima odlično djelovanje protiv gonoreje. Ovo otkriće je toliko značajno i pouzdano da se do danas na porodu novorođenčadima ukapava u oči srebreni nitrat, u svrhu prevencije gonoroičnog konjuktivitisa. Spoj je takođe prepisivan i za liječenje teških opekotina, a djelovao je tako da sprječava infekciju.
Pri niskoj koncentraciji, otopina srebro nitrata ima antiseptička, adstrigentna, protivupalna i regenerirajuća svojstva. U većim koncentracijama (do 20%) lijek se može koristiti kao sredstvo za kauterizaciju. Budući da srebreni nitrat ima protivupalna svojstva, može se propisati u složenom liječenju gastritisa, kao i kod gastrointestinalnog ulkusa.
Toksičnost
urediSrebro-nitrat je otrovan i uzrokuje koroziju. Ukoliko srebro-nitrat dospije na kožu, koža najprije pobijeli, da bi nakon sat vremena potamnila, praveći kombinaciju metalnog srebra i srebrenih sulfida.