Slobodni elektronski par
U hemiji, usamljeni par ili slobodni elektronski par, odnosi se na par valentnih elektrona koji se ne dijele s drugim atomom u kovalentnoj vezi (IUPAC-ova definicija u Zlatnoj knjizi (Gold Book) [1] Ponekad se naziva i nepodijeljeni par ili nevezujući par. Usamljeni parovi nalaze se u najudaljenijem elektronskom omotaču atoma. Mogu se identificirati pomoću Lewisove strukture. Elektronski parovi se stoga smatraju usamljenim parovima ako su dva elektrona uparena, ali se ne koriste u hemijskoj vezi. Dakle, broj usamljenog parova elektrona plus broj vezujući elektroni jednak je ukupnom broju valencija elektrona oko atoma.

Koncept usamljenog para koji se koristi u teoriji odbijanja elektronskih parova valentne ljuske (VSEPR teorija) objašnjava oblike molekula. Oni su takođe navedeni u hemiji Lewisovih kiselina i baza. Međutim, hemičari ne smatraju sve nevezujuće parove elektrona usamljenim parovima. Primjeri su prijelazni metali kod kojih nevezujući parovi ne utječu na molekulsku geometriju i za koje se smatra da su stereohemijski neaktivni. U molekulnoj teoriji orbitala (potpuno delokalizirane kanonske orbitale ili lokalizirane u nekom obliku), koncept usamljenog para je manje različit, jer korespondencija između orbitale i komponenata Lewisove strukture često nije jednostavna. Ipak, zauzete nevežuće orbitale (ili orbitale uglavnom nevezujućeg karaktera) često se identificiraju kao usamljeni parovi.
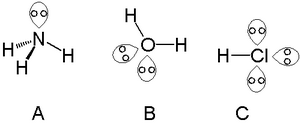
Jednostruki usamljeni par može se naći s atomima u dušičnoj grupi, kao što je dušik u amonijaka, a dva usamljena para mogu se naći s atomima u halkogenu. Skupina poput kisika u vodi i halogena može nositi tri usamljena para kao što je hlorovodik.
U VSEPR-teoriji elektronski parovi na atomu kisika u vodi čine vrhove tetraedra sa usamljenim parovima na dva od četiri vrha. H–O–H ugao veze je 104,5°, manje od 109° predviđenih za tetraedarski ugao, a to se može objasniti odbojnom interakcijom između usamljenih parova.[2][3][4] Predloženi su različiti računarski kriteriji za prisustvo usamljenih parova. Iako sama gustoća elektrona ρ (r) uglavnom ne pruža korisne smjernice u tom pogledu, otkriva se Lplaceova gustoća elektrona i jedan od kriterija za lokaciju usamljenog para je gdje je L (r) = – ∇2 ρ (r) lokalni maksimum. Minimum elektrostatskog potencijala V (r) je drugi predloženi kriterij. Još jedan uzima u obzir funkciju lokalizacije elektrona (ELF).[5]
Promjene ugla
urediParovi često pokazuju negativan polarni karakter sa svojom velikom gustoćom naboja i u prosjeku se nalaze bliže atomskom jezgru u poređenju sa veznim parom elektrona. Prisustvo usamljenog para smanjuje ugqao veze između veznog para elektrona, zbog njihovog visokog električnog naboja koji uzrokuje veliku odbojnost između elektrona. Oni se također koriste u formiranju dativne veze. Naprimjer, stvaranje iona hidronija (H3O+) nastaje kada se kiseline rastvore u vodi i zbog kisikopvog atoma koji donira usamljeni par ionu vodika. To se jasnije može vidjeti ako se pogleda u još dvije uobičajene molekule. Naprimjer, u ugljik- dioksidu (CO2), atomi kisika nalaze se na suprotnim stranama ugljika, dok u vodi (H2O) postoji ugao između atoma vodika od 104,5º. Zbog odbojne sile usamljenih parova atoma kisika, vodikovi se potiskuju dalje, do tačke u kojoj su sile svih elektrona na atomu vodika u ravnoteži. Ovo je ilustracija VSEPR-teorija.
Dipolni momenti
urediUsamljeni parovi mogu dati svoj doprinos molekuli dipolni moment. NH3 ima dipolni moment od 1,47 D. Kako je elektronegativnost dušika (3,04) veća od vodikove (2,2), rezultat je da su N–H veze polarne sa neto negativnim nabojem na atomu dušika i manjim neto pozitivnim nabojem na atomima vodika. Tu je i dipol povezan sa usamljenim parom, što pojačava doprinos polarnih kovalentnih N–H veza amonijaka dipolnom momentu. Za razliku od NH3, NF3 ima mnogo niži dipolni moment od 0,24 D. Fluor je više elektronegativan od dušik i polaritet NF veza suprotan je onom kod N–H veza u amonijaku, tako da se dipol zbog usamljenog para suprotstavlja dipolima N–F veze, što rezultira momentom niskog molekulskog dipola.
Stereogeni usamljeni parovi
uredi| ⇌ | ||
| Inverzija generičke molekule organskog amina na dušiku | ||
Usamljeni par može doprinijeti postojanju hiralnosti u molekuli, kada se sve tri druge grupe vezane za atom razlikuju. Učinak se vidi kod određenih amina, fosfina,[6] sulfonija i oksonijskih iona, sulfoksida, pa čak i karbaniona. Rezolucija enantiomera, gdje je stereogeni centar amin, obično je isključena jer je energetska barijera za inverziju dušika u stereo centru niska, što omogućava da se dva stereoizomera brzo međusobno pretvaraju na sobnoj temperaturi . Kao rezultat, takvi se hiralni amini ne mogu rastvoriti, osim ako grupe amina nisu ograničene u cikličnoj strukturi (kao u Trögerovoj bazi).
Neobični usamljeni parovi
urediTakođer se očekuje stereohemijski aktivan usamljeni par za dvovalentne ione olova i kositra, zbog njihove formalne elektronske konfiguracije ns2. U čvrstom stanju, to rezultira izobličenom koordinacijom metala uočenoj u strukturi monoksida kod PbO i SnO.
Stvaranje ovih teškometalnih ns2 usamljenih parova koji je prethodno pripisano intraatomskoj hibridizaciji s- i p-stanja metala[7] nedavno se pokazalo da ima jaku anionsku zavisnost.[8] Ova ovisnost o elektronskim stanjima aniona može objasniti zašto neki dvovalentni materijali olova i kositra, poput PbS i SnTe, ne pokazuju stereohemijska svojstva usamljenog para i imaju simetričnu kristalnu strukturu kamene soli.[9][10]
U molekulskim sistemima, usamljeni par također može rezultirati izobličenjem u koordinaciji liganada oko metalnog iona. Efekt usamljenog para olova može se uočiti u supramolekulskim kompleksima olovo (II) nitrata, a studija iz 2007. je usamljeni par povezala sa trovanjem olovom.[11] Ionska olova mogu zamijeniti nativne ione metala u nekoliko ključnih enzima, kao što su kationi cinka u enzimu ALAD, koji je poznat i kao porfobilinogen-sintaza, a važan je u sintezi hema, ključna komponenta molekule koja prenosi kisik u hemoglobinu. Čini se da je ta inhibicija sinteze hema molekulska osnova trovanja olovom (koje se naziva i "saturnizam" ili "plumbizam).[12][13][14]
Računarski eksperimenti otkrivaju da, iako se koordinacijski broj ne mijenja nakon supstitucije u proteinima koji se vezuju za kalcij, uvođenje olova narušava način na koji se ligandi organizuju, kako bi smjestili takav novonastali usamljeni par: posljedično, ovi proteini su poremećeni. Ovaj efekt usamljenih parova postaje dramatičan za proteine koji vežu cink, kao što je gore navedena porfobilinogen-sintaza, jer se prirodni supstrat više ne može vezati – u tim slučajevima protein je inhibiran. U elementima grupe 14 (grupa ugljika, usamljeni parovi mogu se manifestirati skraćivanjem ili produžavanjem dužina jednostrukih (redosled veza 1) veza,[15] kao i efektivnim redoslijedom trostrukih veza.[16][17] Poznati alkini imaju trostruku vezu ugljik-ugljik (redosled veze 3) i linearnu geometriju uglova veze 180 ° (slika A u referenci[18]). Međutim, dalje u grupi (silicij, germanij i kalaj, formalne trostruke veze imaju efektivan red veza 2, sa jednim usamljenim parom (slika B [18]) i trans-savijene geometrije. U olovu, efektivni poredak veza se još više smanjuje na jednostruku vezu, sa dva usamljena para za svaki atom olova (slika ’C’ [18]). U organogermanijevoj spoju (’Shema 1’ u referenci), efektivni redosled veza je također 1, sa kompleksiranjem C–N grupe kiselog izonitrila (ili izocijanida), zasnovanog na interakciji s praznom 4p orbitalom germanija.[18][19]
Različiti opisi za više usamljenih parova
urediU osnovnim programima hemije usamljeni parovi vode opisani su kao "zečje uši": dva ekvivalentna elektronska para su s približno sp3 hibridizacijom, dok je ugao veze HOH 104,5°, nešto manji od idealnog tetraedarskih uglova lukova (–1/3) ≈ 109,47 °. Manji ugao veze racionaliziran je VSEPR teorijom pripisujući veći prostorni za dva identična usamljena para, u odnosu na dva vezna para. U naprednijim programima, alternativno objašnjenje ovog fenomena razmatra veću stabilnost orbitala s viškom s karaktera, koristeći teoriju izovalentna hibridizacija, u kojoj se veze i usamljeni parovi mogu konstruirati sa spx hibridima, u kojima su dopuštene neintegralne vrijednosti x, sve dok je sačuvana ukupna količina s i p karaktera (jedna s i tri p-orbitale u slučaju elemenata p-bloka drugog reda).
Da bi se odredila hibridizacija orbitala kisika korištenih za formiranje veznih parova i usamljenih parova vode na ovoj slici, koristi se formula 1 + x cos θ = 0, koja povezuje ugao veze θ sa indeksom hibridizacije x. Prema ovoj formuli, smatra se da su O–H veze izgrađene od orbitala O vezanja ~sp4,0 hibridizacije (~ 80% p karaktera, ~ 20% s karaktera), što ostavlja hibridizaciju O usamljenijh parova orbitale ~sp2,3 (~70% p karakter, ~30% s karakter). Ova odstupanja od idealizirane sp3 hibridizacije za tetraedarsku geometriju, u skladu su s Benetovim pravilom: usamljeni parovi lokaliziraju više elektronske gustoće bliže centralnom atomu u odnosu na vezne parove; stoga je upotreba orbitala s viškom s karaktera za formiranje usamljenih parova (i, shodno tome, onih s viškom p karaktera za formiranje veznih parova) energetski je povoljna.
Međutim, teoretičari često preferiraju alternativni opis vode, koji razdvaja njene usamljene parove prema simetriji, s obzirom na molekulsku ravan. U ovom modelu postoje dva energetski i geometrijski različiti usamljeni parovi vode koji imaju različitu simetriju: jedan (σ) u ravni i simetričan u odnosu na molekulsku ravan, a drugi (π) okomit i antisimetričan u odnosu na planarnu površinu. Usamljeni par σ-simetrije (σ (izlaz)) nastaje od hibridne orbitale koja miješa 2s i 2p karakter, dok je usamljeni par π-simetrije (p) ekskluzivno 2p orbitalnog porijekla. Orbitala O σ (izvan) usamljenog para bogata s karakterima (također označena sa nO(σ)) je ~sp0,7hibrid (~40% p karaktera, 60% s karaktera), dok se orbitala p usamljenog para (također označena sa nO(π)) sastoji od 100% p karaktera.
Oba modela su vrijedna i predstavljaju istu ukupnu gustoću elektrona, s orbitalima povezanim unitarnom transformacijom. U ovom slučaju mogu se konstruirari dvije ekvivalentne usamljene hibridne orbitale h i h', uzimajući linearne kombinacije h= c1 σ (van) + c2 p i h'= c1σ (van) – c2p za odgovarajući izbor koeficijenata c1 i c2. Za hemijska i fizička svojstva vode koja ovise o ukupnoj elektronskoj raspodjeli molekule, upotreba h i h' vrijedi jednako kao i upotreba σ (van) i str. . U nekim slučajevima, takav pogled je intuitivno koristan. Naprimjer, stereoelektronski zahtjev za anomernim efektom može se racionalizirati korištenjem ekvivalentnih usamljenih parova, jer je najvažnija ukupna donacija elektronske gustoće u orbitalu za vezanje. Važeći je i alternativni tretman koji koristi σ/π odvojene usamljene parove, ali zahtijeva uspostavljanje ravnoteže između maksimiziranja preklapanja nO(π)–σ* (maksimum pod uglom od 90 ° u dvodijelnom uglu) i nO(σ)–σ* preklapaju se (maksimum pod uglom od 0 ° u diedru), kompromis koji dovodi do zaključka da je lijeva konformacija (dvostrani ugao 60°) najpovoljnija, a isti je zaključak da ekvivalentni usamljeni model parova racionalizira na mnogo jednostavniji način. Slično tome, vodikova veza vode nastaje duž pravaca usamljenih parova "zečjih ušiju", što je odraz povećane dostupnosti elektrona u tim regionima. Ovaj pogled je i računarski podržan. Međutim, zato što samo simetrijski prilagođene kanonske orbitale imaju fizički značajne energije, pojave koje imaju veze sa energijama pojedinačnih orbitala, poput fotohemijske reaktivnosti ili fotoelektronske spektroskopije, najlakše se objašnjavaju upotrebom σ i π usamljenih parova koji poštuju molekulsku simetriju.[20] Iako je usamljeni par nO (π) ekvivalentan kanonskom MO, s Mullikenovom oznakom 1b1, nO (σ) usamljeni par nije sasvim ekvivalentan kanonskom MO Mullikenove oznake 2a1, jer potpuno delokalizirana orbitala uključuje miješanje sa linearnim kombinacijama vodoravnih 1s-orbitala, prilagođenih simetriji faze, čineći je blagim povezivanjem karaktera, a ne strogim nevezanjem.
Zbog popularnosti VSEPR teorije, tretman usamljenih parova kao ekvivalentnih prevladava u uvodnim programima hemije, a mnogi hemičari koji ga praktikuju i dalje smatraju korisnim modelom. Slična situacija nastaje kada se opisuju dva usamljena para na karbonilnom kisiku ketona.[21] Međutim, pitanje je li koncepcijkski korisno izvoditi ekvivalentne orbitale iz prilagođenih simetrija, sa stanovišta teorije povezivanja i pedagogije, i dalje je kontroverzno, s nedatnim suprostavljenim člancima (2014. i 2015.)[22] i podršku.[23]
Također pogledajte
urediReference
uredi- ^ lone (electron) pair
- ^ Organic Chemistry Marye Anne Fox, James K. Whitesell 2nd Edition 2001
- ^ Organic chemistry John McMurry 5th edition 2000
- ^ Concise Inorganic Chemistry J.D. Lee 4th Edition 1991
- ^ Kumar, Anmol; Gadre, Shridhar R.; Mohan, Neetha; Suresh, Cherumuttathu H. (6. 1. 2014). "Lone Pairs: An Electrostatic Viewpoint". The Journal of Physical Chemistry A (jezik: engleski). 118 (2): 526–532. Bibcode:2014JPCA..118..526K. doi:10.1021/jp4117003. ISSN 1089-5639. PMID 24372481.
- ^ Quin, L. D. (2000). A Guide to Organophosphorus Chemistry, LOCATION: John Wiley & Sons. ISBN 0471318248.
- ^ Stereochemistry of Ionic Solids J.D.Dunitz and L.E.Orgel, Advan. Inorg. and Radiochem. 1960, 2, 1–60
- ^ Payne, D. J. (2006). "Electronic Origins of Structural Distortions in Post-Transition Metal Oxides: Experimental and Theoretical Evidence for a Revision of the Lone Pair Model". Physical Review Letters. 96 (15): 157403. doi:10.1103/PhysRevLett.96.157403. PMID 16712195.
- ^ Walsh, Aron (2005). "The origin of the stereochemically active Pb(II) lone pair: DFT calculations on PbO and PbS". Journal of Solid State Chemistry. 178 (5): 1422–1428. Bibcode:2005JSSCh.178.1422W. doi:10.1016/j.jssc.2005.01.030.
- ^ Walsh, Aron (2005). "Influence of the Anion on Lone Pair Formation in Sn(II) Monochalcogenides: A DFT Study". The Journal of Physical Chemistry B. 109 (40): 18868–18875. doi:10.1021/jp051822r. PMID 16853428.
- ^ Gourlaouen, Christophe; Parisel, Olivier (15. 1. 2007). "Is an Electronic Shield at the Molecular Origin of Lead Poisoning? A Computational Modeling Experiment". Angewandte Chemie International Edition. 46 (4): 553–556. doi:10.1002/anie.200603037. PMID 17152108.
- ^ Jaffe, E. K.; Martins, J.; et al. (13. 10. 2000). "The Molecular Mechanism of Lead Inhibition of Human Porphobilinogen Synthase". Journal of Biological Chemistry. 276 (2): 1531–1537. doi:10.1074/jbc.M007663200. PMID 11032836.
- ^ Scinicariello, Franco; Murray, H. Edward; et al. (15. 9. 2006). "Lead and δ-Aminolevulinic Acid Dehydratase Polymorphism: Where Does It Lead? A Meta-Analysis". Environmental Health Perspectives. 115 (1): 35–41. doi:10.1289/ehp.9448. PMC 1797830. PMID 17366816.
- ^ Chhabra, Namrata (15. 11. 2015). "Effect of Lead poisoning on heme biosynthetic pathway". Clinical Cases: Biochemistry For Medics. Arhivirano s originala, 3. 4. 2016. Pristupljeno 30. 10. 2016.
- ^ Richards, Anne F.; Brynda, Marcin; Power, Philip P. (2004). "Effects of the alkali metal counter ions on the germanium–germanium double bond length in a heavier group 14 element ethenide salt". Chem. Commun. (14): 1592–1593. doi:10.1039/B401507J. PMID 15263933.
- ^ Power, Philip P. (decembar 1999). "π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements". Chemical Reviews. 99 (12): 3463–3504. doi:10.1021/cr9408989. PMID 11849028.
- ^ Vladimir Ya. Lee; Akira Sekiguchi (22. 7. 2011). Organometallic Compounds of Low-Coordinate Si, Ge, Sn and Pb: From Phantom Species to Stable Compounds. John Wiley & Sons. str. 23. ISBN 978-1-119-95626-6.
- ^ a b c d Spikes, Geoffrey H.; Power, Philip P. (2007). "Lewis base induced tuning of the Ge–Ge bond order in a "digermyne"". Chem. Commun. (1): 85–87. doi:10.1039/b612202g. PMID 17279269.
- ^ Power, Philip P. (2003). "Silicon, germanium, tin and lead analogues of acetylenes". Chemical Communications (17): 2091–101. doi:10.1039/B212224C. PMID 13678155.
- ^ A., Albright, Thomas (8. 4. 2013). Orbital interactions in chemistry. Burdett, Jeremy K., 1947-, Whangbo, Myung-Hwan (Second izd.). Hoboken, New Jersey. ISBN 9780471080398. OCLC 823294395.
- ^ Ansyln, E. V.; Dougherty, D. A. (2006). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. str. 41. ISBN 978-1-891389-31-3.
- ^ Clauss, Allen D.; Nelsen, Stephen F.; Ayoub, Mohamed; Moore, John W.; Landis, Clark R.; Weinhold, Frank (2014-10-08). "Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms". Chemistry Education Research and Practice (jezik: engleski). 15 (4): 417–434. doi:10.1039/C4RP00057A. ISSN 1756-1108.
- ^ Hiberty, Philippe C.; Danovich, David; Shaik, Sason (7. 7. 2015). "Comment on "Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms". A reply to a criticism". Chemistry Education Research and Practice (jezik: engleski). 16 (3): 689–693. doi:10.1039/C4RP00245H.