Serin/treonin-specifična protein-kinaza
Serine/treonin protein-kinaza ([[EC broj|EC 2.7.11.–) je kinazni enzim koji fosforilizira OH grupu serina ili treonin (koji imaju slične bočne lance). Najmanje 125 od 500+ lhidskih protein-kinaza su serin/treonin kinaze (STK).[2]
| Protein-serin/treonin-kinaze | |
|---|---|
 | |
| Identifikatori | |
| Simbol | ? |
| CAS broj | |

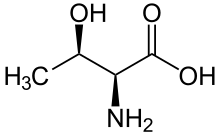
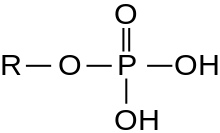

U enzimologiji, termin serin/treonin protein-kinaza opisuje klasu enzima u porodici transferaza, koje prenose fosfate na kisikov atom serinskog ili treoninskog bočnog lanca u proteina. Ovaj proces naziva se fosforilacija. Fosforilacija proteina posebno ima značajnu ulogu u širokom spektru ćelijskih procesa i veoma je važna posttranslacijska modifikacija.[3][4][5][6][7][8][9]
Hemijska reakcija koju vrše ovi enzimi može se zapisati kao:
- ATP + protein ADP + fosfoprotein
Dakle, dva supstrata ovog enzima su ATP i protein, dok su njegova dva proizvoda ADP i fosfoprotein.
Sistematski naziv ove klase enzima je nespecifična ATP: protein fosfotransferaza.
Regulacija
urediReceptori serin/treonin kinaze imaju ulogu u regulaciji ćelijske proliferacije, programirane ćelijske smrti (apoptoza), diferencijaciji ćelija i razvoju embriona.
Selektivnost
urediDok serin/treonin kinaze sve fosforiliraju ostatke serina ili treonina u svojim supstratima, oni biraju specifične ostatke za fosforilaciju na osnovu ostataka koji okružuju fosfoakceptorsko mjesto, a koji zajedno čine konsenzusnu sekvencu . Budući da konsenzusni ostaci ciljnog supstrata dolaze u kontakt samo sa nekoliko ključnih aminokiselina unutar katalitskih pukotina kinaze (obično kroz hidrofobne sile i ionske veze, kinaza obično nije specifična za jedan supstrat, ali umjesto toga može fosforilirati cijelu "porodicu supstrata" koji dijele zajedničke sekvence prepoznavanja. Dok je katalitski domen ovih kinaza visoko konzervirana, varijacija sekvence koja se uočava u kinomu (podskup gena u genomu koji kodira kinaze) omogućava prepoznavanje različitih supstrata. Većina kinaza je inhibirana pomoću pseudosubstrata koji se vezuje za kinazu kao pravi supstrat, ali nema aminokiselinu za fosforilaciju. Kada se pseudosubstrat ukloni, kinaza može obavljati svoju normalnu funkciju.
EC brojevi
urediMnoge serin/treonin protein-kinaze nemaju svoje individualne EC brojeva i koriste se "EC 2.7.11.1". Oni su ranije bili uključeni u EC broj "2.7.1.37", koji je bio opći EC broj za bilo koji enzim koji fosforilizira proteine dok pretvara ATP u ADP (tj. ATP:protein fosfotransferaze).
Tipovi
urediTipovi uključuju one koji djeluju direktno kao receptori (receptor protein serin/treonin kinaza) i unurarćelijski signalni peptidi i proteini. Od ovih potonjih, tipovi uključuju:
| EC broj | Naziv | Opis |
|---|---|---|
| 2.7.11.1 | CK2, Također poznat po pogrešnom nazivu kazein-kinaza 2 | Otkrili su ga 1954. Burnett i Kennedy. |
| 2.7.11.11 | Protein-kinaza A | Sastoji se od dva domena, malog sa nekoliko β struktura i većeg domena koji sadrži nekoliko α heliksa. Vezna mjesta za supstrat i ATP nalaze se u katalitskoj pukotini između domena (ili režnjeva). Kada se ATP i supstrat vežu, dva režnja rotiraju se tako da se terminalna fosfatna grupa ATP-a i ciljna aminokiselina supstrata pomiču u ispravne položaje za odvijanje katalitske reakcije. |
| 2.7.11.13 | Protein kinaza C ('PKC') | je zapravo porodica protein-kinaza koja se sastoji od ~10 izozima. Podijeljeni su u tri potporodic: konvencijskee (ili klasične), nove i atipske, na osnovu zahtjeva za drugim glasnicima. |
| 2.7.11.1 | Mos/Raf kinaze | Čine dio porodice MAPKK-kinaza i aktiviraju se faktorima rasta. Enzim djeluje tako da stimulira ćelijski rast. Raf inhibicija je postala meta za nove lijekove protiv metastatskih karcinoma jer inhibiraju MAPK-kaskadu i smanjuju proliferaciju ćelija. |
| 2.7.11.24 | Mitogen-aktivirana protein kinaza (MAPK) | reaguju na vanćelijske stimuluse (mitogene) i regulišu različite ćelijske aktivnosti, kao što su ekspresija gena, mitoza, diferencijacija i preživljavanje/apoptoza ćelija. |
| 2.7.11.17 | Ca2+/kalmodulin-zavisna protein kinaza ili CaM kinaze (CAMK) | Primarno su regulirani kompleksom Ca2+/kalmodulin. |
| 2.7.11.19 | Fosforilaza-kinaza | To je u stvari bila prva Ser/Thr protein-kinaza koja je otkrivena (1959., Krebs et al.). |
| 2.7.1.37 | Protein kinaza B, također poznata kao AKT kinaza | V-akt gen je identificiran kao onkogeni retrovirus AKT8. Gen kodira protein-kinazu. Ljudski homolozi onkogenog proteina AKT8 identifikovani su 1987. Do 1995. je otkriveno da Akt-kinaze funkcionišu kao kinaze aktivirane mitogenom nizvodno od receptora na površini ćelije koji aktiviraju fosfoinozitid 3-kinazu. Postoje tri ljudska akt gena. Sve tri Akt kinaze regulišu proliferaciju ćelija, a Akt2 je posebno važan za delovanje insulina u ćelijama. Glavna meta Akt kinaza je kinaza glikogen sintaze-3. |
| 2.7.1.37 | Pelle | To je serin/treonin kinaza koja može sama sebe da fosforilira, kao i Tube i Toll. |
Klinički značaj
urediEkspresija serin/treonin kinaze (STK) je promijenjena kod mnogih tipova raka.[2] Limited benefit of serine/threonine kinase inhibitors has been demonstrated in ovarian cancer[10] ali su u toku studije za procjenu njihove sigurnosti i efikasnosti.
Serin/treonin protein kinaza p90-kDa ribosomsks S6 kinaza (RSK) uključena je u razvoj nekih karcinoma prostate.[11]
Raf inhibicija je postala meta za nove lijekove protiv metastatskog ksncera, jer inhibiraju MAPK kaskadu i smanjuju proliferaciju ćelija.
Također pogledajte
uredi- Protein serin/treonin fosfataza, enzim za obrnuti proces.
- Pseudokinaza, protein bez enzimske aktivnosti (pseudoenzim). Može se povezati sa proteinima ove klase.
- ATM serin/treonin kinaza, odgovorna za poremećaj ataksija–telangiektazija.
Reference
uredi- ^ Nowakowski, J.; Cronin, C. N.; McRee, D. E.; Knuth, M. W.; Nelson, C. G.; Pavletich, N. P.; Rogers, J.; Sang, B. C.; Scheibe, D. N.; Swanson, R. V.; Thompson, D. A. (2002). "Structures of the cancer-related Aurora-A, FAK, and EphA2 protein kinases from nanovolume crystallography". Structure. 10 (12): 1659–1667. doi:10.1016/S0969-2126(02)00907-3. PMID 12467573.
- ^ a b Capra, Maria; Nuciforo, Paolo Giovanni; Confalonieri, Stefano; Quarto, Micaela; Bianchi, Marco; Nebuloni, Manuela; Boldorini, Renzo; Pallotti, Francesco; Viale, Giuseppe; Gishizky, Mikhail L.; Draetta, Giulio F.; Fiore, Pier Paolo Di (15. 8. 2006). "Frequent Alterations in the Expression of Serine/Threonine Kinases in Human Cancers". Cancer Research. 66 (16): 8147–8154. doi:10.1158/0008-5472.CAN-05-3489. PMID 16912193.
- ^ Damuni Z, Reed LJ (1988). "Purification and properties of a protamine kinase and a type II casein kinase from bovine kidney mitochondria". Arch. Biochem. Biophys. 262 (2): 574–84. doi:10.1016/0003-9861(88)90408-0. PMID 2835010.
- ^ Baggio B, Pinna LA, Moret V, Siliprandi N (1970). "A simple procedure for the purification of rat liver phosvitin kinase". Biochim. Biophys. Acta. 212 (3): 515–7. doi:10.1016/0005-2744(70)90261-5. PMID 5456997.
- ^ Jergil B, Dixon GH (1970). "Protamine kinase from rainbow trout testis. Partial purification and characterization". J. Biol. Chem. 245 (2): 425–34. doi:10.1016/S0021-9258(18)63408-8. PMID 4312674.
- ^ Langan TA (1969). "Action of adenosine 3',5'-monophosphate-dependent histone kinase in vivo". J. Biol. Chem. 244 (20): 5763–5. doi:10.1016/S0021-9258(18)63626-9. PMID 4310608.
- ^ Takeuchi M, Yanagida M (1993). "A mitotic role for a novel fission yeast protein kinase dsk1 with cell cycle stage dependent phosphorylation and localization". Mol. Biol. Cell. 4 (3): 247–60. doi:10.1091/mbc.4.3.247. PMC 300923. PMID 8485317.
- ^ NF; Lützelberger, M; Weigmann, H; Klingenhoff, A; Shenoy, S; Käufer, NF (1997). "Functional analysis of the fission yeast Prp4 protein kinase involved in pre-mRNA splicing and isolation of a putative mammalian homologue". Nucleic Acids Res. 25 (5): 1028–35. doi:10.1093/nar/25.5.1028. PMC 146536. PMID 9102632.
- ^ Wang Y, Hofmann TG, Runkel L, Haaf T, Schaller H, Debatin K, Hug H (2001). "Isolation and characterization of cDNAs for the protein kinase HIPK2". Biochim. Biophys. Acta. 1518 (1–2): 168–72. doi:10.1016/S0167-4781(00)00308-0. PMID 11267674.
- ^ Ciccone, Marcia A.; Maoz, Asaf; Casabar, Jennifer K.; Machida, Hiroko; Mabuchi, Seiji; Matsuo, Koji (2. 7. 2016). "Clinical outcome of treatment with serine-threonine kinase inhibitors in recurrent epithelial ovarian cancer: a systematic review of literature". Expert Opinion on Investigational Drugs. 25 (7): 781–796. doi:10.1080/13543784.2016.1181748. PMC 7534810. PMID 27101098.
- ^ Clark, D. E.; Errington, T. M.; Smith, J. A.; Frierson, H. F.; Weber, M. J.; Lannigan, D. A. (15. 4. 2005). "The Serine/Threonine Protein Kinase, p90 Ribosomal S6 Kinase, Is an Important Regulator of Prostate Cancer Cell Proliferation". Cancer Research. 65 (8): 3108–3116. doi:10.1158/0008-5472.CAN-04-3151. PMID 15833840.
Vanjski linkovi
uredi- protein-serine-threonine kinases na US National Library of Medicine Medical Subject Headings (MeSH)
