Porodica Bcl-2
Proteinska porodica Bcl-2 (TC# 1.A.21) sastoji se od brojnih evolucijski konzerviranih proteina koji dijele Bcl-2 homologiju (BH) domena. Porodica Bcl-2 je najistaknutija po regulaciji apoptoze, oblika programirane ćelijske smrti, u mitohondrijama. Proteini porodice Bcl-2 sastoje se od članova koji promoviraju ili inhibiraju apoptozu i kontrolišu apoptozu, regulacijom permeabilizacije vanjske mitohondrijske membrane (MOMP), što je ključni korak u unutrašnjem putu apoptoze. U porodici Bcl-2 ukupno je identifikovano 25 gena, 2008.[2]
| Porodica Bcl-2 apoptoznih regulatornih proteina | |
|---|---|
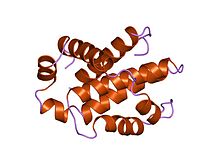 Struktura ljudskog Bcl-xL, inhibitora programirane ćelijske smrti.[1] | |
| Identifikatori | |
| Simbol | Bcl-2 |
Struktura
urediProteini iz porodice Bcl-2 imaju opću strukturu koja se sastoji od hidrofobne četiri α-heliksa okružena amfipatskim α-heliksom. Neki članovi porodice imaju transmembranski domen na svom C-kraju koji prvenstveno služi da ih lokalizuje u mitohondrije.
Bcl-x (L) je dug 233 aminokiselinska ostatka i pokazuje jedan vrlo hidrofobni pretpostavljeni transmembranski α-heliksni segment (ostaci 210–226) kada je u membrani. Homolozi Bcl-x uključuju proteine Bax (pacov; 192 aa) i Bak (miš; 208 aa), koji takođe utiču na apoptozu. Struktura visoke rezolucije monomernog rastvorljivog oblika ljudskog Bcl-x (L) određena je i rendgenskom kristalografijom i NMR-om.[4]
Struktura se sastoji od dva centralna primarno hidrofobna α-heliksa okružena amfipatskim spiralama. Raspored α-heliksa u Bcl-X (L) liči na onaj za difterijski toksin i kolicine. Toksin difterije stvara transmembranske pore i prenosi toksični katalitski domen u citoplazmu životinjske ćelije. Kolicini na sličan način formiraju pore u lipidnim dvoslojevima. Strukturna homologija stoga sugerira da članovi porodice Bcl-2 koji sadrže BH1 i BH2 domene (Bcl-X (L) Bcl-2 i Bax) funkcionišu slično.
Domeni
urediČlanovi porodice Bcl-2 dijele jednu ili više od četiri karakteristična homologna domena pod nazivom domeni Bcl-2 homologije (BH) (zvani BH1, BH2, BH3 i BH4) (vidi sliku). Poznato je da su BH domeni ključni za funkciju, jer delecija ovih domena putem molekulskog kloniranja utiče na stope preživljavanja/apoptoze. Antiapoptotski Bcl-2 proteini, kao što su Bcl-2 i Bcl-xL, konzerviraju sva četiri BH domena. BH domeni također služe za podjelu proapoptotskih Bcl-2 proteina na one sa nekoliko BH domena (npr. Bax i Bak) ili one proteine koji imaju samo BH3 domen (npr. Bim Bid i BAD)
Svi proteini koji pripadaju porodici Bcl-2[5] sadrže BH1, BH2, BH3 ili BH4 domen. Svi antiapoptotski proteini sadrže BH1 i BH2 domene, neki od njih sadrže i dodatni N-terminalni BH4 domen (Bcl-2, Bcl-x (L) i Bcl-w), koji je također javlja u nekim proapoptotskim proteinima, kao što su Bcl-x (S), Diva, Bok-L i Bok-S. S druge strane, svi proapoptotski proteini sadrže BH3 domen neophodan za dimerizaciju sa drugim proteinima iz porodice Bcl-2 i ključan za njihovu aktivnost ubijanja. Neki od njih sadrže i BH1 i BH2 domene (Bax i Bak). BH3 domen je takođe prisutan u nekim antiapoptotskim proteinima, kao što su Bcl-2 ili Bcl-x (L). Tri funkcionalno važne regije homologije Bcl-2 (BH1, BH2 i BH3) su u neposrednoj prostornoj blizini. Formiraju izduženi rascjep koji može pružiti mjesto vezivanja za druge članove porodice Bcl-2.
Funkcija
urediReguliaana ćelijska smrt (apoptoza) je izazvana događajima kao što su povlačenje faktora rasta i toksini. Kontrolišu ga regulatori, koji imaju ili inhibitorni efekat na programiranu ćelijsku smrt (antiapoptotski) ili blokiraju zaštitni efekat inhibitora (proapoptotski).[6][7] Mnogi virusi imaju način da se suprotstave defanzivnoj apoptozi, kodiranjem vlastitih antiapoptoznih gena koji sprječavaju da njihove ciljne ćelije uginu prerano.
Bcl-x je dominantni regulator programirane ćelijske smrti u ćelijama sisara.[8][9] Dugi oblik Bcl-x (L), pokazuje aktivnost represora ćelijske smrti, ali kratka izoforma (Bcl-x (S)) i β-izoforma (Bcl-xβ) promoviraju ćeliju smrt Bcl-x (L), Bcl-x (S) i Bcl-xβ su tri izoforme izvedene pomoću alternativne prerade RNK.
Postoji niz teorija o tome kako članovi porodice gena Bcl-2 ispoljavaju svoj pro- ili antiapoptotski efekt. Važno je da se to postiže aktivacijom ili inaktivacijom unutrašnje prelazne pore mitohondrijske permeabilnosti, koja je uključena u regulaciju matriksnog Ca2+, pH i napona. Također se smatra da neki proteini porodice Bcl-2 mogu inducirati (proapoptotski članovi) ili inhibirati (antiapoptotski članovi) oslobađanje citohroma c u citosol koji, kada se tamo nađe, aktivira kaspazu-9 i kaspazu-3, što dovodi do apoptoze. Iako je Zamzami et al. sugeriraju da je oslobađanje citohroma c indirektno posredovano PT-porama na unutrašnjoj mitohondrijskoj membrani,[10] jaki dokazi upućuju na raniju implikaciju MAC pora na vanjskoj membrani.[11][12]
Druga teorija sugerira da Rho proteini imaju ulogu u aktivaciji Bcl-2, Mcl-1 i Bid. Rho inhibicija smanjuje ekspresiju antiapoptotskih Bcl-2 i Mcl-1 proteina i povećava nivoe proteina pro-apoptotskog Bid, ali nije imala efekta na nivoe Bax ili FLIP. Rho inhibicija inducira apoptozu zavisnu od kaspaze-9 i kaspaze-3 kultiviranih ljudskih endotelnih ćelija.[13]
Mjesto aktivnosti
urediOvi proteini nalaze se na vanjskoj mitohondrijskoj membrani životinjske ćelije, gdje se smatra da formiraju kompleks sa anionskim kanalom zavisnim od porina (VDAC). Interakcija Bcl-2 sa VDAC1 ili sa peptidima izvedenim iz VDAC3 štiti od ćelijske smrti, inhibiranjem oslobađanja citohroma c. Pokazana je direktna interakcija Bcl-2 sa dvoslojno rekonstituisanim pročišćenim VDAC-om, pri čemu Bcl-2 smanjuje provodljivost kanala.[14]
Unutar mitohondrija nalaze se apoptogeni faktori (citohrom c, Smac / (Diablo homolog, Omi) koji ako se oslobode aktiviraju izvršitelje apoptoze, kaspaze.[15] Ovisno o njihovoj funkciji, aktivirani, Bcl-2 proteini ili pospješuju oslobađanje ovih faktora, ili ih zadržavaju sekvestriranim u mitohondrijima. Dok bi aktivirani pro-apoptotski Bak i/ili Bax formirali MAC i posredovali u oslobađanju citohroma c, antiapoptotski Bcl-2 bi ga blokirao, vjerovatno inhibicijom Bax i/ili Bak.[16]
Proteini iz porodice Bcl-2 su takođe prisutni u perijetarnom omotaču i široko su raspoređeni u mnogim tjelesnim tkivima. Njihova sposobnost da formiraju oligomerne pore u vještačkim lipidnim dvoslojevima je dokumentovana, ali fiziološki značaj formiranja pora nije jasan. Svaki od ovih proteina ima karakteristična svojstva, uključujući određeni stepen ionske selektivnosti.[17]
Transportna reakcija
urediGeneralizirana transportna reakcija predložena za oligomerne članove porodice Bcl-2 ugrađene u membranu je:
- citohrom c (mitohondrijski međumbranski prostor) ⇌ citohrom c (citoplazma)
Jedina porodica BH3
urediPodskup Bcl-2 porodice proteina koji sadrži samo BH3 sadrži samo jedan BH3-domen. Ovi članovi BH3 imaju ključnu ulogu u promoviranju apoptoze. Jdini članovi porodice BH3 su Bim, Bid, BAD i drugi. Različiti apoptotski stimulansi indukuju ekspresiju i/ili aktivaciju specifičnih članova porodice koji imaju samo BH3, koji se translociraju u mitohondrije i iniciraju Bax/Bak-zavisnu apoptozu.[18]
Primjeri
urediProteini za koje je poznato da sadrže ove domene uključuju Bcl-2 kičmenjaka (alfa i beta izoforme) i Bcl-x (izoforme Bcl-x (L)).
Također pogledajte
uredi- Bcl-2 inhibitor, lijekovi protiv karcinoma usmjereni na ovu porodicu proteina
- B-ćelijski CLL / limfom, šira grupa
Reference
uredi- ^ Muchmore SW, Sattler M, Liang H, et al. (maj 1996). "X-ray and NMR structure of human Bcl-xL, an inhibitor of programmed cell death". Nature. 381 (6580): 335–41. Bibcode:1996Natur.381..335M. doi:10.1038/381335a0. PMID 8692274. S2CID 4279148.
- ^ Youle, Richard J.; Strasser, Andreas (2008). "The BCL-2 protein family: opposing activities that mediate cell death". Nature Reviews Molecular Cell Biology. 9 (1): 47–59. doi:10.1038/nrm2308. PMID 18097445. S2CID 7033834.
- ^ Chao DT, Korsmeyer SJ (1998). "BCL-2 family: regulators of cell death". Annu. Rev. Immunol. 16: 395–419. doi:10.1146/annurev.immunol.16.1.395. PMID 9597135.
- ^ Muchmore, S. W.; Sattler, M.; Liang, H.; Meadows, R. P.; Harlan, J. E.; Yoon, H. S.; Nettesheim, D.; Chang, B. S.; Thompson, C. B. (23. 5. 1996). "X-ray and NMR structure of human Bcl-xL, an inhibitor of programmed cell death". Nature. 381 (6580): 335–341. Bibcode:1996Natur.381..335M. doi:10.1038/381335a0. ISSN 0028-0836. PMID 8692274. S2CID 4279148.
- ^ Reed JC, Zha H, Aime-Sempe C, Takayama S, Wang HG (1996). Structure-function analysis of Bcl-2 family proteins. Regulators of programmed cell death. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. 406. str. 99–112. doi:10.1007/978-1-4899-0274-0_10. ISBN 978-1-4899-0276-4. PMID 8910675.
- ^ Vaux DL (1993). "A boom time for necrobiology". Curr. Biol. 3 (12): 877–878. doi:10.1016/0960-9822(93)90223-B. PMID 15335822. S2CID 9638716.
- ^ Milliman CL, Korsmeyer SJ, Wang K, Yin XM, Chao DT (1996). "BID: a novel BH3 domain-only death agonist". Genes Dev. 10 (22): 2859–2869. doi:10.1101/gad.10.22.2859. PMID 8918887.
- ^ Boise, L. H.; González-García, M.; Postema, C. E.; Ding, L.; Lindsten, T.; Turka, L. A.; Mao, X.; Nuñez, G.; Thompson, C. B. (27. 8. 1993). "bcl-x, a bcl-2-related gene that functions as a dominant regulator of apoptotic cell death" (PDF). Cell. 74 (4): 597–608. doi:10.1016/0092-8674(93)90508-n. hdl:2027.42/30629. ISSN 0092-8674. PMID 8358789. S2CID 13542617.
- ^ Tsujimoto, Y.; Shimizu, S. (21. 1. 2000). "Bcl-2 family: life-or-death switch". FEBS Letters. 466 (1): 6–10. doi:10.1016/s0014-5793(99)01761-5. ISSN 0014-5793. PMID 10648802. S2CID 29229869.
- ^ Zamzami N, Brenner C, Marzo I, Susin SA, Kroemer G (april 1998). "Subcellular and submitochondrial mode of action of Bcl-2-like oncoproteins". Oncogene. 16 (17): 2265–82. doi:10.1038/sj.onc.1201989. PMID 9619836.
- ^ Kinnally KW, Antonsson B (maj 2007). "A tale of two mitochondrial channels, MAC and PTP, in apoptosis". Apoptosis. 12 (5): 857–68. doi:10.1007/s10495-007-0722-z. PMID 17294079.
- ^ Martinez-Caballero S, Dejean LM, Jonas EA, Kinnally KW (juni 2005). "The role of the mitochondrial apoptosis induced channel MAC in cytochrome c release". J. Bioenerg. Biomembr. 37 (3): 155–64. doi:10.1007/s10863-005-6570-z. PMID 16167172. S2CID 27152003.
- ^ Hippenstiel S, Schmeck B, N'Guessan PD, Seybold J, Krüll M, Preissner K, Eichel-Streiber CV, Suttorp N (oktobar 2002). "Rho protein inactivation induced apoptosis of cultured human endothelial cells". Am. J. Physiol. Lung Cell Mol. Physiol. 283 (4): L830–8. doi:10.1152/ajplung.00467.2001. PMID 12225960.
- ^ Arbel, Nir; Shoshan-Barmatz, Varda (26. 2. 2010). "Voltage-dependent anion channel 1-based peptides interact with Bcl-2 to prevent antiapoptotic activity". The Journal of Biological Chemistry. 285 (9): 6053–6062. doi:10.1074/jbc.M109.082990. ISSN 1083-351X. PMC 2825399. PMID 20037155.
- ^ Fesik SW, Shi Y (2001). "Controlling the caspases". Science. 294 (5546): 1477–1478. doi:10.1126/science.1062236. PMID 11711663. S2CID 11392850.
- ^ Dejean LM, Martinez-Caballero S, Manon S, Kinnally KW (februar 2006). "Regulation of the mitochondrial apoptosis-induced channel, MAC, by BCL-2 family proteins". Biochim. Biophys. Acta. 1762 (2): 191–201. doi:10.1016/j.bbadis.2005.07.002. PMID 16055309.
- ^ Antonsson, B.; Montessuit, S.; Lauper, S.; Eskes, R.; Martinou, J. C. (15. 1. 2000). "Bax oligomerization is required for channel-forming activity in liposomes and to trigger cytochrome c release from mitochondria". The Biochemical Journal. 345 (2): 271–278. doi:10.1042/0264-6021:3450271. ISSN 0264-6021. PMC 1220756. PMID 10620504.
- ^ Michael Kastan; Abeloff, Martin D.; Armitage, James O.; Niederhuber, John E. (2008). Abeloff's clinical oncology (4th izd.). Philadelphia: Churchill Livingstone/Elsevier. ISBN 978-0-443-06694-8.
Vanjski linkovi
uredi- The BCL-2 Database Arhivirano 23. 10. 2013. na Wayback Machine, the reference database on BCL-2 proteins
As of ovo uređivanje, ovaj članak koristi sadžaj iz "1.A.21 The Bcl-2 (Bcl-2) Family", koji je licenciran na način da dozvoljava korištenje pod Creative Commons Attribution-ShareAlike 3.0 Unported License, ali ne pod GFDL. Svi odgovarajući uslovi moraju biti praćeni.