Motilin
Motilin je 22-aminokiselinski polipeptidni hormon porodice motilina, kojeg, kod čovjeka, koodira gen MLN.[2]
| Motilin/grelin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura motilina u u izotropnom fosfolipidnom izotropnom rastvoru[1] | |||||||||
| Identifikatori | |||||||||
| Simbol | MTL | ||||||||
| Pfam | PF04644 | ||||||||
| InterPro | IPR006738 | ||||||||
| SCOP2 | 1lbj / SCOPe / SUPFAM | ||||||||
| OPM superporodica | 145 | ||||||||
| OPM protein | 1lbj | ||||||||
| |||||||||
| Motilin | |||||||
|---|---|---|---|---|---|---|---|
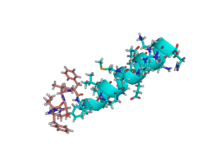 NMR struktura rastvora motilina u bicelarnom rastvoru fosfolipida.[1] | |||||||
| Identifikatori | |||||||
| Simbol | MLN | ||||||
| NCBI gen | 4295 | ||||||
| HGNC | 7141 | ||||||
| OMIM | 158270 | ||||||
| PDB | 1lbj | ||||||
| RefSeq | NM_001040109 | ||||||
| UniProt | P12872 | ||||||
| Ostali podaci | |||||||
| Lokus | Hrom. 6 p21.3-p21.2 | ||||||
| |||||||
Motilin luče endokrine Mo-ćelije[3][4] (ili M-ćelije, koje nisu isto kao što su Microfoldove ćelije (M-ćelije) u Preyerovom sloju) koji su brojni u kriptama tankog crijeva, posebno u dvanaestopalačnom crijevu i jejunumu.[5] Otpušta se u opću cirkulaciju kod ljudi u intervalima od oko 100 minuta, tokom međudigestivnog stanja i najvažniji je faktor u kontroli međudigesantnih pokretnih kontrakcija; također stimulira endogeno oslobađanje iz endokrinog dijela gušterače.[6] Na osnovu aminokiselinske sekvence, motilin nije povezan sa drugim hormonima. Zbog sposobnosti da stimulira želučanu aktivnost, nazvan je "motilin". Osim kod ljudi, motilinski receptor je identificiran u gastrointestinalnim traktovima svinja, pacova, krava i mačaka, te u centralnom nervnom sistemu kunića.
Otkriće
urediMotilin je otkrio J.C. Brown kada je uveo alkalni rastvor u duodenum pasa, što je uzrokovalo jake želučane kontrakcije. Brown et al. predvidili su da alkalija može osloboditi stimulus za aktiviranje motorne aktivnosti ili spriječiti lučenje hormona koji inhibira. Izolovali su polipeptid kao nusproizvod pročišćavanja sekretina na karboksimetil celulozi. Ovaj polipeptid nazvali su motilin.[7]
Struktura
urediMotilin ima 22 aminokiseline i molekulska težina od 2.698 daltona. U ekstraktu iz ljudskog crijeva i plazme postoje dva osnovna oblika motilina. Prvi molekulski oblik je polipeptid od 22 aminokiseline. S druge strane, drugi oblik je veći i sadrži istih 22 aminokiselina kao i prvi oblik, ali uključuje dodatni kraj karboksilnog završetka .[8]
Sekvence aminokiselina motilina su: Phe - Val - Pro - Ile - Phe - Thr - Tyr - Gly - Glu - Leu - Gln - Arg - Met - Gln-Glu - Lys - Glu-Arg - Asn - Lys-Gly-Gln.[9]
Struktura i dinamika gastrointestinalnog peptidnog hormona motilina proučavani su u prisustvu izotropnog bicelnog q = 0,5 fosfolipida. Struktura NMR rastvora peptida u kiseloj bicelnoj otopini određena je prema203 ograničenja udaljenosti izvedenih iz NOE i šest ograničenja torzionog ugla. Dinamička svojstva za 13Cα→1H vektor u Leu-10 određena su za motilin koji je posebno obilježen sa 13C na ovom položaju, analizom podataka o relaksaciji više polja. Struktura otkriva uređen alfa heliksnu konformaciju između Glu-9 i Lys-20. N-kraj je također dobro strukturiran sa zaokretom sličnim onom klasičnog beta-obrta. Dinamika 13C jasno pokazuje da motilin polahko opada u rastvoru, sa vremenom korelacije koji je karakterističan za veliki objekt.[1]
Stimulans
urediKontrola lučenja motilina uglavnom je nepoznata, iako neka istraživanja sugeriraju da alkalni pH u dvanaestopalačnom crijevu stimulira njegovo oslobađanje. Međutim, pri niskom pH inhibira motornu aktivnost želuca, dok pri visokom pH ima stimulativni učinak. Neke studije na psima, pokazale su da se motilin oslobađa tokom posta ili interdigestivnog perioda, a unos hrane tokom tog perioda može spriječiti njegovo lučenje.[10] Intravenska injekcija glukoze, koja povećava oslobađanje insulina, takođe inhibira ciklično povišenje motilina u plazmi.[11] Druge studije na psima također sugeriraju da je motilin djelovao kao endogeni ligand u mehanizmu pozitivne povratne sprege da stimulira oslobađanje više motilina.[12]
Funkcija
urediGlavna funkcija motilina je povećanje komponente migrirajućeg mioelektričnog kompleksa gastrointestinalne pokretljivosti i stimuliranje proizvodnje pepsina. Motilin se označava i kao "crijevni domar", jer poboljšava peristaltiku u tankom crijevu i čisti crijeva kako bi se pripremila za sljedeći obrok.[9] A visok nivo motilina, koji se luči u krvi između obroka, stimulira kontrakciju fundusa i antruma i ubrzava pražnjenje želuca. Zatim kontrahira žučni mjehur i povećava pritisak stiskanja donjeg sfinktera jednjaka. Ostale funkcije motilina uključuju povećanje oslobađanja polipeptida gušterače i somatostatina.[13]
Agonisti motilina
urediEritromicin i srodni antibiotici djeluju kao nepeptidni motilinski agonisti, a ponekad se koriste zbog svoje sposobnosti da stimuliraju gastrointestinalnu pokretljivost. U slučaju eritromicina, on je njegov hemiketalni intermedijar, nastao nakon oralne doze u niskom pH okruženju lumena želuca, koji direktno djeluje na motilinski receptor.[14] Primjena male doze eritromicina inducirat će peristaltiku, što pruža dodatnu potporu zaključku da sekrecija motilina pokreće ovaj obrazac gastrointestinalne pokretljivosti, a ne kao posladica toga. Međutim, neka svojstva eritromicina, uključujući antibiotsku aktivnost, nisu prikladna za lijek dizajniran za hroničnu upotrebu tokom života pacijenta.
Novi agonisti motilina su na bazi eritromicina; međutim, može biti da ova klasa droga postane suvišna. Receptori hormona rasta sekretagoga imaju 52% svoje DNK iste kao motilinski receptor, a agonisti ovih receptora, nazvani grelini, mogu postići slične efekte kao agonisti motilina.
Kamicinal je agonist motilina u razvoju.
Srodni peptidi
urediOvaj domen se takođe nalazi u grelinu, sekretagogi hormona rasta, kojeg sintetiziraju endokrine ćelije u želucu. U hipofizi, grelin stimulira receptore sekretagoga hormona rasta. Ovi se receptori razlikuju od receptora za oslobađanje hormona rasta i, prema tome, pružaju sredstvo za kontrolu oslobađanja hormona rasta hipofize u gastrointestinalnom sistemu.[15] U pražnjenju želuca, eritromicin ima prednost u odnosu na metoklopramid, zbog nedostatka nuspojava u centralnom nervnom sistemu. FDA ga ne odobrava upotrebu za pražnjenje želuca. Može se koristiti kratkotrajno, za pacijente s dijabetesom i za one koji moraju pročistiti želudac za bilo koji postupak, na osnovu diskrecionog prava liječnika, a uz potpuno razumijevanje da ga FDA za ovu upotrebu nije odobrila.
Reference
uredi- ^ a b c PDB-1lbj; Andersson A, Mäler L (oktobar 2002). "NMR solution structure and dynamics of motilin in isotropic phospholipid bicellar solution". Journal of Biomolecular NMR. 24 (2): 103–12. doi:10.1023/A:1020902915969. PMID 12495026.
- ^ Daikh DI, Douglass JO, Adelman JP (oktobar 1989). "Structure and expression of the human motilin gene". DNA. 8 (8): 615–21. doi:10.1089/dna.1989.8.615. PMID 2574660.
- ^ Daniel EE (11. 12. 1990). Neuropeptide Function in the Gastrointestinal Tract. CRC Press. ISBN 9780849361586.
- ^ Goswami C, Shimada Y, Yoshimura M, Mondal A, Oda S, Tanaka T, Sakai T, Sakata I (26. 6. 2015). "Motilin Stimulates Gastric Acid Secretion in Coordination with Ghrelin in Suncus murinus". PLOS ONE. 10 (6): e0131554. Bibcode:2015PLoSO..1031554G. doi:10.1371/journal.pone.0131554. PMC 4482737. PMID 26115342.
- ^ Poitras P, Peeters TL (februar 2008). "Motilin". Current Opinion in Endocrinology, Diabetes and Obesity. 15 (1): 54–7. doi:10.1097/MED.0b013e3282f370af. PMID 18185063.
- ^ Itoh Z (1997). "Motilin and clinical application". Peptides. 18 (4): 593–608. doi:10.1016/S0196-9781(96)00333-6. PMID 9210180.
- ^ Brown JC, Cook MA, Dryburgh JR (maj 1973). "Motilin, a gastric motor activity stimulating polypeptide: the complete amino acid sequence". Canadian Journal of Biochemistry. 51 (5): 533–7. doi:10.1139/o73-066. PMID 4706833.
- ^ DeGroot LJ (1989). McGuigan JE (ured.). Endocrinology. Philadelphia: Saunders. str. 2748. ISBN 978-0-7216-2888-2. CS1 održavanje: nepreporučeni parametar (link)
- ^ a b Williams RL (1981). Textbook of endocrinology (6th izd.). Philadelphia: Saunders. str. 704–705. ISBN 978-0-7216-9398-9. CS1 održavanje: nepreporučeni parametar (link)
- ^ Itoh Z, Takeuchi S, Aizawa I, Mori K, Taminato T, Seino Y, Imura H, Yanaihara N (oktobar 1978). "Changes in plasma motilin concentration and gastrointestinal contractile activity in conscious dogs". The American Journal of Digestive Diseases. 23 (10): 929–35. doi:10.1007/BF01072469. PMID 717352.
- ^ Lemoyne M, Wassef R, Tassé D, Trudel L, Poitras P (septembar 1984). "Motilin and the vagus in dogs". Canadian Journal of Physiology and Pharmacology. 62 (9): 1092–6. doi:10.1139/y84-182. PMID 6388765.
- ^ Hall KE, Greenberg GR, El-Sharkawy TY, Diamant NE (juli 1984). "Relationship between porcine motilin-induced migrating motor complex-like activity, vagal integrity, and endogenous motilin release in dogs". Gastroenterology. 87 (1): 76–85. doi:10.1016/0016-5085(84)90128-8. PMID 6724277.
- ^ Frohman LA, Felig P (2001). Ghosh PK, O'Dorisio TM (ured.). Endocrinology & metabolism. New York: McGraw-Hill, Medical Pub. Div. str. 1330. ISBN 978-0-07-022001-0. CS1 održavanje: nepreporučeni parametar (link)
- ^ Galligan JJ, Vanner S (oktobar 2005). "Basic and clinical pharmacology of new motility promoting agents". Neurogastroenterology and Motility. 17 (5): 643–53. doi:10.1111/j.1365-2982.2005.00675.x. PMID 16185302.
- ^ Kojima M, Hosoda H, Matsuo H, Kangawa K (april 2001). "Ghrelin: discovery of the natural endogenous ligand for the growth hormone secretagogue receptor". Trends in Endocrinology and Metabolism. 12 (3): 118–22. doi:10.1016/S1043-2760(00)00362-3. PMID 11306336.
Vanjski linkovi
uredi- Motilin na US National Library of Medicine Medical Subject Headings (MeSH)
- Nosek, Thomas M. "Section 6/6ch2/s6ch2_26". Essentials of Human Physiology. Arhivirano s originala, 24. 3. 2016.