Koneksin
Koneksini (Cx) (TC# 1.A.24), proteini pukotinskih veza su strukturno povezani transmembranski proteini, koji se okupljaju i tvore međućelijske spojeve kpd kičmenjaka. Potpuno druga porodica proteina, ineksini, formira pukotinske veze u beskičmenjacima.[1] Svaki pukotinski prostor sastoji se od dva hemikanala ili koneksona, koji se sastoji od homo– ili heteroheksamernih nizova koneksina, a konekson u jednoj plazmqmembrani pristaje jedan do drugog s koneksonom u membranama blisko susjednih ćelija. Hemikanal se sastoji od šest koneksinxskih podjedinica, od kojih se svaki sastoji od četiri transmembranske segmenta. Međućelijske veze pukotina bitni su za mnoge fiziološke procese, poput koordinirane depolarizacije srčanog mišića, pravilnog razvoja embriona i izvedenog odgovora u mikrovaskulaturi. Zato mutacije u genima koji kodiraju koneksin mogu dovesti do funkcionalnih i razvojnih abnormalnosti.
| Koneksin | |
|---|---|
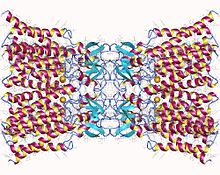 Koneksin-26 dodekamer: Uske međućelijske veze sastavljeno od dvanaest identičnih koneksinskih proteina, po šest u membrani svake ćelije. Svaka od ovih šest jedinica je jedan polipeptid koji prolazi membranu četiri puta (nazivaju se četveroprolazni transmembranski proteini).). | |
| Identifikatori | |
| Simbol | Connexin |
Nomenklatura
urediKoneksini se obično imenuju prema njihovoj molekularnoj težini, npr. Cx26 je protein koneksina od 26 kDa. Konkurentna nomenklatura je sistem protein pukotinska veza, gdje se koneksini razvrstavaju po svojim α (GJA) i β (GJB) oblicima, s dodatnim koneksinima grupiranim u C, D i E grupe, iza kojih slijedi identifikacijski broj, npr GJA1 odgovara Cx43. Nakon glasanja na Gap Junction konferenciji (2007.) u Elsinoreu, zajednica se složila da koristi sistem nomenklature GJ za gene koji kodiraju koneksine, ali je željela zadržati nomenklaturu koneksina za kodirane proteine, koristeći težinu ljudskog proteina za numeriranje ortolognih proteina.
Struktura
urediKoneksini sadrže četiri visoko uređena transmembranska segmenta (TMS), prvenstveno nestrukturirane C– i citoplazmatske završetke, citoplazmatsku petlju (CL) i dvije vanćelijske petlje, (EL-1) i (EL-2) . Koneksini su sastavljeni u grupama od po šest, kako bi formirali polukanale ili konekse, a dva hemikanala se zatim spajaju i tvore veznu pukotinu.
Dostupna je kristalna struktura veznog kanala s pukotinama koju je tvorio ljudski Cx26 (poznat i kao GJB2) rezolucije 3,5 Å.[2] Mapa gustoće pokazala je dva polukanala koji se protežu kroz membranu i raspored četiri TMS-a od šest protomera, koji tvore svaki hemikanal. Hemikaneli imaju pozitivno nabijen citoplazmatski ulaz, lijevak, negativno nabijen transmembranski put i vanćelijsku šupljinu. Pore se sužavaju na lijevku, koji je formiran od šest amino-terminalnih spirala koje oblažu zid kanala, čime se određuje ograničenje veličine molekula na ulazu u kanal.
Porodica koneksinskih gena je raznovrsna, sa dvadeset jednim identificiranim članom u sekvenciranom ljudskom genomu i dvadeset u mišjem (od kojih je devetnaest ortolognih parova). Obično teže između 25 i 60 kDa i imaju prosječnu dužinu od 380 aminokiselina. Uočeno je da se različiti koneksini spajaju u homomerne i heteromerne spojeve, od kojih svaki može pokazivati različita funkcionalna svojstva, uključujući vodljivost pora, selektivnost veličine, selektivnost naboja, naponske i hemijske rešetke.[3]
Biosinteza i internalizacija
urediIzuzetan aspekt koneksina je to što imaju relativno kratak poluživot od samo nekoliko sati.[4] Rezultat je prisutnost dinamičkog ciklusa, u kojem se koneksini sintetiziraju i zamjenjuju. Predloženo je da ovaj kratki životni vijek omogućava da se odvijaju preciznije regulirani fiziološki procesi, poput miometrije.
Funkcija
urediKoneksinske pukotinske međućelijske veze nalaze se samo u kičmenjaka, dok je funkcionalno analogna (ali genetiki nepovezana) grupa proteina, ineksina, odgovorna za pukotinske veze u beskičmenjaka. Ineksinski ortolozi su također identificirani u razredu Chordata, ali više nisu sposobni stvarati pukotinske veze. Umjesto toga, kanali koje tvore ovi proteini (zvani paneksini) djeluju kao vrlo velike transmembranske pore koje povezuju unutar- i vanćelijske odjele.
Unutar centralnog nervnog sistema, međućelijske pukotonske veze obezbeđuju električne sprege između progenitornih ćelija, neurona i glijinih ćelija. Korištenjem specifičnog koneksina nokaut-miševa, studije su otkrile da je spajanje ćelija bitno za vizuelnu signalizaciju. U retini, nivoi ambijentnog svjetla utiču na međućelijske veze, osiguravajućih vanjskih kanala, prilagođavajući vizuelnu funkciju različitim svjetlosnim uvjetima. Međuelijskomom spregom upravlja nekoliko mehanizama, uključujući ekspresiju koneksina.[5]
Decrock et al. raspravljali su o višerazinskoj platformi putem koje koneksini i paneksini mogu uticati na sljedeće ćelijske funkcije u tkivu: (1) spojni kanali koneksin-pukotina (GJC) omogućuju izravnu komunikaciju malih molekula u vezi ćelija-ćelija, (2) koneksinski hemikanali i kanali paneksina mogu pridonijeti do autokrine/parakrinih signalizacijskih puteva i (3) različiti strukturi domeni ovih proteina omogućavaju funkcije nezavisne od kanala, kao što je adhezija ćelija-ćelija, interakcije sa citoskeletom i aktivacija unutarćelijskih signalnih puteva.[6] Dakle, koneksini i paneksini imaju višestruki doprinos razvoju mozga i specifičnim procesima u neuro-glio-vaskularnoj jedinici, uključujući sinapsnu transmisiju i plastičnost, signalizaciju glije, vazomotornu kontrolu i integritet krvno-moždane barijere u zrelom CNS-u.[6]
Transportna reakcija
urediTransportna reakcija koju kataliziraju koneksini je:
- Male molekule (citoplazma ćelije 1) ⇌ male molekule (citoplazma ćelije 2)
Ljudski koneksini i implikacije u bolesti
uredi| Koneksin | Gen | Lokacija i funkcija |
|---|---|---|
| Cx43 | GJA1 | Eksprimira se na površini vaskulature s aterosklerotskim plakom, a regulira se tokom ateroskleroze kod miševa. Može imati patološke efekte. Također se ispoljava između granulastnih ćelija, što je potrebno za proliferaciju. Normalno izražen u astrocitima, također otkriven u većini ljudskih astrocitoma i u astroglijinoj komponenti glioneuronskih tumora.[7] To je ujedno i glavni srčani koneksin, koji se uglavnom nalazi u komosrom dijelu miokarda.[8] Povezan s okulodentodigitnom displazijom. |
| Cx46 | GJA3 | |
| Cx37 | GJA4 | Izaziva se u glatkim mišićima krvnih žila tokom koronarne arteriogeneze. Cx37 mutacije nisu smrtonosne. Formira rascjep između oocita i granulsstih ćelija i potreban je za preživljavanje oocita |
| Cx40 | GJA5 | Selektivno se eksprimira u pretkomorskim miocitima. Odgovoran za posredovanje u koordiniranoj električnoj aktivaciji pretkomora.[9] |
| Cx33 | GJA6 (GJA6P) |
Ljudski pseudogen |
| Cx50 | GJA8 | Pukotinske veze između vodoravnih ćelija A-tipa u mrežnjači miša i kunića [10] |
| Cx59 | GJA10 | |
| Cx62 | GJA10 | Ljudski Cx62 usklađen je sa Cx57 (miša). Lokacija u vodoravnog B-ćelijskog tipa s aksonom u mrežnjačama kunića [11] |
| Cx32 | GJB1 | Glavna komponenta perifernog mijelina. Mutacije u ljudskom genu uzrokuju X-vezanu Charcot-Marie-Toothovu bolest, nasljednu neuropatiju. U normalnom ljudskom mozgu CX32 izražen u neuronima i oligodendrocitima.[7] |
| Cx26 | GJB2 | Mutiran u Vohwinkelovom sindroma kao i u bolesti sidrom keratitis–ihtioza–gluhoća. |
| Cx31 | GJB3 | Može biti pridružen sa Erythrokeratodermia variabilis. |
| Cx30.3 | GJB4 | Fonseca et al. potvrdili su ekspresiju Cx30.3 u timocitima.[12] Može biti povezana s Erythrokeratodermia variabilis. |
| Cx31.1 | GJB5 | |
| Cx30 | GJB6 | Mutiran u Cloustonovom sindromu (hidrotska ektodermna displazija) |
| Cx25 | GJB7 | |
| Cx45 | GJC1/GJA7 | Ljudske duktusne epitelne ćelije gušterače.[13] Pretkomorsko-komorski čvor node |
| Cx47 | GJC2/GJA12 | Eksprimiran u pukotinskim vezama oligodentrocita [14] |
| Cx31.3 | GJC3 | Ljudski ortolog mišje Cx29. Nije poznato da stvaraju pukotinske veze.[15] |
| Cx36 | GJD2/GJA9 | Funkcija beta-ćelija gušterače, posreduje u oslobađanju insulina. Neuroni širom centralnog nervnog sistem, gdje sinhronizuju neuronske aktivnosti.[16] |
| Cx31.9 | GJD3/GJC1 | |
| Cx39 | GJD4 | |
| Cx40.1 | GJD4 | |
| Cx23 | GJE1 |
Pukotinske veze bitne su za mnoge fiziološke procese, poput koordinirane depolarizacije srčanog mišića, pravilnog embrionskog razvoja i provedenog odgovora u mikrovaskulaturi. Iz tog razloga, delecija ili mutacija različitih koneksinske izoforme proizvode karakteristične fenotipove i patološka stanja.[17] Dok su mutacije u Cx43 uglavnom povezane s okulodentodigitalnom displazijom, mutacije Cx47 povezane su s sličnom Pelizaeus-Merzbacherovom bolesti i limfedemom. Cx40 mutacije uglavnom su povezane s pretkomorskom fibrilacijom. Mutacije u Cx37 još nisu opisane, ali su polimorfizmi u genu Cx37 upleteni u razvoj arterijske bolesti..[18]
Reference
uredi- ^ Lodish, Harvey F.; Arnold Berk; Paul Matsudaira; Chris A. Kaiser; Monty Krieger; Mathew P. Scott; S. Lawrence Zipursky; James Darnell (2004). Molecular Cell Biology (5th izd.). New York: W.H. Freeman and Company. str. 230–1. ISBN 0-7167-4366-3.
- ^ Maeda S, Nakagawa S, Suga M, Yamashita E, Oshima A, Fujiyoshi Y, Tsukihara T (April 2009). "Structure of the connexin 26 gap junction channel at 3.5 A resolution". Nature. 458 (7238): 597–602. doi:10.1038/nature07869. ISSN 1476-4687. PMID 19340074. S2CID 4431769.
- ^ Ayad WA, Locke D, Koreen IV, Harris AL (June 2006). "Heteromeric, but not homomeric, connexin channels are selectively permeable to inositol phosphates". J. Biol. Chem. 281 (24): 16727–39. doi:10.1074/jbc.M600136200. ISSN 0021-9258. PMID 16601118.
- ^ Laird DW (March 2006). "Life cycle of connexins in health and disease". Biochem. J. 394 (Pt 3): 527–43. doi:10.1042/BJ20051922. PMC 1383703. PMID 16492141.
- ^ Kihara AH, de Castro LM, Moriscot AS, Hamassaki DE (May 2006). "Prolonged dark adaptation changes connexin expression in the mouse retina". J Neurosci Res. 83 (7): 1331–41. doi:10.1002/jnr.20815. PMID 16496335. S2CID 2919282.
- ^ a b Decrock E, De Bock M, Wang N, Bultynck G, Giaume C, Naus CC, Green CR, Leybaert L (August 2015). "Connexin and pannexin signaling pathways, an architectural blueprint for CNS physiology and pathology?". Cell. Mol. Life Sci. 72 (15): 2823–51. doi:10.1007/s00018-015-1962-7. ISSN 1420-9071. PMID 26118660. S2CID 17170098.
- ^ a b Aronica E, Gorter JA, Jansen GH, Leenstra S, Yankaya B, Troost D (May 2001). "Expression of connexin 43 and connexin 32 gap-junction proteins in epilepsy-associated brain tumors and in the perilesional epileptic cortex". Acta Neuropathol. 101 (5): 449–59. doi:10.1007/s004010000305. PMID 11484816. S2CID 6738913.
- ^ Verheule S, van Kempen MJ, te Welscher PH, Kwak BR, Jongsma HJ (May 1997). "Characterization of gap junction channels in adult rabbit atrial and ventricular myocardium". Circ. Res. 80 (5): 673–81. doi:10.1161/01.res.80.5.673. PMID 9130448.
- ^ Gollob MH, Jones DL, Krahn AD, Danis L, Gong XQ, Shao Q, et al. (June 2006). "Somatic mutations in the connexin 40 gene (GJA5) in atrial fibrillation". N. Engl. J. Med. 354 (25): 2677–88. doi:10.1056/NEJMoa052800. PMID 16790700.
- ^ Massey, Stephen (16 January 2009). Connexins: A Guide (1st izd.). Springer-Verlag Gmbh. str. 3–?. ISBN 978-1-934115-46-6.
- ^ Beyer, Eric C.; Berthound, Viviana M. (16 January 2009). Connexins: A Guide (1st izd.). Springer-Verlag Gmbh. str. 387–417. ISBN 978-1-934115-46-6.
- ^ Fonseca PC, Nihei OK, Urban-Maldonado M, Abreu S, de Carvalho AC, Spray DC, Savino W, Alves LA (June 2004). "Characterization of connexin 30.3 and 43 in thymocytes". Immunol. Lett. 94 (1–2): 65–75. doi:10.1016/j.imlet.2004.03.019. PMID 15234537.
- ^ Tai MH, Olson LK, Madhukar BV, Linning KD, Van Camp L, Tsao MS, Trosko JE (January 2003). "Characterization of gap junctional intercellular communication in immortalized human pancreatic ductal epithelial cells with stem cell characteristics". Pancreas. 26 (1): e18–26. doi:10.1097/00006676-200301000-00025. PMID 12499933. S2CID 34571252.
- ^ Kamasawa N, Sik A, Morita M, Yasumura T, Davidson KG, Nagy JI, Rash JE (2005). "Connexin-47 and connexin-32 in gap junctions of oligodendrocyte somata, myelin sheaths, paranodal loops and Schmidt-Lanterman incisures: implications for ionic homeostasis and potassium siphoning". Neuroscience. 136 (1): 65–86. doi:10.1016/j.neuroscience.2005.08.027. PMC 1550704. PMID 16203097.
- ^ Sargiannidou I, Ahn M, Enriquez AD, Peinado A, Reynolds R, Abrams C, Scherer SS, Kleopa KA (May 2008). "Human oligodendrocytes express Cx31.3: function and interactions with Cx32 mutants". Neurobiol. Dis. 30 (2): 221–33. doi:10.1016/j.nbd.2008.01.009. PMC 2704064. PMID 18353664.
- ^ Connors BW, Long MA (2004). "Electrical synapses in the mammalian brain". Annu. Rev. Neurosci. 27: 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Pfenniger A, Wohlwend A, Kwak BR (January 2011). "Mutations in connexin genes and disease". Eur. J. Clin. Invest. 41 (1): 103–16. doi:10.1111/j.1365-2362.2010.02378.x. ISSN 1365-2362. PMID 20840374. S2CID 24404442.
- ^ Molica F, Meens MJ, Morel S, Kwak BR (September 2014). "Mutations in cardiovascular connexin genes". Biol. Cell. 106 (9): 269–93. doi:10.1111/boc.201400038. PMID 24966059. S2CID 10070999.
Vanjski linkovi
uredi- Connexins na US National Library of Medicine Medical Subject Headings (MeSH)
As of ovo uređivanje, ovaj članak koristi sadžaj iz "1.A.24 The Gap Junction-forming Connexin (Connexin) Family", koji je licenciran na način da dozvoljava korištenje pod Creative Commons Attribution-ShareAlike 3.0 Unported License, ali ne pod GFDL. Svi odgovarajući uslovi moraju biti praćeni.