Ugljična kiselina
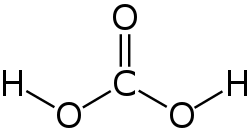
Ugljična kiselina je hemijski spoj sa hemijskom formulom H2CO3 (ekvivalentno: OC(OH)2). To je također naziv koji se ponekad daje rastvorima ugljik-dioksida u vodi (gazirana voda), jer takvi rastvori sadrže male količine H2CO3. U fiziologiji ugljična kiselina je opisana kao „isparljiva kiselina“ ili „respiratorna kiselina“, jer je jedina kiselina koja se plućima izlučuje kao plin.[2] Ima važnu ulogu u bikarbonatnom puferskom sistemu za održavanje kiselinsko-bazne homeostaze.
| Ugljična kiselina | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Ugljična kiselina |
| Druga imena | Rastrvor ugljik-dioksida Dihidrogen karbonat Vodik-bikarbonat Zračna kiselina Hidroksimetanska kiselina IUPAC ime: Karbonska kiselina[1] |
| Molekularna formula | CH2O3 /H2CO3 |
| CAS registarski broj | 463-79-6 |
| SMILES | O=C(O)O |
| InChI | 1/H2O3/c2-1(3)4/h(H2,2,3,4) |
| Osobine1 | |
| Gustoća | 1,668 g/cm3 |
| Rastvorljivost | Stabilna samo u rastvoru |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Ugljična kiselina, koja je slaba kiselina, tvori dvije vrste soli: karbonata i bikarbonata. U geologiji, ugljična kiselina uzrokuje rastvaranje krečnjaka, proizvodeći kalcij-bikarbonat, što dovodi do mnogih krečnjačkih strukturta, kao što su stalaktiti i stalagmiti.
Dugo se vjerovalo da ugljična kiselina ne može postojati kao čisti spoj. Međutim, 1991. godine objavljeno je da su Nasini naučnici uspjeli stvoriti uzorak čvrstog materijala H2CO3.[3]
Hemijska ravnoteža
urediKada se ugljik-dioksid otopi u vodi, on postoji u hemijskoj ravnoteži sa ugljičnom kiselinom:[4]
Hidratacijska konstanta ravnoteže na 25 °C naziva se Kh, što je u slučaju ugljične kiseline [H2CO3]/[CO2] ≈ 1,7 × 10 −3, u ćistoj vodi.[5] Stoga se većina ugljik-dioksida ne pretvara u ugljičnu kiselinu, ostajući kao molekuli CO2. U nedostatku katalizatora, ravnoteža se postiže prilično sporo. Konstante brzine su 0,039 s−1 za reakciju naprijed (CO2 + H2 Onbsp; → H2CO3 ) i 23 s−1 za obrnutu reakciju (H2CO3 → CO2 + H2O). Dodavanjem dva molekula vode u CO2 nastala bi ortokarbonska kiselina, C (OH)4, koja vodenom rastvoru postoji samo u malim količinama.
Dodavanjem baze suvišku ugljične kiseline dobija se bikarbonat (vodik-karbonat). Sa viškom baze, ugljiča kiselina reaguje dajući karbonatne soli.
Uloga ugljične kiseline u krvi
urediBikarbonat je međuprodukt u transportu CO2 iz tijela putem razmjene respiratornih plinova. Reakcija hidratacije CO2 je općenito vrlo spora u odsustvu katalizatora, ali crvene krvne ćelije sadrže enzim zvani karboanhidraza, koji povećava brzinu reakcije za 10.000 do 1.000.000 puta , proizvodeći bikarbonat (HCO3–) rastvoren u krvnoj plazmi.[6] Ova katalizirana reakcija obrnuta je onoj u u plućima, gdje se bikarbonat pretvara natrag u CO2 i omogućava njegovo izbacivanje. Ekvilibracija igra važnu ulogu kao pufer u krvi sisara.[7] Teorijski izvještaj iz 2016. sugerira da ugljična kiselina u krvnom serumu može imati ključnu ulogu u protoniranju različitih dušičnih baza.[8]
Uloga ugljične kiseline u hemiji okeana
urediOkeani svijeta apsorbirali su gotovo polovinu CO2 koju ljudi emituju izgaranjem fosilnih goriva.[9] Procjenjuje se da je dodstni rastvoreni ugljik-dioksid uzrokovao promjenu prosječnog pH površine okeana za oko &minus, 0,1 jedinica sa predindustrijskih nivoa. Ovo je poznato kao zakiseljavanje okeana, iako okean ostaje bazni.[10]
Kiselost ugljične kiseline
urediUgljična kiselina je karboksilna kiselina sa hidroksilnom grupom kao supstituentom. Također je poliprotonska kiselina: specifično je diprotonska i tako ima dva protona koji se mogu razdvojiti od matične molekule. Dakle, postoje dvije konstante disocijacije, od kojih je prva za disocijaciju u bikarbonat (koji se naziva i vodik-karbonatni) ion HCO3−:
- Ka1 = 2.5×10−4;[4] pKa1 = 3,6 na 25 °C.
Kada se navodi i koristi prva konstanta disocijacije ugljič kiseline, o tome se mora voditi računa. U vodenim rastvorima ugljična kiselina postoji u ravnoteži sa ugljik-dioksidom, a koncentracija H2CO3 je mnogo niža od koncentracije CO2. U mnogim analizama, H2CO3 uključuje otopljeni CO2 (naziva se CO2(aq)), H2CO3*, što se koristi za predstavljanje dvije vrste prilikom pisanja jednadžbe ravnoteže hemijske ravnoteže. Jednadžba se može prepisati na sljedeći način: [4]
- H2CO3*<=>HCO3− + H+
- Ka(app) = 4,47×10−7; pK(app) = 6,35 na 25 °C i ionska snaga = 0,0.
Dok se očigledni pKa citira kao konstanta disocijacije ugljične kiseline, dvosmislen je i možda bi se bolje mogao nazvati konstantom kiselosti otopljenog ugljik-dioksida., kao posebno korisno za izračunavanje pH rastvora koje sadrže CO2. Slična situacija odnosi se na sumporastu kiselinu (H2SO3), koja postoji u ravnoteži sa značajnim količinama nehidriranog sumpor-dioksida. Druga konstanta je za disocijaciju bikarbonatnog u karbonatni ion CO32−:
- Ka2 = 4,69×10−11; pKa2 = 10,329 na 25 °C a ionska snaga = 0,0.
Tri kiselinske konstantr definitrane su kako slijedi:
pH i sastav rastvora ugljične kiseline
urediSastav rastvora ugljične kiseline u potpunosti se određuje parcijalnim pritiskom ugljik-dioksida iznad rastvora. Da bi se izračunao sastav, mora se uzeti u obzir
- sljedeća ravnoteža između otopljenog CO2 i plinovitog CO2 iznad rastvora:
- CO2(plin) <=> CO2(rastvoren) sa
gdje where
- kH = 29,76 atm/(mol/L) (Henryjeva konstanta) na 25 °C
- ravnoteža hidratacije između otopljenih CO2 i H2CO3 sa konstantom (vidi gore)
- prva ravnoteža disocijacije ugljične kiseline (vidi gore Ka1)
- druga ravnoteža disocijacije ugljične kiseline (vidi gote Ka2)
- disocijacijska ravnotrža vode:
- uvjet neutralnosti naboja:
Pri izolaciji [HCO3−] u prvoj disocijacijskoj ravnoteži, [HCO32−] u drugoj didocijacijskoj ravnoteži i [OH−] u disocijacijskoj ravnoteži vode, zatim zamjenom sve tri naboja u uvjetima neutralnosti, dobija se kubna jednadžba u [H+], čiji rastvor daje vrijednosti pH i koncentracije različitih vrsta u sljedećoj tabeli. (druga ravnoteža disocijacije može se zanemariti za ovaj određeni problem, smanjujući kubnu jednadžbu na jednostavan kvadratni korijen; vidi napomene ispod tabele.)
| (atm) |
pH | [CO2] (mol/L) |
[H2CO3] (mol/L) |
[HCO3−] (mol/L) |
[CO32−] (mol/L) |
|---|---|---|---|---|---|
| 10−8 | 7,00 | 3,36 × 10−10 | 5,71 × 10−13 | 1,42 × 10−9 | 7,90 × 10−13 |
| 10−7 | 6,94 | 3,36 × 10−9 | 5,71 × 10−12 | 5,90 × 10−9 | 1,90 × 10−12 |
| 10−6 | 6,81 | 3,36 × 10−8 | 5,71 × 10−11 | 9,16 × 10−8 | 3,30 × 10−11 |
| 10−5 | 6,42 | 3,36 × 10−7 | 5,71 × 10−10 | 3,78 × 10−7 | 4,53 × 10−11 |
| 10−4 | 5,92 | 3,36 × 10−6 | 5,71 × 10−9 | 1,19 × 10−6 | 5,57 × 10−11 |
| 3.5 × 10−4 | 5,65 | 1,18 × 10−5 | 2,00 × 10−8 | 2,23 × 10−6 | 5,60 × 10−11 |
| 10−3 | 5,42 | 3,36 × 10−5 | 5,71 × 10−8 | 3,78 × 10−6 | 5,61 × 10−11 |
| 10−2 | 4,92 | 3,36 × 10−4 | 5,71 × 10−7 | 1,19 × 10−5 | 5,61 × 10−11 |
| 10−1 | 4,42 | 3,36 × 10−3 | 5,71 × 10−6 | 3,78 × 10−5 | 5,61 × 10−11 |
| 100 | 3,92 | 3,36 × 10−2 | 5,71 × 10−5 | 1,20 × 10−4 | 5,61 × 10−11 |
| 2.5 × 100 | 3,72 | 8,40 × 10−2 | 1,43 × 10−4 | 1,89 × 10−4 | 5,61 × 10−11 |
| 101 | 3,42 | 3,36 × 10−1 | 5,71 × 10−4 | 3,78 × 10−4 | 5,61 × 10−11 |
- U ukupnom opsegu pritiska, pH je uvijek mnogo niži od pKa2 (= 10,3) tako da je koncentracija CO 32− juvijek zanemariva s obzirom na koncentraciju HCO3–. U stvari, CO32− ne igra kvantitativnu ulogu u sadašnjem izračunu (vidi napomenu dolje).
- Za nestajanje , pH je sličan onom kod čiste vode (pH = 7), a rastvoreni ugljik je u osnovi u obliku HCO3−.
- Pri normalnim atmosferskim prilikama ( atm), dobija se blago kiseli rastvor (pH = 5,7), a otopljeni ugljen je sada u osnovi u obliku CO2 i HCO3−.
- Za pritisak CO2 tipski za gazirana pića u bocama ( ~ 2.5 atm), dobija se relativno kiseliji medij (pH =3,7) sa visokom koncentracijom rtastvorenog CO2. Ove osobine doprinose kiselkastom i reskom okusu ovih pića.
- Između 2,5 i 10 atm, pH prelazi vrijednost pKa1</sub (3,60), sa [H2CO3] > [HCO3−], pod visokim pritiskom.
- Grafikon ravnotežnih koncentracija ovih različitih oblika rastvorenog neorganskog ugljika (i koja vrsta je dominantna) u zavisnosti od pH otopine poznat je kao Bjerrumov grafikon.
Također pogledajte
urediReference
uredi- ^ "Front Matter". Nomenclature of Organic Chemistry: Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Acid-Base Physiology 2.1 – Acid-Base Balance by Kerry Brandis.
- ^ M. H. Moore; R. K. Khanna (1990). "Infrared and mass spectral studies of proton irradiated H2O + CO2 ice: Evidence for carbonic acid". Spectrochimica Acta Part A. 47 (2): 255–262. Bibcode:1991AcSpA..47..255M. doi:10.1016/0584-8539(91)80097-3.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.) p. 310. Butterworth-Heinemann. ISBN 978-0-08-037941-8.CS1 održavanje: upotreba parametra authors (link)
- ^ Soli, A. L.; R. H. Byrne (2002). "CO2 system hydration and dehydration kinetics and the equilibrium CO2/H2CO3 ratio in aqueous NaCl solution". Marine Chemistry. 78 (2–3): 65–73. doi:10.1016/S0304-4203(02)00010-5.
- ^ Lindskog S (1997). "Structure and mechanism of carbonic anhydrase". Pharmacology & Therapeutics. 74 (1): 1–20. doi:10.1016/S0163-7258(96)00198-2. PMID 9336012.
- ^ "Excretion". Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
- ^ "Reaction Mechanism for Direct Proton Transfer from Carbonic Acid to a Strong Base in Aqueous Solution I: Acid and Base Coordinate and Charge Dynamics", S. Daschakraborty, P. M. Kiefer, Y. Miller, Y. Motro, D. Pines, E. Pines, and J. T. Hynes. J. Phys. Chem. B (2016), 120, 2271.
- ^ Sabine, C. L.; et al. (2004). "The Oceanic Sink for Anthropogenic CO2". Science. 305 (5682): 367–371. Bibcode:2004Sci...305..367S. doi:10.1126/science.1097403. hdl:10261/52596. PMID 15256665. Arhivirano s " originala, July 6, 2008. CS1 održavanje: nepreporučeni parametar (link)
- ^ National Research Council. "Summary". Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: The National Academies Press, 2010. 1. Print.
Dopunska literatura
uredi- Welch, M. J.; Lifton, J. F.; Seck, J. A. (1969). "Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water". J. Phys. Chem. 73 (335): 3351. doi:10.1021/j100844a033.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 978-0-07-112651-9.
- Moore, M. H.; Khanna, R. (1991). "Infrared and Mass Spectral Studies of Proton Irradiated H2O+Co2 Ice: Evidence for Carbonic Acid Ice: Evidence for Carbonic Acid". Spectrochimica Acta Part A. 47A (2): 255–262. Bibcode:1991AcSpA..47..255M. doi:10.1016/0584-8539(91)80097-3.
- W. Hage, K. R. Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Carbonic Acid in the Gas Phase and Its Astrophysical Relevance". Science. 279 (5355): 1332–1335. Bibcode:1998Sci...279.1332H. doi:10.1126/science.279.5355.1332. PMID 9478889.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1995). "A Polymorph of Carbonic Acid and Its Possible Astrophysical Relevance". J. Chem. Soc. Faraday Trans. 91 (17): 2823–2826. Bibcode:1995JCSFT..91.2823H. doi:10.1039/ft9959102823.
Vanjski linkovi
uredi- Ask a Scientist: Carbonic Acid Decomposition (archive)
- Why was the existence of carbonic acid unfairly doubted for so long?
- Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- How to calculate concentration of Carbonic Acid in Water