Sangerovsko sekvenciranje
Sangerovsko sekvenciranje ili Sangerov metod je postupak DNK sekvenciranje koji uključuje elektroforezu i zasniva se na nasumičnoj inkorporaciji didezoksinukleotida koji završavaju lanac putem DNK-polimeraze tokom DNK replikacija in vitro. Nakon što su ga prvi razvili Frederick Sanger i kolege 1977. godine, postao je najčešće korišten metod sekvenciranja otprilike 40 godina. Prvi put ga je komercijalizirao Applied Biosystems 1986. U skorije vrijeme, Sangerovsko sekvenciranje većeg obima zamijenjeno je sekvenciranjem metodima sljedeće generacije, posebno za velike, automatizirane genomske analize. Međutim, Sangerova metod ostaje u širokoj upotrebi za manje projekte i za validaciju rezultata dubokog sekvenciranja. I dalje ima prednost u odnosu na tehnologije sekvenciranja kratkog čitanja (kao što je Illumina), u tome što može proizvesti očitavanje DNK sekvence od > 500 nukleotida i održava vrlo nisku stopu greške sa tačnošću od oko 99,99%.[1] Sangerovo sekvenciranje se još uvijek aktivno koristi u naporima za javnozdravstvene inicijative kao što je sekvenciranje šiljastog proteina iz SARS-CoV-2[2] kao i za nadzor izbijanja norovirusa kroz CaliciNet mrežu nadzora Centra za kontrolu i prevenciju bolesti (CDC).[3]
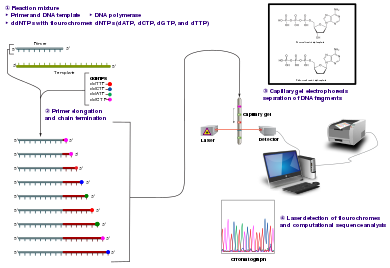
Metod
urediKlasični metod završetka lanca zahtijeva jednolančani DNK šablon, DNK prajmer, DNK-polimerazaDNK-polierfazu, normalne dezoksinukleotidne trifosfate (dNTP-e) i modificirane didezoksinukleotidne trifosfate (ddNTPs), od kojih potonji završavaju produžavanje lanca DNK. Ovim nukleotidima koji završavaju lanac nedostaje 3'-OH grupa potrebna za formiranje fosfodiesteske veze između dva nukleotida, što uzrokuje da DNK-polimeraza prestane sa produžavanjem DNK kada se ugradi modificirani ddNTP. ddNTP-ovi mogu biti radioaktivno ili fluorescentno označeni za detekciju u automatizovanim mašinama za sekvenciranje.
Uzorak DNK je podijeljen u četiri odvojene reakcije sekvenciranja, koje sadrže sva četiri standardna dezoksinukleotida (dATP, dGTP, dCTP i dTTP) i DNK-polimerazu. Svakoj reakciji se dodaje samo jedan od četiri didezoksinukleotida (ddATP, ddGTP, ddCTP ili ddTTP), dok su ostali dodati nukleotidi obični. Koncentracija dezoksinukleotida bi trebala biti približno 100 puta veća od one odgovarajućeg didezoksinukleotida (npr. 0,5 mM dTTP : 0,005 mM ddTTP), kako bi se omogućilo da se proizvede dovoljno fragmenata, dok se još uvijek prepisuje kompletna sekvenca (ali koncentracija ddNTP također ovisi o željenom dužina sekvence).[4] Stavljajući to u razumniji red, četiri odvojene reakcije su potrebne u ovom procesu za testiranje sva četiri ddNTP. Nakon ciklusa produžetka DNK šablona iz vezanog prajmera, rezultujući fragmenti DNK se zagrijavaju denaturiraju i razdvajaju po veličini pomoću gel elektroforeza. U originalnoj publikaciji iz 1977. godine,[4] formiranje petlji uparenih bazama ssDNK bilo je uzrok ozbiljnih poteškoća u rješavanju pojaseva na nekim lokacijama. Ovo se često izvodi pomoću denaturirajućeg poliakrilamidnog-ureja gela pri čemu se svaka od četiri reakcije odvija u jednoj od četiri pojedinačne trake (trake A, T, G, C). DNK trake se tada mogu vizualizirati autoradiografijom ili UV svjetlom, a DNK sekvenca se može direktno očitati sa X-zrakama filma ili slike gela.
Na slici desno, rendgenski film je bio izložen gelu, a tamne trake odgovaraju fragmentima DNK različite dužine. Tamna traka u traci ukazuje na fragment DNK koji je rezultat prekida lanca nakon ugradnje didezoksinukleotida (ddATP, ddGTP, ddCTP ili ddTTP). Relativni položaji različitih traka između četiri trake, odozdo prema gore, zatim se koriste za čitanje DNK sekvence.
Tehničke varijacije sekvenciranja završetka lanca uključuju označavanje nukleotidima koji sadrže radioaktivni fosfor za radioobilježavanje, ili korištenje prajmera označenog na 5' kraju fluorescentnom bojom. Sekvenciranje prajmera boje olakšava čitanje u optičkom sistemu za bržu i ekonomičniju analizu i automatizaciju. Kasniji razvoj od strane Leroya Hooda i saradnika[5][6] fluorescentno obilježenih ddNTP i prajmera postavili su scenu za automatizovano, visoko propusno sekvenciranje DNK.
Metodi prekida lanca uveliko su pojednostavile sekvenciranje DNK. Naprimjer, komercijalno su dostupni kompleti zasnovani na prekidu lanca koji sadrže reagense potrebne za sekvenciranje, prethodno raspoređene u alikvote i spremne za upotrebu. Ograničenja uključuju nespecifično vezivanje prajmera za DNK, što utiče na precizno očitavanje sekvence DNK i sekundarne strukture DNK koje utiču na vijernost sekvence.
Redoslijed boje-terminatora
urediSekvenciranje terminatora boje koristi označavanje terminatora lanca ddNTP, što omogućava sekvenciranje u jednoj reakciji, a ne u četiri reakcije kao u metodu označenog prajmera. U sekvenciranju terminatora boje, svaki od četiri terminatora didezoksinukleotidnog lanca označen je fluorescentnim bojama, od kojih svaka emituje svjetlost na različitim talasnim dužinama.
Zbog svoje veće ekspeditivnosti i brzine, sekvenciranje dye-terminatora je sada glavni oslonac u automatskom sekvenciranju. Njegova ograničenja uključuju efekte boje zbog razlika u inkorporaciji bojom označenih terminatora lanca u fragment DNK, što rezultira nejednakim visinama vrhova i oblika u tragu hromatograma elektronske DNK sekvence nakon kapilatne elektroforeze (vidi sliku lijevo).
Ovaj problem je riješen korištenjem modificiranih enzimskih sistema DNK-polimeraze i boja koje minimiziraju varijabilnost inkorporacije, kao i metoda za eliminaciju "mrlja boje". Metod sekvenciranja dye-terminatora, zajedno sa automatizovanim analizatorima DNK sekvence velike propusnosti, korišćen je za veliku većinu projekata sekvenciranja sve do uvođenja sljedeće generacije.
Automatizacija i priprema uzoraka
urediAutomatizovani instrumenti za sekvenciranje DNK (DNK sekvenceri) mogu sekvencirati do 384 DNK uzorka u jednoj seriji. Serijski se izvodi do 24 puta dnevno. DNK sekvenceri razdvajaju lance po veličini (ili dužini) pomoću kapilarne elektroforeze, detektuju i snimaju fluorescenciju boje, i izlaze podatke kao fluorescentni pikhromatogramskog traga. Reakcije sekvenciranja (termocikliranje i obilježavanje), čišćenje i resuspenzija uzoraka u pufer rastvoru izvode se odvojeno, prije ubacivanja uzoraka u sekvencer. Brojni komercijalni i nekomercijalni softverski paketi mogu automatski smanjiti tragove DNK lošeg kvaliteta. Ovi programi ocjenjuju kvalitet svakog pika i uklanjaju bazne vrhove niskog kvaliteta (koji se općenito nalaze na krajevima sekvence). Preciznost ovakvih algoritama je lošija od vizuelnog pregleda ljudskog operatera, ali je adekvatna za automatizovanu obradu velikih skupova podataka sekvence.
Primjene sekvenciranja koje završava bojom
urediPodručje javnog zdravlja ima mnoge uloge u podršci dijagnostici pacijenata, kao i ekološkom nadzoru potencijalnih toksičnih supstanci i cirkulirajućih bioloških patogena. Laboratorije za javno zdravstvo (PHL) i druge laboratorije širom svijeta odigrale su ključnu ulogu u pružanju brzih podataka o sekvenciranju za praćenje virusa SARS-CoV-2, uzročnika COVID 19, tokom pandemije koja je proglašena vanrednim stanjem za javno zdravlje 30. januara 2020.[7] Laboratorije su dobile zadatak da brzo implementiraju metode sekvenciranja i zatražene su da pruže tačne podatke za pomoć u modelima donošenja odluka za razvoj politika za ublažavanje širenja virusa. Mnoge laboratorije pribjegle su metodologijama sekvenciranja sljedeće generacije, dok su druge podržale napore sa Sangerovskim sekvenciranjem. Napori za sekvencioniranje SARS-CoV-2 su brojni, dok je većina laboratorija implementirala sekvenciranje cijelog genoma virusa, drugi su se odlučili za sekvenciranje vrlo specifičnih gena virusa kao što je S-gen, koji kodira informacije potrebne za proizvodnju šiljastog proteina. Visoka stopa mutacija SARS-CoV-2 dovodi do genetičkih razlika unutar S-gena i ove razlike su imale ulogu u infektivnosti virusa.[8] Sangerovsko sekvenciranje S-gena pruža brz, tačan i pristupačniji metod za pronalaženje genetičkog koda. Laboratorije u zemljama s nižim prihodima možda nemaju mogućnosti za implementaciju skupih aplikacija kao što je sekvenciranje sljedeće generacije, tako da Sangerovi metodi mogu prevladati u podršci generiranju podataka sekvenciranja za nadzor varijanti.
Sangerovsko sekvenciranje je također "zlatni standard" za metode nadzora norovirusa za CaliciNet mreži Centra za kontrolu i prevenciju bolesti (CDC). CalciNet je mreža za nadzor epidemije koja je uspostavljena u martu 2009. Cilj mreže je prikupiti podatke o sekvenciranju cirkulirajućih norovirusa u Sjedinjenim Državama i aktivirati nizvodno djelovanje kako bi se utvrdio izvor infekcije, i ublažilo se širenje virusa. CalciNet mreža je identifikovala mnoge infekcije kao bolesti koje se prenose hranom.[3] Ovi podaci se zatim mogu objaviti i koristiti za razvoj preporuka za buduće akcije za sprečavanje kvarenja hrane. Metodi koji se koriste za detekciju norovirusa uključuju ciljano pojačavanje specifičnih područja genoma. Amplikoni se zatim sekvenciraju korištenjem Sangerove sekvence koja završava bojom, a generirani hromatogrami i sekvence se analiziraju pomoću softverskog paketa razvijenog u BioNumerics. Prate se sekvence i proučava se povezanost sojeva kako bi se zaključila epidemiološka relevantnost.
Poređenja sa drugim tehnikama sekvenciranja
uredi| Tehnologija | Broj traka | Zapremina injektiranja (nL) | Vrijeme analize | Prosječna dužina čitanja | Propusnost (uključujući analizu; Mb/h) | Izlijevanje gela | Praćenje trake |
|---|---|---|---|---|---|---|---|
| Gel za ploče | 96 | 500–1000 | 6–8 sata | 700 bp | 0,0672 | Da | Da |
| Elektroforeza kapilarnog niza | 96 | 1–5 | 1–3 sata | 700 bp | 0,166 | Ne | Ne |
| Mikročip | 96 | 0,1–0,5 | 6–30 minuta | 430 bp | 0,660 | Ne | Ne |
| 454/Roche FLX (2008) | < 0.001 | 4 sata | 200–300 bp | 20–30 | |||
| Illumina/Solexa (2008) | 2–3 days | 30–100 bp | 20 | ||||
| ABI/SOLiD (2008) | 8 dana | 35 bp | 5–15 | ||||
| Illumina MiSeq (2019) | 1–3 dana | 2x75–2x300 bp | 170–250 | ||||
| Illumina NovaSeq (2019) | 1–2 dana | 2x50–2x150 bp | 22.000–67.000 | ||||
| Ion Torrent Ion 530 (2019) | 2.5–4 sata | 200–600 bp | 110–920 | ||||
| BGI MGISEQ-T7 (2019) | 1 day | 2x150 bp | 250.000 | ||||
| Pacific Biosciences SMRT (2019) | 10–20 sati | 10–30 kb | 1,300 | ||||
| Oxford Nanopore MinIon (2019) | 3 dana | 13–20 kb[12] | 700 |
Krajnji cilj visokopropusnog sekvenciranja je razvoj sistema koji su jeftini i izuzetno efikasan u dobijanju produženih (većih) dužina čitanja. Većee dužine čitanja svakog pojedinačnog elektroforetskog odvajanja, značajno smanjuju troškove povezane sa de novo sekvenciranjem DNK i brojem šablona potrebnih za sekvenciranje DNK kontiga u datoj redundansi. Mikrofluidika može omogućiti brže, jeftinije i lakše sklapanje sekvence.
Također pogledajte
urediReference
uredi- ^ Shendure J, Ji H (oktobar 2008). "Next-generation DNA sequencing". Nature Biotechnology. 26 (10): 1135–1145. doi:10.1038/nbt1486. PMID 18846087. S2CID 6384349.
- ^ Daniels RS, Harvey R, Ermetal B, Xiang Z, Galiano M, Adams L, McCauley JW (novembar 2021). "A Sanger sequencing protocol for SARS-CoV-2 S-gene". Influenza and Other Respiratory Viruses. 15 (6): 707–710. doi:10.1111/irv.12892. PMC 8447197 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34346163 Provjerite vrijednost parametra|pmid=(pomoć). - ^ a b Vega E, Barclay L, Gregoricus N, Williams K, Lee D, Vinjé J (august 2011). "Novel surveillance network for norovirus gastroenteritis outbreaks, United States". Emerging Infectious Diseases. 17 (8): 1389–1395. doi:10.3201/eid1708.101837. PMC 3381557. PMID 21801614.
- ^ a b Sanger F, Nicklen S, Coulson AR (decembar 1977). "DNA sequencing with chain-terminating inhibitors". Proceedings of the National Academy of Sciences of the United States of America. 74 (12): 5463–5467. Bibcode:1977PNAS...74.5463S. doi:10.1073/pnas.74.12.5463. PMC 431765. PMID 271968.
- ^ Smith LM, Sanders JZ, Kaiser RJ, Hughes P, Dodd C, Connell CR, et al. (1986). "Fluorescence detection in automated DNA sequence analysis". Nature. 321 (6071): 674–679. Bibcode:1986Natur.321..674S. doi:10.1038/321674a0. PMID 3713851. S2CID 27800972.
We have developed a method for the partial automation of DNA sequence analysis. Fluorescence detection of the DNA fragments is accomplished by means of a fluorophore covalently attached to the oligonucleotide primer used in enzymatic DNA sequence analysis. A different coloured fluorophore is used for each of the reactions specific for the bases A, C, G and T. The reaction mixtures are combined and co-electrophoresed down a single polyacrylamide gel tube, the separated fluorescent bands of DNA are detected near the bottom of the tube, and the sequence information is acquired directly by computer.
- ^ Smith LM, Fung S, Hunkapiller MW, Hunkapiller TJ, Hood LE (april 1985). "The synthesis of oligonucleotides containing an aliphatic amino group at the 5' terminus: synthesis of fluorescent DNA primers for use in DNA sequence analysis". Nucleic Acids Research. 13 (7): 2399–2412. doi:10.1093/nar/13.7.2399. PMC 341163. PMID 4000959.
- ^ Taylor DB (17. 3. 2021). "A Timeline of the Coronavirus Pandemic". The New York Times (jezik: engleski). ISSN 0362-4331. Pristupljeno 5. 12. 2021.
- ^ Sanches PR, Charlie-Silva I, Braz HL, Bittar C, Freitas Calmon M, Rahal P, Cilli EM (septembar 2021). "Recent advances in SARS-CoV-2 Spike protein and RBD mutations comparison between new variants Alpha (B.1.1.7, United Kingdom), Beta (B.1.351, South Africa), Gamma (P.1, Brazil) and Delta (B.1.617.2, India)". Journal of Virus Eradication. 7 (3): 100054. doi:10.1016/j.jve.2021.100054. PMC 8443533 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34548928 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Morozova O, Marra MA (novembar 2008). "Applications of next-generation sequencing technologies in functional genomics". Genomics. 92 (5): 255–264. doi:10.1016/j.ygeno.2008.07.001. PMID 18703132.
- ^ Sinville R, Soper SA (juli 2007). "High resolution DNA separations using microchip electrophoresis". Journal of Separation Science. 30 (11): 1714–1728. doi:10.1002/jssc.200700150. PMID 17623451.
- ^ Kumar KR, Cowley MJ, Davis RL (oktobar 2019). "Next-Generation Sequencing and Emerging Technologies". Seminars in Thrombosis and Hemostasis. 45 (7): 661–673. doi:10.1055/s-0039-1688446. PMID 31096307.
- ^ Tyson JR, O'Neil NJ, Jain M, Olsen HE, Hieter P, Snutch TP (februar 2018). "MinION-based long-read sequencing and assembly extends the Caenorhabditis elegans reference genome". Genome Research. 28 (2): 266–274. doi:10.1101/gr.221184.117. PMC 5793790. PMID 29273626.
Dopunska literatura
uredi- Dewey FE, Pan S, Wheeler MT, Quake SR, Ashley EA (februar 2012). "DNA sequencing: clinical applications of new DNA sequencing technologies". Circulation. 125 (7): 931–944. doi:10.1161/CIRCULATIONAHA.110.972828. PMC 3364518. PMID 22354974.
- Sanger F, Coulson AR, Barrell BG, Smith AJ, Roe BA (oktobar 1980). "Cloning in single-stranded bacteriophage as an aid to rapid DNA sequencing". Journal of Molecular Biology. 143 (2): 161–178. doi:10.1016/0022-2836(80)90196-5. PMID 6260957.