Hlorat
Hloratni anion ima formulu ClO3−. U ovom slučaju, atom hlora je u oksidacijskom stanju +5. Termin hlorat se također može odnositi i na hemijski spoj koji sadrži ovaj anion. Hlorati su soli hlorne kiseline. "Hlorat", kad u zagradama slijedi rimski broj, npr. hlorat (VII), odnosi se na određeni oksijanion hlora. Kao što je predviđeno teorijom odbijanja elektronskih parova valentne ljuske, anioni hlorata imaju trigonalne piramidne strukture.
CAS # 14866-68-3[1]
Hlorati su snažni oksidanti i treba ih držati dalje od organskih materija ili lahko oksidirajućih materijala. Mješavine hloratnih soli s gotovo svim zapaljivim materijalima (šećer, piljevina, drveni ugljen, organska otapala, metali itd.) lahko će brzo sagoriti. Iz ovog razloga su hlorati nekad bili široko korišćeni u pirotehnici, iako je njihova upotreba opala zbog nestabilnosti. Većina pirotehničkih aplikacija koje su ranije koristile hlorate, umjesto toga koriste stabilnije perhlorata .
Strukture i vezanje
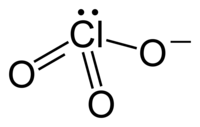
urediHloratni ion ne može se na zadovoljavajući način predstaviti samo jednom Lewisovom strukturom, jer su sve Cl–O veze iste dužine (1,49 Å u kalij-hloratu[2]), a atom hlora je hipervalentan. Umjesto toga, često se smatra da je hibrid višestrukih rezonantnih struktura:
Dobijanje
urediLaboratorijsko
urediMetalni hlorati mogu se pripremiti dodavanjem hlora vrućem metalnom hidroksidu poput KOH:
- 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
U ovoj reakciji, hlor prolazi disproporcionalnost, i redukciju i oksidaciju. Hlor, oksidacijski broj 0, tvori klorid Cl– (oksidacijski broj –1) i hlorat (V) ClO3– (oksidacijski broj +5). Reakcijom hladnih vodenih metalnih hidroksida s hlorom nastaje hlorid i hipoklorit (oksidacijski broj +1).
Industrijski
urediIndustrijskoa skala sinteze za natrij-hlorat polazi od vodene otopine natri-hlorida (slane otopine), a ne od plinskog hlora. Ako oprema za elektrolizu omogućava miješanje hlora i natrij-hidroksida, tada dolazi do gore opisane reakcije neproporcionalnosti. Zagrijavanje reaktanata na 50–70 °C obavlja se električnom snagom koja se koristi za elektrolizu.
Prirodno pojavljivanje
urediNedavna studija otkrila je prisustvo prirodnih hloratnih naslaga diljem svijeta, s relativno visokim koncentracijama koje se nalaze u sušnim i hipesušnim regijama.[3]
Hlorat je takođe mjeren u uzorcima kiše sa količinom hlorata sličnom perhloratu. Sumnja se da hlorat i perhlorat mogu imati zajednički prirodni mehanizam formiranja i mogli bi biti dio ciklusa biogeohemije hlora. Sa stanovišta mikroba, prisustvo prirodnog hlorata moglo bi takođe objasniti zašto postoji niz mikroorganizama koji su sposobni za redukciju hlorata u hlorid. Nadalje, evolucija smanjenja hlorata može biti drevni fenomen, jer sve do danas opisane bakterije koje reduciraju perhlorat također ga koriste kao terminalni akceptor elektrona.[4] Treba jasno reći da dosad nisu poznati minerali u kojims dominira hlorat. To znači da anion hlorata postoji samo kao zamjena u poznatim mineralnim vrstama ili je – eventualno – p risutan u otopinama za punjenje pora.[5]
U 2011., studija tehnološkog Instituta u Georgiji otkrila je prisustvo magnezij-hlorata na planeti Mars.[6]
Spojevi (soli)
urediPrimjeri hlorata uključuju:
- kalij-hlorat, KClO3
- natrij-hlorat, NaClO3
- magnezuj-hlorat, Mg(ClO3)2
Ostali oksianioni
urediAko rimska brojeve u zagradama slijedi riječ "hlorat", to znači da oksianion sadrži hlor u naznačenom oksidacijskom stanju, kao:
| Uobičajeno ime | Naziv zaliha | Oksidacijsko stanje | Formula |
|---|---|---|---|
| Hipohlorit | Hlorat(I) | +1 | ClO− |
| Hlorit | Hlorat(III) | +3 | ClO2− |
| Hlorat | Hlorat(V) | +5 | ClO3− |
| Perhlorat | Hlorat(VII) | +7 | ClO4− |
Koristeći ovu konvenciju, "hlorat" znači "bilo koji" oksanion hlora. Obično se "hlorat" odnosi samo na hlor u oksidacijskom stanju +5.
Toksičnost
urediKlorati su relativno otrovni, mada po redukciji formiraju općenito bezopasne hloride.
Također pogledajte
urediReference
uredi- ^ "ChemIndustry". Pristupljeno 9. 4. 2014.
- ^ J. Danielsen; A. Hazell; F. K. Larsen (1981). "The structure of potassium chlorate at 77 and 298 K". Acta Crystallogr. B. 37: 913–915. doi:10.1107/S0567740881004573.
- ^ Rao, B.; Hatzinger, P. B.; Böhlke, J. K.; Sturchio, N. C.; Andraski, B. J.; Eckardt, F. D.; Jackson, W. (2010). "Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O3− Internal Standard". Environ. Sci. Technol. 44: 8429–8434. Bibcode:2010EnST...44.8429R. doi:10.1021/es1024228. PMID 20968289.
- ^ Coates, J. D.; Achenbach, L. A. (2004). "Microbial perchlorate reduction: rocket-fuelled metabolism". Nature Reviews Microbiology. 2 (July): 569–580. doi:10.1038/nrmicro926. PMID 15197392.
- ^ http://www.mindat.org
- ^ "Arhivirana kopija". Arhivirano s originala, 18. 1. 2017. Pristupljeno 1. 5. 2020.CS1 održavanje: arhivirana kopija u naslovu (link)