Fosfor-pentafluorid
Fosfor-pentafluorid – PF5 – je fosforni halid. Pri sobnoj temperaturi i pritisku, to je bezbojni plin.[1]
| Fosfor-pentafluorid | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Fosfor-pentafluorid |
| Druga imena | Fosfor(V) fluorid Pentafluoridofosfor Pentafluorofosforan IUPAC ime: Fosfor pentafluorid |
| Molekularna formula | PF5 |
| CAS registarski broj | 7647-19-0 |
| SMILES | FP(F)(F)(F)F |
| InChI | 1/F5P/c1-6(2,3,4)5 |
| Kratki opis | Bezbojni plin, neprijatnog mirisa |
| Osobine1 | |
| Molarna masa | 125,966 g/mol |
| Agregatno stanje | Plin |
| Gustoća | 5,527 kg/m3 (g/L) |
| Tačka topljenja | –93,78 |
| Tačka ključanja | –84,6 |
| Rastvorljivost | Hidrolizira |
| Dipolni moment | 0 D |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Dobijanje
urediFosfor pentafluorida je prvi put dobijen 1876. putem fluoriranja fosfor-pentahlorida, pomoću arsen-trifluorida.
Struktura
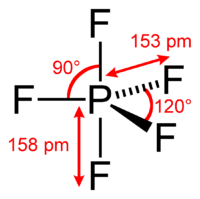
urediStudije putem jednostruke kristalografije X-zrakama ukazuju da molekule PF5 imaju dva odvojena tipa P−F veza (aksijalne i ekvatorijalne): dužina aksijalnih P−F bveza je ista kao i ekvatorske P-F, pod uticajem pseudo Berryjeve rotacije.
U fluor-19 NMR spektroscopiji, čak i na temperaturama nižim od -100 °C, aksijalno i ekvatorijalno okruženje fluora se razlikuju. Prividna ekvivalentnost proizlazi iz niske barijere za pseudorotaciju putem bobičastog mehanizma, kojim aksijalni i ekvatorijalni atoma fluora brzo razmjene pozicije. Prividnu ekvivalentnost F centara u PF5 je prvi put primijetio Gutowsky.[2] Objašnjenje ove pojave je prvi put opisao R. Stephen Berry, po kojemu je mehanizam dobio ime. Berryjeva pseudorotcija utiče na 19F NMR spektar PF5, jer NMR spektroskopija djeluje u vremenskim rasponima na milisekunde.
Kristalografija putem elektronske difrakcije X-zraka, u čvrstom stanju strukture, ne otkriva ovaj efekt, u odnosu na molekule u otopini, a statički i ne može podlijegati potrebnim promjenama u položaju atoma.[3][4][5][6][1]
Također pogledajte
urediReference
uredi- ^ a b Voet D., Voet J. (1995). Biochemistry, 2nd Ed. Wiley.CS1 održavanje: upotreba parametra authors (link)
- ^ Gutowsky, H. S.; McCall, D. W.; Slichter, C. P. (1953). "Nuclear Magnetic Resonance Multiplets in Liquids". J. Chem. Phys. 21 (2): 279. doi:10.1063/1.1698874.
- ^ Atkins P., de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 0-7167-8759-8.
- ^ Whitten K.W., Gailey K. D., Davis R. E. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 0-03-072373-6.CS1 održavanje: više imena: authors list (link)
- ^ Petrucci R. H., Harwood W. S., Herring F. G. (2002). General Chemistry, 8th Ed. New York: Prentice-Hall. ISBN 0-13-014329-4.CS1 održavanje: više imena: authors list (link)
- ^ Laidler K. J. (1978). Physical chemistry with biological applications. Benjamin/Cummings. Menlo Park. ISBN 0-8053-5680-0.
