DiGeorgeov sindrom
DiGeorgeov sindrom, poznat i kao sindrom delecije 22q11.2 , sindrom je uzrokovan delecijom malog segmenta hromosoma 22. Iako simptomi mogu varirati, oni često uključuju urođene srčane probleme, specifične crte lica, česte infekcije, kašnjenje u razvoju, problem s učenjem i rascjep nepca. Povezana stanja uključuju probleme s bubrezima, gubitak sluha i autoimunske poremećaje kao što su reumatoidni artritis ili Gravesova bolest.
| DiGeorgeov sindrom (DiGeorgeova anomalija,[1][2] (Velokardiofacijalni sindrom (VCFS) (Shprintzenov sindrom),[3] (Sindrom konotrunkusne anomalije lica (CTAF) Takaov sindrom),[4] (Sedlackov sindrom) (Caylerpov kardiofacijalni sindrom) (Sindrom delecije 22q11.2) | |
|---|---|
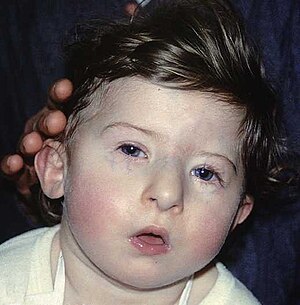 Dijete sa karakterističnim obilježjima lica kod DiGeorgeovog sindroma | |
| Klasifikacija i vanjski resursi | |
| ICD-10 | D82.1 |
| ICD-9 | 279.11, 758.32 |
| OMIM | 188400 |
| DiseasesDB | 3631 |
| eMedicine | med/567 ped/589derm/716 |
| GeneReviews | 22q11.2 Deletion Syndrome |
Znakovi i simptomi
urediKarakteristike ovog sindroma variraju u velikoj mjeri, čak i među članovima iste porodice, i utiču na mnoge dijelove tijela. Karakteristični znakovi i simptomi mogu uključivati urođene nedostatke kao što su urođena srčana bolest, nedostaci nepca, najčešće povezani sa nervno-mišićnim problemima sa zatvaranjem (velofaringealna insuficijencija), smetnje u učenju, blage razlike na značajkama lica i ponavljajuće infekcije. Infekcije su česte kod djece zbog problema sa imunskim sistemom T-ćelija – posredovani odgovor koji je kod nekih pacijenata odsutan ili hipoplazijski timus. DiGeorgeov sindrom može se prvo uočiti kada pogođeno novorođenče ima srčane greške ili konvulzije od hipokalcemije, zbog neispravnog rada paratireoidnih žlijezda i niskih nivoa paratiroidnog hormona (parathormon).
Pogođene osobe mogu imati i druge oblike urođenih oštećenja, uključujući abnormalnosti bubrega i značajne poteškoće sa hranjenjem kao bebe. Gastrointestinalni problemi su takođe vrlo česta u ovoj populaciji pacijenata. Problemi s motorikom probave mogu rezultirati zatvorom.[5] Poremećaji kao što su hipotiroidizam i hipoparatireoidizam ili trombocitopenija (nizak nivo trombocita) i psihijatrijske bolesti su uobičajene karakteristike koje se javljaju u kasnim uzrastima.[6]
Poremećaji kao što su hipotiroidizam i hipoparatireoidizam ili trombocitopenija (nizak nivo trombocita) i psihijatrijske bolesti su uobičajene karakteristike koje se javljaju u kasnim vremenima.[7] Studije pružaju različite stope od 22q11.2DS kod shizofrenije, u rasponu od 0,5 do 2,0% i u prosjeku oko 1,0%, u poređenju sa ukupnim procijenjenim 0,025% rizika od 22q11,2DS u općoj populaciji.[8]
Istaknute karakteristike mogu se sažeti pomoću mnemoničke CATCH-22 za opis 22q11.2DS, s tim da 22 označava da se hromozomska abnormalnost nalazi na 22. hromosomu, kao u nastavku:[9]
- Srčana abnormalnost (obično prekinut luk aorte, truncus arteriosus i Fallotova tetralogija)
- Abnormalno facije
- Timusna aplazija
- Rascjep nepca
- Hipokalcemija / hipoparatireoidizam
Pojedini mogu imati mnogo mogućih karakteristika, u rasponu od broja pridruženih karakteristika, od blagih do vrlo ozbiljnih. Uobičajeni simptomi uključuju:
- Kongenitalna bolest srca (40% osoba), posebno konotrunkusne malformacije (prekinut luk aorte (50%), perzistentni truncus arteriosus (34%), Fallotovu tetralogiju i defekt ventrikulske pregrade)
- Cijanoza (plavkasta koža zbog loše cirkulacije krvi bogate kiseonikom)
- Nepčane abnormalnosti (50%), posebno velofaringeusna nesposobnost, submukozni rascjep nepca i rascjep usne; karakteristične crte lica (prisutne kod većine kavkazoidnih osoba), uključujući hipertelorizam
- poteškoće u učenju (90%), uključujući kognitivni deficit, poremećaj pažnje[10]
- Hipokalcemija (50%) (zbog hipoparatireoidizma)
- Značajni problemi hranjenje (30%)
- Bubrežne anomalije (37%)
- Gubitak sluha (i provodna i senzorinervna) (gubitak sluha s kraniofacijalnim sindromima)
- Laringotraheoezofagusne anomalije
- Nesostatak hormona rasta
- Autoimunski poremećaji
- Imunski poremećaji zbog smanjenog broja T-ćelija
- Shizofrenija
- Napadi (sa ili bez hipokalcemije)
- Skeletne abnormalnosti
- Psihijatrijski poremećaji [10]
Ovaj sindrom karakterizira nepotpuna penetracija. Stoga postoji značajna varijabilnost u kliničkoj ekspresiji između različitih pacijenata. To često otežava ranu dijagnozu.[11]
Genetika
urediDiGeorgeov sindrom uzrokovan je heterozigot nomdelecijom dijela dugog kraka (q) hromosoma 22, regija 1, pruga 1, podopseg 2 (22q11.2). Otprilike 80-90% pacijenata ima deleciju od tri Mb, a 8% deleciju od 1,5Mb.[12][13] Broj gena zahvaćenih delecijom naveden je kao približno 30 do 50.[14][15] Vrlo rjeđe, pacijenti sa donekle sličnim kliničkim karakteristikama mogu imati delecije na kratkom kraku hromosoma 10.[16] Poremećaj ima obrazac autosomno dominantnog nasljeđivanja.
Francuska studija na 749 ljudi kojima je dijagnosticiran između 1995. i 2013. godine otkrila je da je mutacija naslijeđena kod 15% pacijenata, od čega je 85,5% bilo od majke.[17] Druge studije su utvrdile stope nasljeđivanja od 6-10%. Većina slučajeva posljedica je delecija de novo (novo u porodici). To je zato što regija 22q11 ima strukturu koja je čini vrlo sklonom preuređivanju tokom stvaranja sperme ili jaja.[18]
Tačan mehanizam koji uzrokuje sve pridružene karakteristike sindroma je nepoznat. Od 30-50 gena u deletiranom području, utvrđeno je da jedan broj možda ima ulogu u razvoju nekih od znakova i simptoma.
TBX1
urediSmatra se da je haploinsuficijencija gena TBX1 (faktor transkripcije T-boksa TBX1) uzrok nekih uočenih simptoma. Kod osoba s DiGeorgeovim sindromom, u ovom genu uočene su tačkaste mutacije i TBX1, dio je porodice T-boks gena koji imaju važnu ulogu u formiranje tkiva i organa tokom embrionskog razvoja i može imati ulogu u regulaciji diferencijacijske postmigracije ćelija neurvnog grebena. Nervni greben tvori mnoge strukture zahvaćene DiGeorgeovim sindromom, uključujući kosti lobanje, mezenhim lica i nepca, odvodni trakt srca i timus i paratireoidnu stromu. Kada dođe do gubitka ekspresije FGF18 tokom razvoja ždrijelnih lukova, nastuoa smrt ćelije neuronskog grebena. Iako ni FGF18 ni TBX1 nisu eksprimirani u ćelijama neuronskog grebena, TBX1 bi mogao imati ulogu u regulaciji ekspresije FGF18, osiguravajući da je diferencijacija ovih ćelija u ždrijelnoj regiji tačna. Zato je disfunkcija TBX1 možda odgovorna za neke simptome DiGeorgeovog sindroma. Istraživanje na modelima miša pokazalo je da delecija Tbx1 dovodi do nekoliko defekata sličnih onima koji se viđaju kod ljudi, uglavnom utičući na razvoj velikih arterija i timusa.[19][20]
Nenormalnosti uočene u velikim arterijama miševa kojima nedostaje Tbx1 posljedica su abnormalnog formiranja i preoblikovanja aortnih lukova tokom ranog razvoja. Uloga Tbx1 u pravilnom formiranju i preoblikovanju luka aorte opsežno je proučavana u različitim modelima miševa sugerirajući ključnu ulogu Tbx1 za kardiovaskularni razvoj i fenotipove viđene kod DiGeorge sindroma.
DGCR8
urediHaploinsuficijencija gena DGCR8 u miševa povezana je s nepravilnom regulacijom mikroRNK miR-338 i fenotipa delecije 22q11.2.[21]
TANGO2
urediHomolog transporta i Golgijeve organizacije 2 ([[[TANGO2]])) poznat i kao hromosom 22, otvoreni okvir čitanja 25 (C22orf25) je protein koji je kod ljudi kodiran genom TANGO2.
Gen koji kodira C22orf25 nalazi se na hromosomu 22, i na lokaciji q11.21, pa je često povezan sa sindromom delecije 22q11.2.[22] Ali, ako TANGO2 poremećaj bude autosomno recesivan, neće se dogoditi u svim slučajevima.
Mutacije u genu TANGO2 mogu prouzrokovati nedostatke u mitohondrijskoj β-oksidaciji [23] i povećani endoplazmatski retikulumski stres i smanjenje zapreminske gustine Golgijevog aparata.[24] Ove mutacije rezultiraju ranim početkom hipoglikemije, hiperamonemije, rabdomioliza, srčane aritmije i encefalopatije što se kasnije razvija u kognitivno oštećenje.
Geni za Parkinsonovu bolest
urediRegija 22q11.2DS povezana je s većim rizikom od ranog početka Parkinsonove bolesti (PD). Uočena neuropatologija slična je PD -LRRK2. Nijedan od gena pogođenih kod osoba sa 22q11.2DS prethodno nije bio povezan s PD, ali postoji određeni broj vjerovatnih kandidata. Uključuju DGCR8, koji je važan za biogenezu mikroDNK mozga, SRPT5 koji kodira komunicirajući protein sa PARK2 proteinom, COMT koji je uključen u regulaciju nivoa dopamina i mikroRNK miR-185 za koje se pretpostavlja da ciljaju poznate PD lokuse LRRK2.[25]
Dijagnoza
urediDijagnoza DiGeorgeovog sindroma može biti teška zbog broja potencijalnih simptoma i razlike u fenotipovima među pojedincima. Sumnja se na pacijente s jednim ili više znakova delecije. U tim slučajevima, dijagnoza 22q11.2DS potvrđuje se opažanjem delecije dijela dugog kraka (q) hromosoma 22, regija 1, traka 1, podopseg 2. Genetička analiza se obično vrši pomoću fluorescentne in situ hibridizacije (FISH), koja je sposobna otkriti mikrodelecije koje standardna analiza kariotipa (npr. G-pruganje) ne može. Novije metode analize uključuju multipleks ligacija-ovisno pojačavanje sonde test (MLPA) i kvantitativnu lančanu reakciju polimeraze (qPCR), od kojih obje mogu otkriti atipske delecije u 22q11.2 koje FISH ne otkriva.[27] Analiza qPCR je također brža od FISH-a, koji može imati zaokret od 3 do 14 dana.
Studija iz 2008. godine o novoj sondi visoke definicije , razvijenoj za otkrivanje varijacija broja kopija u 37 tačaka na hromosomu 22q pokazala je da je pouzdana kao i FISH u otkrivanju normalnih delecija 22q11.2. Također je mogla otkriti manje atipske delecije koje se lahko propuštaju pomoću FISH-a. Ovi faktori, zajedno s nižim troškovima i lakšim testiranjem, znače da bi ova MLPA sonda mogla zamijeniti FISH u kliničkom ispitivanju.[28]
Genetičko testiranje pomoću BAC-ova na kuglicama. uspješno je otkrilo delecije u skladu sa 22q11.2DS tokom prenatalnog testiranja.[[29][30] Komparativna genomska hibridizacija niza (niz-CGH) koristi veliki broj sondi utisnutih u čip da bi se čitav genom provjerio na delecije ili duplikacije. Može se koristiti u post- i prenatalnoj dijagnozi 22q11.2.[31]
Manje od 5% osoba sa simptomima DiGeorge sindroma ima uobičajene rutinske citogenetičke studije i negativno FISH testiranje. U tim slučajevima uzroci su atipski.[32] Neki slučajevi delecijskog sindroma 22q11.2 imaju nedostatke u drugim hromosomima, posebno deleciju u hromosomskoj regiji 10p14.
Liječenje
urediZa DiGeorgeov sindrom nije poznat nijedan lijek. Određene pojedinačne osobine mogu se izliječiti standardnim tretmanima.[33] Ključ je identificirati svaku od povezanih karakteristika i upravljati svakom pomoću najboljih dostupnih tretmana.
Naprimjer, kod djece je važno da se imunski problemi prepoznaju rano, jer su potrebne posebne mjere opreza u vezi sa transfuzijom krvi i imunizacijom živim cjepivima.[34] Transplantacija timusa može se koristiti za rješavanje odsustva timusa u rijetkom, takozvanom "potpunom" DiGeorge sindromu.[35] Bakterijske infekcije se liječe antibioticima. Kardiohirurgija je često potrebna za urođene srčane abnormalnosti. Hipoparatireoidizam, koji uzrokuje hipokalciemiju, često zahtijeva doživotne dodatke vitamina D i kalcija. Specijalizirane klinike koje pružaju višesistemsku njegu omogućuju procjenu osoba s DiGeorgeovim sindromom u skladu sa svim njihovim zdravstvenim potrebama i omogućuju pažljivo praćenje pacijenata. Primjer ove vrste sistema je klinika za uklanjanje 22q u Bolnici za bolesnu djecu, Toronto SickKids bolnica]] u Kanadi, koja djeci pruža s trajnu podršku, medicinskom njegom s delecijskim sindromom 22q11 i informacijama tima zdravstvenih radnika.[36]
Epidemiologija
urediProcjenjuje se da DiGeorgeov sindrom pogađa između 1/2.000 i 1/4.000 živorođenih.[37][38] Ova procjena temelji se na glavnim urođenim mahanama i može biti potcijenjena, jer neke osobe s deleciom imaju malo simptoma i možda im nije formalno dijagnosticirana. Jedan je od najčešćih uzroka intelektualne invalidnosti zbog sindroma genetičke delecije.[39]
Očekuje se da će se broj pogođenih povećati iz više razloga: (1) hirurški i medicinski napredak, sve veći broj ljudi preživljava srčane greške povezane sa sindromom. Ovi pojedinci zauzvrat imaju djecu. Šanse da osoba s DiGeorgeovim sindromom rodi dijete budu 50% za svaku trudnoću; (2) Roditeljima koji su utjecali na djecu, ali koji nisu bili svjesni vlastitih genetičkih stanja, sada se postavlja dijagnoza kada genetičko testiranje postane dostupno; (3) Tehnike molekulske genetike poput FISH (fluorescentna in situ hibridizacija) imaju ograničenja i nisu uspjele otkriti sve delecije 22q11.2. Novije tehnologije su uspjele otkriti ove atipske delecije.[40]
Također pogledajte
urediReference
uredi- ^ Rapini, Ronald P.; Bolognia, Jean L.; Jorizzo, Joseph L. (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN 978-1-4160-2999-1.
- ^ James, William D.; Berger, Timothy G.; et al. (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. ISBN 978-0-7216-2921-6.
- ^ Shprintzen RJ, Goldberg RB, Lewin ML, Sidoti EJ, Berkman MD, Argamaso RV, Young D (januar 1978). "A new syndrome involving cleft palate, cardiac anomalies, typical facies, and learning disabilities: velo-cardio-facial syndrome". Cleft Palate J. 15 (1): 56–62. PMID 272242.
- ^ Burn J, Takao A, Wilson D, Cross I, Momma K, Wadey R, Scambler P, Goodship J (oktobar 1993). "Conotruncal anomaly face syndrome is associated with a deletion within chromosome 22q11". J. Med. Genet. 30 (10): 822–4. doi:10.1136/jmg.30.10.822. PMC 1016562. PMID 8230157.
- ^ McDonald-McGinn DM, Sullivan KE (januar 2011). "Chromosome 22q11.2 deletion syndrome (DiGeorge syndrome/velocardiofacial syndrome)". Medicine (Baltimore). 90 (1): 1–18. doi:10.1097/MD.0b013e3182060469. PMID 21200182. S2CID 27954882.
- ^ Debbané M, Glaser B, David MK, Feinstein C, Eliez S (2006). "Psychotic symptoms in children and adolescents with 22q11.2 deletion syndrome: Neuropsychological and behavioral implications". Schizophr. Res. 84 (2–3): 187–93. doi:10.1016/j.schres.2006.01.019. PMID 16545541. S2CID 9999210.
- ^ Šablon:Primary-source inline Bassett AS, Chow EW, AbdelMalik P, Gheorghiu M, Husted J, Weksberg R (2003). "The schizophrenia phenotype in 22q11 deletion syndrome". Am J Psychiatry. 160 (9): 1580–6. doi:10.1176/appi.ajp.160.9.1580. PMC 3276594. PMID 12944331.
- ^ |date=April 2015}} Horowitz A, Shifman S, Rivlin N, Pisanté A, Darvasi A (2005). "A survey of the 22q11 microdeletion in a large cohort of schizophrenia patients". Schizophr. Res. 73 (2–3): 263–7. doi:10.1016/j.schres.2004.02.008. PMID 15653270.
- ^ Burn J (oktobar 1999). "Closing time for CATCH22". J. Med. Genet. 36 (10): 737–8. doi:10.1136/jmg.36.10.737. PMC 1734243. PMID 10528851.
- ^ a b Lindsay EA (novembar 2001). "Chromosomal microdeletions: dissecting del22q11 syndrome". Nat. Rev. Genet. 2 (11): 858–68. doi:10.1038/35098574. PMID 11715041.
- ^ Swillen A, Vogels A, Devriendt K, Fryns JP (2000). "Chromosome 22q11 deletion syndrome: update and review of the clinical features, cognitive-behavioral spectrum, and psychiatric complications". Am. J. Med. Genet. 97 (2): 128–35. doi:10.1002/1096-8628(200022)97:2<128::AID-AJMG4>3.0.CO;2-Z. PMID 11180220.
- ^ OMIM: #188400
- ^ Packham EA, Brook JD (april 2003). "T-box genes in human disorders". Hum. Mol. Genet. 12 Spec No 1 (90001): R37–44. doi:10.1093/hmg/ddg077. PMID 12668595.
- ^ Tang KL, Antshel KM, Fremont WP, Kates WR (oktobar 2015). "Behavioral and Psychiatric Phenotypes in 22q11.2 Deletion Syndrome". J Dev Behav Pediatr. 36 (8): 639–50. doi:10.1097/DBP.0000000000000210. PMC 4586411. PMID 26372046.
- ^ Maynard TM, Meechan DW, Dudevoir ML, Gopalakrishna D, Peters AZ, Heindel CC, Sugimoto TJ, Wu Y, Lieberman JA, Lamantia AS (novembar 2008). "Mitochondrial localization and function of a subset of 22q11 deletion syndrome candidate genes". Mol. Cell. Neurosci. 39 (3): 439–51. doi:10.1016/j.mcn.2008.07.027. PMC 2729512. PMID 18775783.
- ^ Bartsch O, Nemecková M, Kocárek E, Wagner A, Puchmajerová A, Poppe M, Ounap K, Goetz P (februar 2003). "DiGeorge/velocardiofacial syndrome: FISH studies of chromosomes 22q11 and 10p14, and clinical reports on the proximal 22q11 deletion". Am. J. Med. Genet. A. 117A (1): 1–5. doi:10.1002/ajmg.a.10914. PMID 12548732.
- ^ Poirsier C, Besseau-Ayasse J, Schluth-Bolard C, Toutain J, Missirian C, Le Caignec C, et al. (juni 2016). "A French multicenter study of over 700 patients with 22q11 deletions diagnosed using FISH or aCGH". Eur. J. Hum. Genet. 24 (6): 844–51. doi:10.1038/ejhg.2015.219. PMC 4867458. PMID 26508576.
- ^ Edelmann L, Pandita RK, Spiteri E, Funke B, Goldberg R, Palanisamy N, Chaganti RS, Magenis E, Shprintzen RJ, Morrow BE (1999). "A common molecular basis for rearrangement disorders on chromosome 22q11". Hum Mol Genet. 8 (7): 1157–67. doi:10.1093/hmg/8.7.1157. PMID 10369860.
- ^ Jerome LA, Papaioannou VE (mart 2001). "DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1". Nat. Genet. 27 (3): 286–91. doi:10.1038/85845. PMID 11242110.
- ^ Lindsay EA, Vitelli F, Su H, Morishima M, Huynh T, Pramparo T, Jurecic V, Ogunrinu G, Sutherland HF, Scambler PJ, Bradley A, Baldini A (mart 2001). "Tbx1 haploinsufficieny in the DiGeorge syndrome region causes aortic arch defects in mice". Nature. 410 (6824): 97–101. doi:10.1038/35065105. PMID 11242049.
- ^ Chun S, Du F, Westmoreland JJ, Han SB, Wang YD, Eddins D, et al. (januar 2017). "Thalamic miR-338-3p mediates auditory thalamocortical disruption and its late onset in models of 22q11.2 microdeletion". Nat. Med. 23 (1): 39–48. doi:10.1038/nm.4240. PMC 5218899. PMID 27892953.
- ^ "Gene (NCBI)".
- ^ Kremer LS, Distelmaier F, Alhaddad B, Hempel M, Iuso A, Küpper C, et al. (2016). "Bi-allelic Truncating Mutations in TANGO2 Cause Infancy-Onset Recurrent Metabolic Crises with Encephalocardiomyopathy". American Journal of Human Genetics. 98 (2): 358–62. doi:10.1016/j.ajhg.2015.12.009. PMC 4746337. PMID 26805782.
- ^ Lalani SR, Liu P, Rosenfeld JA, Watkin LB, Chiang T, Leduc MS, et al. (2016). "Recurrent Muscle Weakness with Rhabdomyolysis, Metabolic Crises, and Cardiac Arrhythmia Due to Bi-allelic TANGO2 Mutations". American Journal of Human Genetics. 98 (2): 347–57. doi:10.1016/j.ajhg.2015.12.008. PMC 4746334. PMID 26805781.
- ^ Butcher NJ, Kiehl TR, Hazrati LN, Chow EW, Rogaeva E, Lang AE, Bassett AS (2013). "Association between early-onset Parkinson disease and 22q11.2 deletion syndrome: identification of a novel genetic form of Parkinson disease and its clinical implications". JAMA Neurol. 70 (11): 1359–66. doi:10.1001/jamaneurol.2013.3646. PMC 4464823. PMID 24018986.
- ^ Tonelli AR, Kosuri K, Wei S, Chick D (2007). "Seizures as the first manifestation of chromosome 22q11.2 deletion syndrome in a 40-year old man: a case report". J Med Case Rep. 1: 167. doi:10.1186/1752-1947-1-167. PMC 2222674. PMID 18053182.
- ^ Miller, Kimberley A. (2008). "FISH Diagnosis of 22q11.2 Deletion Syndrome". Newborn and Infant Nursing Reviews. 8 (1): e11–e19. doi:10.1053/j.nainr.2007.12.006.
- ^ Jalali GR, Vorstman JA, Errami A, Vijzelaar R, Biegel J, Shaikh T, Emanuel BS (mart 2008). "Detailed analysis of 22q11.2 with a high density MLPA probe set". Hum. Mutat. 29 (3): 433–40. doi:10.1002/humu.20640. PMC 2664158. PMID 18033723.
- ^ García-Herrero S, Campos-Galindo I, Martínez-Conejero JA, Serra V, Olmo I, Lara C, Simón C, Rubio C (2014). "BACs-on-Beads technology: a reliable test for rapid detection of aneuploidies and microdeletions in prenatal diagnosis". Biomed Res Int. 2014: 590298. doi:10.1155/2014/590298. PMC 3985206. PMID 24795887.
- ^ Choy KW, Kwok YK, Cheng YK, Wong KM, Wong HK, Leung KO, Suen KW, Adler K, Wang CC, Lau TK, Schermer MJ, Lao TT, Leung TY (septembar 2014). "Diagnostic accuracy of the BACs-on-Beads™ assay versus karyotyping for prenatal detection of chromosomal abnormalities: a retrospective consecutive case series". BJOG. 121 (10): 1245–52. doi:10.1111/1471-0528.12873. PMID 24893808.
- ^ Park SJ, Jung EH, Ryu RS, Kang HW, Ko JM, Kim HJ, Cheon CK, Hwang SH, Kang HY (maj 2011). "Clinical implementation of whole-genome array CGH as a first-tier test in 5080 pre and postnatal cases". Mol Cytogenet. 4: 12. doi:10.1186/1755-8166-4-12. PMC 3114015. PMID 21549014.
- ^ Mupanemunda, Richard H.; Watkinson, Michael (2004). Key Topics in Neonatology. CRC Press. str. 82. ISBN 9781859962343.
- ^ "DiGeorge syndrome (22q11.2 deletion syndrome)". Mayo Clinic. Pristupljeno 22. 5. 2020.
- ^ "DiGeorge (22q11.2 deletion) syndrome: Management and prognosis". www.uptodate.com. Pristupljeno 30. 10. 2018.
- ^ Markert ML, Devlin BH, Alexieff MJ, Li J, McCarthy EA, Gupton SE, et al. (maj 2007). "Review of 54 patients with complete DiGeorge anomaly enrolled in protocols for thymus transplantation: outcome of 44 consecutive transplants". Blood. 109 (10): 4539–47. doi:10.1182/blood-2006-10-048652. PMC 1885498. PMID 17284531.
- ^ "Clinical and Metabolic Genetics- The 22q Deletion Clinic". The Hospital for Sick Children. Arhivirano s originala, 7. 4. 2016.
- ^ Fung WL, Butcher NJ, Costain G, Andrade DM, Boot E, Chow EW, et al. (august 2015). "Practical guidelines for managing adults with 22q11.2 deletion syndrome". Genet. Med. 17 (8): 599–609. doi:10.1038/gim.2014.175. PMC 4526275. PMID 25569435.
- ^ Oskarsdóttir S, Vujic M, Fasth A (2004). "Incidence and prevalence of the 22q11 deletion syndrome: a population-based study in Western Sweden". Arch. Dis. Child. 89 (2): 148–51. doi:10.1136/adc.2003.026880. PMC 1719787. PMID 14736631.
- ^ Daily DK, Ardinger HH, Holmes GE (februar 2000). "Identification and evaluation of mental retardation". Am Fam Physician. 61 (4): 1059–67, 1070. PMID 10706158.
- ^ "The Genetics of 22q11.2 DS: Demographics". Information for Medical Professionals. The Dalglish Family Hearts and Minds Clinic for Adults with 22q11.2 Deletion Syndrome. Arhivirano s originala, 9. 3. 2016. Pristupljeno 26. 8. 2015.
Vanjski linkovi
uredi- DiGeorgeov sindrom na Curlie
- McDonald-McGinn DM, Emanuel BS, Zackai EH (16. 12. 2005). "22q11.2 Deletion Syndrome". u Pagon RA, Bird TD, Dolan CR, Stephens K (ured.). GeneReviews. PMID 20301696. NBK1523.
- Firth HV (17. 2. 2009). "22q11.2 Duplication". u Pagon RA, Bird TD, Dolan CR, Stephens K (ured.). GeneReviews. PMID 20301749. NBK3823.
Šablon:Imunski poremećaji Šablon:Kongenitalni poremećaji limfnih organa