L-tip kalcijskog kanala
L-tip kalcijskog kanala (poznat i kao dihidropiridinski kanal ili DHP-kanal) dio je visokonaponske aktivirane porodice naponski ovbisnih kanala .[2] "L" označava dugotrajno označavanje dužine aktivacije. Ovaj kanal ima četiri podjedinice (Cav1.1, Cav1.2, Cav1.3, Cav1.4).
| Naponski ovisni kalcijev kanal | |
|---|---|
 Kristalografska strukltura | |
| Identifikatori | |
| Simbol | CACNA1D |
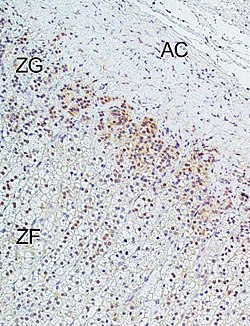
ZG = zona glomerulosa,
ZF = zona fasciculata ,
AC = nadbubrežna kapsula.
Imunohistokemijska analiza izvedena je prema objavljenim metidama.[1]

Kalcijevi kanali L-tipa odgovorni su za pobudu – kontrakcije spregnutih skeletnih, glatkih isrčanih mišića, te za sekreciju aldosterona u endokrinih ćelija u kori nadbubrežne žlijezde.[1] Nalaze se i u neuronima, a uz pomoć kalcijevih kanala L-tipa u endokrinim ćelijama reguliraju neurohormone i neurotransmitere. Također je primijećeno da imaju ulogu u ekspresiji gena, stabilnosti iRNK, preživljavanju neurona, aksonskom ozljedom izazvanoj ishemijom, sinapsnoj djelotvornosti i aktiviranju, te deaktiviranju drugih ionskih kanala.
U srčanim miocitima, L-tip kalcijevog kanala prolazi unutrašnju struju Ca2+ i pokreće oslobađanje kalcija iz sarkoplazmatskog retikuluma, aktiviranjem rianodinskog receptora 2 (RyR2) (otpuštanjee kalcij-induciranog kalcija).[3] Fosforilacija ovih kanala povećava njihovu propusnost za kalcij i povećava kontraktilnost njihovih srčanih miocita.
L-tip blokatora kalcijskih kanala koriste se kao srčani antiaritmici ili antihipertenzivi, ovisno o tome imaju li veći afinitet za srce (fenilalkilamini, kao što je verapamil), ili za krvne sudove (dihidropiridini, poput nifedipina).[4]
U skeletnim mišićima postoji vrlo visoka koncentracija kalcijevih kanala L-tipa, koji se nalaze u T-tubulama. Depolarizacija mišića rezultira velikim protocima strujanja, ali s anomalijski malim protokom kalcija, što se sada objašnjava vrlo sporim aktiviranjem ionskih struja. Zato, malo ili nimalo Ca2+ prolazi kroz membranu T-tubula, tokom pojedinačnog potencijala djelovanja.
Historija
urediGodine 1953., Paul Fatt i Bernard Katz otkrili su u mišićima rakova naponske kalcijske kanale. Kanali su pokazivali različite napone aktivacije i svojstva provodljivosti kalcija, pa su tako razdvojeni na visokonaponske (HVA) i niskonaponske aktivacijske kanale (LVA). Nakon daljnjeg eksperimentiranja, utvrđeno je da se HVA kanali otvaraju za 1,4-dihidropiridin (DHP-ove).[5] Koristeći DHP-ove, otkrili su da su HVA kanali specifični za određena tkiva i različito su reagirali, što je dovelo do dalje kategorizacije HVA kanala u L-tip, P-tip i N-tip.[6] Kalcijski kanali L-tipa sekvencirani su peptidom i utvrđeno je da postoje četiri tipa kalcijskih kanala L-tipa: α1S (skeletni mišići), α1C ( srčani), α1D (u mozgu) i α1F (u mrežnjači).[5] U 2000., nakon što je obavljeno više istraživanja na podjedinicama α1 u naponski usmjerenim kalcijevim kanalima, korištena je nova nomenklatura koja je nazvala L-tip kalcijevih kanala CaV1, sa podjedinicama CaV1.1, Cav1.2, CaV1.3 i CaV1.4.[6] Istraživanja na podjedinicama CaV1 nastavljaju otkrivati više o njihovoj strukturi, funkciji i farmaceutskoj primjeni.[7]
Struktura
urediL-tip kalcijevih kanala sadrži pet različitih podjedinica: α1 (170–240 kDa), α2 (150kDa), δ (17-25 kDa), β (50-78 kDa) i γ (32 kDa).[8] Podjedinice α2, δ i β su nekovalentno povezane sa α1 podjedinicom i moduliraju promet iona i biofizička svojstva α1 podjedinice. Podjedinice α2 i δ nalaze se u vanćelijskom prostoru, dok su podjedinice β i γ smještene u citosolu.[8]
Podjedinica α1 je heterotetramer koji ima četiri transmembranske regije, poznate kao domeni I-IV, koji šest puta prelaze plazmu kao α-heliksi, zvani S0-S6 (S0 i S1 zajedno jednom prelaze membranu).[6] Podjedinica α1 kao cjelina sadrži domen osjećanja napona, provodnu pora i aparat za zatvaranje.[9] Kao i većina naponski ograničenih ionskih kanala, α-podjedinica se sastoji od četiri podjedinice. Svaka podjedinica je formirana od po šest alfa-heliksa, transmembranskih domena koji prelaze membranu (pod brojem S1-S6). Podjedinice S1-S4 čine senzor napona, a podjedinice S5-S6 – filter selektivnosti.[10] Da bi se osjetio napon ćelije, S1-S3 spirala sadrži mnogo negativno nabijenih aminokiselina, dok S4 heliks sadrži uglavnom pozitivno nabijene aminokiseline s P-petljama koje povezuju S4 sa S5 spiralama. Nakon S1-6 domena, postoji šest C-domena, koji se sastoje od dvije EF-motiva ruke (C1-2 i C3-4) i pre-IQ domen (C5) i IQ domen (C6). Na N-kraju se nalaze i dva motiva EF-šake. I N i C-kraj nalaze se u citosolnom prostoru, a C-kraj je mnogo duži od N-kraja.[11]
Poznato je da podjedinica β ima četiri izoforme (β1-β4) za regulaciju funkcija kanala i povezana je s α1, preko α1 I i II povezivača u citosolu na β α1 - vezujućeg džepa (ABP).[7][12] Svaka izoforma sadrži src homologijui 3 domena (SH3) i domen poput gvanilat-kinaze (GK), koji su odvojeni HOOK domenom i tri nestrukturirana regiona.[12]
Podjedinice α2 i δ povezane su disulfidnim vezama (ponekad poznate i kao α2δ podjedinice) i u interakciji su s α1. Imaju četiri poznate izoforme, zvane α2δ-1 do α2δ-2 i sadrže von Willebrandov A (VWA) domen i skladišni domen. Regija α2 nalazi se u vanćelijskom prostoru, dok je regija δ u ćelijskoj membrani i vidjelo se da je usidrena pomoću glikozilfosfatidilinozitola ( (GPI).[12]
Podjedinica γ ima osam izoformi (γ1-γ8) i povezana je s podjedinicom α1, te je pronađena samo u mišićnim ćelijama u kanalima CaV1.1 i CaV1.2. Nije poznato mnogo toga o γ podjedinici, ali povezana je s interakcijama hidrofobnih sila.[6]
Mehanizam
urediOtvaranje pora u kalcijskim kanalima tipa L odvija se u α1 podjedinici. Kada se membrana depolarizira, S4 heliks se kreće kroz linkere S4 i S5 do citoplazmatskih krajeva S5 i S6 zavojnica. Ovo otvara vrata za aktiviranje koja su formirana od unutrašnje strane S6 heliksa u podjedinici α1.[11]
Najzastupljeniji put autoinhibicije kalcijevih kanala tipa L je sa kompleksom Ca(2+)/Cam.[11] Kako se pora otvara i uzrokuje priliv kalcija, on se veže za kalmodulin, a zatim stupa u interakciju s petljom koja povezuje susjedna motive EF-ruke i uzrokuje konformacijsku promjenu u motivu EF-ruketa ko da u interakciji s porama uzrokuje brzu inhibiciju u kanalu.[5] Još uvijek se raspravlja o tome gdje i kako pore i EF ruka djeluju. Hidrofobni džepovi u kompleksu Ca(2+)/Cam također se vežu za tri odjeljka IQ domen poznat kao „aromatska sidra“.[11] Kompleks Ca(2+)/Cam ima visok afinitet za L-tip kalcijskih kanala, omogućavajući mu blokiranje čak i kada u ćeliji ima male količine kalcija. Pora se na kraju zatvara dok se ćelijaa repolarizira i uzrokuje konformacijsku promjenu u kanalu da je dovede u zatvorenu konformaciju.
Inhibicija i modulacija
urediJedna od najpriznatijih karakteristika kalcijskog kanala L-tipa je njegova jedinstvena osjetljivost na 1,4-dihidropiridine (DHP).[6] Za razliku od ostalih kalcijskih kanala s naponom, kalcijevi kanali L-tipa otporni su na lijekove koji inhibiraju ⍵-CT X (GVIA) i ⍵-AG A (IVA).[6]
Dobro uočeni oblik modulacije je posljedica alternativne prerade. Uobičajeni oblik modulacije od alternativne prerade je C-krajev modulator (CTM). ]]Ima pozitivno nabijen [[alfa heliks|α-heliks na C-kraju, koja se naziva DCRD, i negativno nabijenu zavojnicu odmah nakon motiva IQ (interakcijsko mjesto CaM) zvanog PCRD. Dvija heliksa mogu formirati strukturu koja se kompetitivno veže sa CaM, kako bi se smanjila vjerovatnoća otvorenog stanja i smanjila inhibicija ovisna o kalciju (CDI).[7]
Alternativna prerada se također vidi u na podjedinicama β, kako bi se stvorili različiti izoforme i kanali dobili različita svojstva zbog palitolilacije [5] i editiranja RNK.[7] Ostali oblici modulacije na β-podjedinici uključuju povećanje ili smanjenje ekspresije podjedinice. To je zbog činjenice da β-podjedinice povećavaju otvorenost kanala, aktivnost u plazemamembrani i antagoniziraju ubikvitinaciju kanala.[5]
L-tip kalcijevih kanala je također moduliran od G-protein spregnutog receptora i adrenergičnog dijela nervnog sistema.[5] Protein-kinaza A (PKA ) aktivirana kaskadom receptora povezanih sa G-proteinima može fosforilirati kalcijske kanale tipa L, nakon što oni formiraju signalni kompleks sa A-kinaza-sidrećim proteinom (AKAP), da bi se povećao struja kalcija kroz kanal, povećavajući vjerovatnoću otvorenog stanja i ubrzani period oporavka. Aktivirana fosfolipaza C (PLC) iz receptora povezanih sa G-proteinima može razbiti polifosfoinozitide da smanji kanalsku struju za 20% – 30%.[7]
Uočeno je da adrenergični nervni sistem modulira kalcijeve kanale tipa L, cijepajući fragment C-kraja, kada se β-adrenergički receptor stimulira povećanje aktivacije kanala.[5]
Geni
urediTakođer pogledajte
urediReference
uredi- ^ a b Felizola SJ, Maekawa T, Nakamura Y, Satoh F, Ono Y, Kikuchi K, et al. (oktobar 2014). "Voltage-gated calcium channels in the human adrenal and primary aldosteronism". The Journal of Steroid Biochemistry and Molecular Biology. 144 Pt B (part B): 410–6. doi:10.1016/j.jsbmb.2014.08.012. PMID 25151951.
- ^ Rossier MF (2016). "T-Type Calcium Channel: A Privileged Gate for Calcium Entry and Control of Adrenal Steroidogenesis". Frontiers in Endocrinology. 7: 43. doi:10.3389/fendo.2016.00043. PMC 4873500. PMID 27242667.
- ^ Yamakage M, Namiki A (februar 2002). "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review". Canadian Journal of Anaesthesia. 49 (2): 151–64. doi:10.1007/BF03020488. PMID 11823393.
- ^ Hughes, Alun (2017). "Calcium channel blockers". u Bakris, George; Sorrentino, Matthew (ured.). Hypertension: a companion to Braunwald's heart disease (Third izd.). Philadelphia, PA: Elsevier Health Sciences. str. 242–253. ISBN 9780323508766. OCLC 967938982.
- ^ a b c d e f g Dolphin AC (oktobar 2018). "Voltage-gated calcium channels: their discovery, function and importance as drug targets". Brain and Neuroscience Advances. 2: 2398212818794805. doi:10.1177/2398212818794805. PMC 6179141. PMID 30320224.
- ^ a b c d e f Lipscombe D, Helton TD, Xu W (novembar 2004). "L-type calcium channels: the low down". Journal of Neurophysiology. 92 (5): 2633–41. doi:10.1152/jn.00486.2004. PMID 15486420.
- ^ a b c d e Striessnig J, Pinggera A, Kaur G, Bock G, Tuluc P (mart 2014). "2+ channels in heart and brain". Wiley Interdisciplinary Reviews: Membrane Transport and Signaling. 3 (2): 15–38. doi:10.1002/wmts.102. PMC 3968275. PMID 24683526.
- ^ a b Bodi I, Mikala G, Koch SE, Akhter SA, Schwartz A (decembar 2005). "The L-type calcium channel in the heart: the beat goes on". The Journal of Clinical Investigation. 115 (12): 3306–17. doi:10.1172/JCI27167. PMC 1297268. PMID 16322774.
- ^ "Voltage-gated calcium channels | Introduction | BPS/IUPHAR Guide to PHARMACOLOGY". www.guidetopharmacology.org. Pristupljeno 28. 11. 2019.
- ^ Catterall WA, Perez-Reyes E, Snutch TP, Striessnig J (decembar 2005). "International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels". Pharmacological Reviews. 57 (4): 411–25. doi:10.1124/pr.57.4.5. PMID 16382099.
- ^ a b c d Wahl-Schott C, Baumann L, Cuny H, Eckert C, Griessmeier K, Biel M (oktobar 2006). "Switching off calcium-dependent inactivation in L-type calcium channels by an autoinhibitory domain". Proceedings of the National Academy of Sciences of the United States of America. 103 (42): 15657–62. Bibcode:2006PNAS..10315657W. doi:10.1073/pnas.0604621103. PMC 1622877. PMID 17028172.
- ^ a b c Shaw RM, Colecraft HM (maj 2013). "L-type calcium channel targeting and local signalling in cardiac myocytes". Cardiovascular Research. 98 (2): 177–86. doi:10.1093/cvr/cvt021. PMC 3633156. PMID 23417040.
Dopumska literatura
uredi- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K, et al. (maj 2019). "L-type calcium channel modulates mechanosensitivity of the cardiomyocyte cell line H9c2". Cell Calcium. 79: 68–74. doi:10.1016/j.ceca.2019.02.008. PMID 30836292.
Vanjski linkovi
uredi- "Voltage-Gated Calcium Channels". IUPHAR Database of Receptors and Ion Channels. International Union of Basic and Clinical Pharmacology. Arhivirano s originala, 2. 9. 2012. Pristupljeno 8. 3. 2021.
- L-Type Calcium Channel na US National Library of Medicine Medical Subject Headings (MeSH)