Fluoksimesteron
Fluoksimestron, koji se, između ostalog, prodaje pod markama Halotestin i Ultandren, jest lijek, androgeni i anabolički steroid (AAS) koji koristi se u liječenju niske razine testosterona kod muškaraca, odloženog puberteta kod dječaka, raka dojke kod žena i anemije.[4] Uzima se oralno.
| Fluoksimesteron | ||
|---|---|---|
| Naziv lijeka | Fluoksimesteron | |
| Druga imena | Fluoksimestron; Androfluoren; NSC-12165; 9α-Fluoro-11β-hidroksi-17α-metiltestosteron; 9α-Fluoro-17α-metilandrost-4-en-11β,17β-diol-3-on | |
| Grupa | Androgen; Anabolički steroid | |
| Trgovačka imena | Halotestin, Ora-Testryl, Ultandren i ostala | |
| ||
| ATC kodovi | G03; BA01 | |
| CAS registarski broj | 76-43-7 | |
| ||
| Stručne informacije | ||
| ||
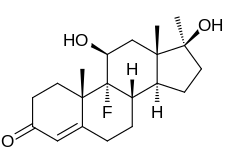 Ime po IUPAC (8S,9R,10S,11S,13S,14S,17S)-9-fluoro-11,17-dihidroksi-10,13,17-trimetil-1,2,6,7,8,11,12,14,15,16-dekahidrociklopenta[a]fenantren-3-on | ||
| Sumarna formula | C20H29FO3 | |
| ||
| Biološka raspoloživost | Oralno: 80%[1] | |
| Metabolizam | Jetreni (6β-hidroksilacija, 5α- i 5β-redukcija, 3α- i 3β-ketooksidacija, 11β-hidroksi-oksidacija) Metaboliti: • 5α‑Dihidrofluoksimesteron[2] • 11-Oksofluoksimesteron | |
| Poluvrijeme eliminacije | 9,2 sati[3] | |
| Izlučivanje | Bubrežno mokraćom MedlinePlus: a682690 PubChem: 6446. | |

Nuspojave i mehanizam
urediNeželjeni efekti fluoksimestterona uključuju simptome maskulinizacije, kao što su akne, povećani rast dlaka, glasovne promjene i povećana seksualna želja.[4] Također može izazvati oštećenje jetre i kardiovaskularne nuspojave poput povišenog krvnog pritiska. Lijek je sintetski androgen i anabolički steroid i stoga je agonist androgenih receptora (AR), biološka meta androgena poput testosterona i dihidrotestosterona (DHT).[5] Ima snažne androgene i umjerene anaboličke efekte, što ga čini korisnim za izazivanje maskulinizacije.[4][6]
Medicinska upotreba
urediFluoksimestron se koristi ili se koristio u liječenju hipogonadizma, odloženog puberteta i anemija kod muškaraca i u liječenju karcinoma dojke kod žena.[4][7] Posebno je odobren u jednoj ili više zemalja za liječenje hipogonadizma kod muškaraca, odgođenog puberteta kod dječaka i raka dojke kod žena.[8]
Fluoksimestron je manje efikasan u indukciji maskulinizacije od testosterona, ali je koristan za održavanje utvrđene maskulinizacije kod odraslih.[9]
Nuspojave
urediNuspojave koje su povezane sa fluoksimestteronom uključuju promjene kao što su akne, edem, seboreja / seboreični dermatitis, alopecija, hirzutizam , produbljivanje glasa, virilizacija općenito, ispiranje, ginekomastija, bol u dojkama, poremećaj menstrualnog ciklusa, hipogonadizam, atrofija testisa, povećanje klitorisa, povećanje penisa, priapizam, povećana agresivnost, povećanje prostate, kardiovaskularna toksičnost i hepatotoksičnost, između ostalog.[4][10]
Farmakologija
uredi| Lijek | Odnosa |
|---|---|
| Testosteron | ~1:1 |
| Androstanolon (DHT, dihidrotestosteron) | ~1:1 |
| Metiltestosteron | ~1:1 |
| Metandriol | ~1:1 |
| Fluoksimesteron | 1:1–1:15 |
| Metandienon | 1:1–1:8 |
| Drostanolon | 1:3–1:4 |
| Metenolon | 1:2–1:30 |
| Oksimetolon | 1:2–1:9 |
| Oksandrolon | 1:3–1:13 |
| Stanozolol | 1:1–1:30 |
| Nandrolon | 1:3–1:16 |
| Etilestrenol | 1:2–1:19 |
| Noretandrolon | 1:1–1:20 |
| Napomene: kod glodara. Fusnote: a = Odnos androgena – anabolička aktivnost. Izvori: [11]:735[12][13][14] | |
Farmakodinamika
urediKao AAS, fluoksimestron je agonist androgenih receptora (AR), slično androgenima, kao što su testosterona i DHT.[4][15] To je supstrat za enzim 5α-reduktaza, poput testosterona, pa je tako pojačan u takozvanim "androgenim" tkivima poput kože, folikula dlaka i prostate putem metabolizam transformacija u 5α-dihidrofluoksimestron. Kao takav, fluoksimestron ima relativno loš odnos anaboličke i androgene aktivnosti, slično testosteronu i metiltestosteronu.[4][15] Međutim, fluoksimestester je ipak proporcionalno manje androgen i više anaboličan od metiltestosterona i testosterona.[6]
Izvješteno je da fluoksimestester nije – aromatizibilan zbog sterne smetnje njegove C11β hidroksilne grupe,[16] i stoga se ne smatra sklonim proizvodnji estrogenih efekata kao što su ginekomastija ili zadržavanje tečnosti.[4][17] Međutim, paradoksalno, postoji prikaz slučaja ozbiljne ginekomastije izazvane fluoksimestronom, a ginekomastija povezana sa fluoksimestteronom je zabilježena i u drugim publikacijama, iako to možda nije zbog estrogene aktivnosti.[18] Smatra se da fluoksimestron ima malu ili nikakvu progestogenu aktivnost.[4][15]
Hemija
urediFluoksimestron, poznat i kao 9α-fluoro-11β-hidroksi-17α-metiltestosteron ili kao 9α-fluoro-17α-metilandrost-4-en-11β, 17β-diol-3-on, je sintetički androstan steroid i 17α-alkilirani derivat testosterona (androst-4-en-17β-ol- 3-on).[19][20] To je specifično derivat testosterona sa atomom fluora na položaju C9α, hidroksilne grupe na položaju C11β i metil grupe na položaju C17α.
Sinteza
urediPrvi korak u sintezi fluoksimestterona je mikrobiološka oksidacija komercijalno dostupnog androstenediona (1.1) pomoću Actinomyces; ovo uvodi hidroksilnu grupu u položaj 11 (1.12), koji se zatim oksidira u keton, pomoću Jonesovog reagensa, dajući 3,11,17-triketon, adrenosteron (1.13). Pirolidin tada reagira, formirajući enamin (1.14) reakcijom sa 3α-keto grupom, štiteći ga od alkilacije u narednom koraku. Regioselektivnost pirolidina za reakciju na položaju 3α u strukturi adrenosterona javlja se inherentno, zbog položaja sterilno glomaznih metilnih grupa. U narednim koracima, alkilacija 17-keto grupe (1.14), upotrebom Grignardovog reagensa, dodavanje hidrida u položaju 11 (1.15) i regeneracija zaštićene 3-keto grupe daje početni materijal (1.16) za završne korake sinteze fluoksimestterona. To uključuje više standardnih sintetskih transformacija.
Drugi korak: 11α-hidroksil početnog materijala (1.16) sulfonira se pomoću p-toluensulfonil hlorida; dodavanjem trimetilamina (baza) deprotonira 11α-ugljik, dajući (E2) eliminaciju tozilata (pka–5) dajući olefin (1.17). Stereospecifičnost reakcije između olefina i hipobromne kiseline (HOBr) u bazi, N-bromosukcinimida (NBS), određuje se stvaranjem bromonijevog intermedijera. Elektrofilni kation bromonija približava se prstenu manje sterno ometanom α-licu i napada ga π-elektronska gustoća alkena. Hidroksidni ion zatim napada iznad prstena (β-lice) na 11-ugljik, što rezultira strukturom (1.18) stereospecifičnim dodavanjem hidroksila i broma preko dvostruke veze. Dodavanjem natrij-hidroksida dolazi do deprotoniranja 11α-hidroksila, a naknadna struktura prolazi kroz intramolekulsko stvaranje SN2 epoksi prstena. Epoksidni prsten β-epoksida (1.19) protonira se, dajući intermedijer oksironijevog iona. U usklađenom procesu, fluorid napada α-površinu prstena odozdo, jer je jedna od dvije veze kisik-ugljik prekinuta na suprotnoj strani; otuda se regenerira 11α- hidroksil trans do supstituenta fluora. Dobijena struktura (1.20) je androgeni steroid,
Reference
uredi- ^ Thomas L. Lemke; David A. Williams (24. 1. 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. str. 1360–. ISBN 978-1-60913-345-0.
- ^ Kammerer RC, Merdink JL, Jagels M, Catlin DH, Hui KK (1990). "Testing for fluoxymesterone (Halotestin) administration to man: identification of urinary metabolites by gas chromatography-mass spectrometry". J. Steroid Biochem. 36 (6): 659–66. doi:10.1016/0022-4731(90)90185-u. PMID 2214783.
- ^ Thomas L. Lemke; David A. Williams (2008). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. str. 1279–. ISBN 978-0-7817-6879-5.
- ^ a b c d e f g h i William Llewellyn (2011). Anabolics. Molecular Nutrition Llc. str. 500–508. ISBN 978-0-9828280-1-4.
- ^ Kicman AT (2008). "Pharmacology of anabolic steroids". Br. J. Pharmacol. 154 (3): 502–21. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ a b Charles D. Kochakian (6. 12. 2012). Anabolic-Androgenic Steroids. Springer Science & Business Media. str. 370, 374, 401, 454, 504–506. ISBN 978-3-642-66353-6.
- ^ Susan M. Ford; Sally S. Roach (7. 10. 2013). Roach's Introductory Clinical Pharmacology. Lippincott Williams & Wilkins. str. 502–. ISBN 978-1-4698-3214-2.
- ^ http://adisinsight.springer.com/drugs/800012288
- ^ John A. Thomas; Edward J. Keenan (6. 12. 2012). Principles of Endocrine Pharmacology. Springer Science & Business Media. str. 125–. ISBN 978-1-4684-5036-1.
- ^ Jerome Z. Litt; Neil Shear (17. 12. 2014). Litt's Drug Eruptions and Reactions Manual, 19th Edition. CRC Press. str. 177–. ISBN 978-1-84214-599-9.
- ^ Chrousos, George P. (2012). "The Gonadal Hormones & Inhibitors". u Katzung, Bertram G. (ured.). Basic & Clinical Pharmacology. New York London: McGraw-Hill Medical McGraw-Hill distributor. str. 735. ISBN 0071764011.
- ^ Potts GO, Arnold A, Beyler AL (1976). "Dissociation of the Androgenic and Other Hormonal Activities from the Protein Anabolic Effects of Steroids". u Kochakian CD (ured.). Anabolic-Androgenic Steroids. Handbook of Experimental Pharmacology. 43. str. 361–406. doi:10.1007/978-3-642-66353-6_11.
- ^ Ashraf Mozayani; Lionel Raymon (15. 10. 2003). Handbook of Drug Interactions: A Clinical and Forensic Guide. Springer Science & Business Media. str. 504–. ISBN 978-1-59259-654-6.
- ^ Camerino, B.; Sala, G. (1960). "Anabolic Steroids". Progress in Drug Research. str. 71–134. doi:10.1007/978-3-0348-7038-2_2.
- ^ a b c Kicman, A T (2008). "Pharmacology of anabolic steroids". British Journal of Pharmacology. 154 (3): 502–521. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR (2008). "Dimethandrolone (7alpha,11beta-dimethyl-19-nortestosterone) and 11beta-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase". J. Steroid Biochem. Mol. Biol. 110 (3–5): 214–22. doi:10.1016/j.jsbmb.2007.11.009. PMC 2575079. PMID 18555683.
- ^ Norman T. Adler; Donald Pfaff; Robert W. Goy (6. 12. 2012). Reproduction. Springer Science & Business Media. str. 630–. ISBN 978-1-4684-4832-0.
- ^ Lo TE, Andal ZC, Lantion-Ang FL (2015). "Fluoxymesterone-induced gynaecomastia in a patient with childhood aplastic anaemia". BMJ Case Rep. 2015: bcr2014207474. doi:10.1136/bcr-2014-207474. PMC 4434366. PMID 25948845.
- ^ J. Elks (14. 11. 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. str. 568–. ISBN 978-1-4757-2085-3.
- ^ Index Nominum 2000: International Drug Directory. Taylor & Francis. januar 2000. str. 461. ISBN 978-3-88763-075-1.