Fibrilin
Fibrillin je glikoprotein, koji je ključni za formiranje elastičnih vlakana, nađen u vezivnom tkivu.[2] Fibrillin se luči u vanćelijski matriks iz fibroblasta i ugrađuje se u nerastvorljive milrofibrile, koji se javljaju kao skele za deponirani elastin.[3]
| Fibrilin 1 | |||||||
|---|---|---|---|---|---|---|---|
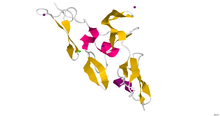 Kristalografija X-zrakama; Kristalografska struktura regije cbEGF9-hibrida 2-cbEGF10 ljudskog fibrilina 1.[1] | |||||||
| Identifikatori | |||||||
| Simbol | FBN1 | ||||||
| Alt. simboli | FBN, MFS1, WMS | ||||||
| NCBI gen | 2200 | ||||||
| HGNC | 3603 | ||||||
| OMIM | 134797 | ||||||
| PDB | 2W86 | ||||||
| RefSeq | NM_000138 | ||||||
| UniProt | P35555 | ||||||
| Ostali podaci | |||||||
| Lokus | Hrom. 15 q21.1 | ||||||
| |||||||
| fibrillin 2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | FBN2 | ||||||
| Alt. simboli | CCA | ||||||
| NCBI gen | 2201 | ||||||
| HGNC | 3604 | ||||||
| OMIM | 121050 | ||||||
| RefSeq | NM_001999 | ||||||
| UniProt | P35556 | ||||||
| Ostali podaci | |||||||
| Lokus | Hrom. 5 q23-q31 | ||||||
| |||||||
| fibrillin 3 | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | FBN3 | ||||||
| NCBI gen | 84467 | ||||||
| HGNC | 18794 | ||||||
| OMIM | 608529 | ||||||
| RefSeq | NM_032447 | ||||||
| UniProt | Q75N90 | ||||||
| Ostali podaci | |||||||
| Lokus | Hrom. 19 p13 | ||||||
| |||||||
Klinički značaj
urediMutatacije u genima FBN1 i FBN2 vezane su sa adolescentnom idiopatskom skoliozom .[4]
Tipovi
urediFibrillin-1
urediFibrilin-1 je glavna komponenta mikrofibrila koja tvori list koji okružuje amorforasti elastin. Vjeruje se da su mikrofibrile građene od polimera fibrillina koji su povezani u nizu. Do danas, opisane su tri oblika ofibrilina. Protein fibriliny-1 izolirao je Engvall, 1986.,[5] i mutacije u genu FBN1, koje su uzrok Marfanovog sindroma.[6][7] Ovaj protein nađen je kod ljudi, a njegov kodirajući gen nalazi se na hromosonu 15. Do danas je opisano više nego 1500 različitih mutacija odgovornog gena.[1][7]
Struktura
urediNe postoji potpuna, visokrezolucijska struktura fibrilina-1. Umjesto toga, rekombinacijski su prouzvedeni kratki fragmenti,a njihova struktura je riješena putem kristalografije X-zracima ili pomoću NMR spektroskopije. Nedavni primjer je struktura fibrilina-1 hibridnog 2 domena, u kontekstu bočnog vezanja kalcija domena epidermalnog faktora rasta, koja je određena pomoću kristalografija X-zraka, u rezoluciji od 1,8 Å.[1] Mikrofibrili koji se sastoje od fibrilinskih proteina koji su odgovorni za različite ćelijske interakcije u ljudskom tijelu.
Fibrilin-2
urediFibrilin-2 je izolirao Zhang, 1994.[8] i smatra se da ima ulogu u ranoj elastogenezi. Mutacije u genu fibrilina-2 su povezane sa Bealovim sindrom.
Fibrilin-3
urediMnogo prije opisan je fibrilin-3, a vjeruje se da se pretežno nalazi u mozgu.[9] Zajedno sa mozgom, fibrilina-3 je lokaliziran i u gonadnom i jajničkom polju miševa.
Fibrilin-4
urediFibrilin-4 je prvo opisan kod ribe zebra, sa sekvencom koja je slična onoj u fibrilinu-2.[10]
Također pogledajte
urediReference
uredi- ^ a b c PDB 2W86; Jensen SA, Iqbal S, Lowe ED, Redfield C, Handford PA (maj 2009). "Structure and interdomain interactions of a hybrid domain: a disulphide-rich module of the fibrillin/LTBP superfamily of matrix proteins". Structure. 17 (5): 759–68. doi:10.1016/j.str.2009.03.014. PMC 2724076. PMID 19446531.CS1 održavanje: upotreba parametra authors (link)
- ^ Kielty CM, Baldock C, Lee D, Rock MJ, Ashworth JL, Shuttleworth CA (februar 2002). "Fibrillin: from microfibril assembly to biomechanical function". Philos. Trans. R. Soc. Lond., B, Biol. Sci. 357 (1418): 207–17. doi:10.1098/rstb.2001.1029. PMC 1692929. PMID 11911778.CS1 održavanje: upotreba parametra authors (link)
- ^ Singh (2006). Textbook of human histology. Jaypee Brothers Publishers. str. 64–. ISBN 978-81-8061-809-3. Arhivirano s originala, 17. 6. 2013. Pristupljeno 9. 12. 2010.
- ^ Buchan, J. G.; Alvarado, D. M.; Haller, G. E.; Cruchaga, C; Harms, M. B.; Zhang, T; Willing, M. C.; Grange, D. K.; Braverman, A. C.; Miller, N. H.; Morcuende, J. A.; Tang, N. L.; Lam, T. P.; Ng, B. K.; Cheng, J. C.; Dobbs, M. B.; Gurnett, C. A. (2014). "Rare variants in FBN1 and FBN2 are associated with severe adolescent idiopathic scoliosis". Human Molecular Genetics. 23: 5271–5282. doi:10.1093/hmg/ddu224. PMID 24833718.
- ^ Sakai LY, Keene DR, Engvall E (decembar 1986). "Fibrillin, a new 350-kD glycoprotein, is a component of extracellular microfibrils". J. Cell Biol. 103 (6 Pt 1): 2499–509. doi:10.1083/jcb.103.6.2499. PMC 2114568. PMID 3536967.CS1 održavanje: upotreba parametra authors (link)
- ^ Dietz HC; Guttmacher, Alan E.; Dietz, Harry C. (august 2010). "New therapeutic approaches to mendelian disorders". N. Engl. J. Med. 363 (9): 852–63. doi:10.1056/NEJMra0907180. PMID 20818846.
- ^ a b von Kodolitsch Y (2015). "Perspectives on the revised Ghent criteria for the diagnosis of Marfan syndrome". Application of Clinical Genetics. 8: 137–155. doi:10.2147/TACG.S60472. PMC 4476478. PMID 26124674.
- ^ Zhang H, Apfelroth SD, Hu W et al. (1994). "Structure and expression of fibrillin-2, a novel microfibrillar component preferentially located in elastic matrices". J. Cell Biol. 124 (5): 855–63. doi:10.1083/jcb.124.5.855. PMC 2119952. PMID 8120105.CS1 održavanje: upotreba parametra authors (link)
- ^ Corson GM, Charbonneau NL, Keene DR, Sakai LY (mart 2004). "Differential expression of fibrillin-3 adds to microfibril variety in human and avian, but not rodent, connective tissues". Genomics. 83 (3): 461–72. doi:10.1016/j.ygeno.2003.08.023. PMID 14962672.CS1 održavanje: upotreba parametra authors (link)
- ^ Gansner JM, Madsen EC, Mecham RP, Gitlin JD (oktobar 2008). "Essential role for fibrillin-2 in zebrafish notochord and vascular morphogenesis". Dev. Dyn. 237 (10): 2844–61. doi:10.1002/dvdy.21705. PMC 3081706. PMID 18816837.CS1 održavanje: upotreba parametra authors (link)
Vanjski linkovi
uredi- Fibrillin na US National Library of Medicine Medical Subject Headings (MeSH)