Adenozintrifosfataza
Adenozintrifosfataza (3.6.1.3) – adenilpirofosfataza, ATP monofosfataza, ATPaza, SV40 T-antigen, adenozin 5'-trifosfataza, ATP hidrolaza, kompleks V (mitohondrijski elektronski transport), (Ca2+ + Mg2+)-ATPaza, HCO3--ATPaza, adenozinska trifosfataza) – je enzim sa sistemskim imenom ATP fosfohidrolaza.[1][2][3][4][5][6]
| Adenozintrifosfataza | |
|---|---|
| Identifikatori | |
| Simbol | ? |
| CAS broj | |
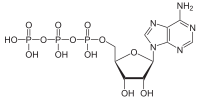
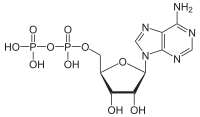
ATPaza katalizira slijedeću hemijsku reakciju:
Mnogi enzimi koji su nekada bili obuhvaćeni ovom klasom, sada su u klasama EC 3.6.3 i EC 3.6.4.
Funkcije
urediTransmembranski ATPaze unose mnoge metabolite koji su potrebni za ćelijski metabolizam i odnošenje toksina, otpada i rastvorenih materija koje mogu ometati ćelijske procese. Važan primjer je natrij-kalij mjenjač (iliNa+/K+ATPaza) koja održava potencijal ćelijske membrane. Primjer je I vodik kalij ATPaza (H+/K+ATPAZA) ili protonska pumpa želuca koja zakiseljava njegov sadržaj. Osim uloge izmjenjivača, druge kategorije transmembranskih ATPaza uključuju ko-transporterske pumpe (međutim, neki izmjenjivači su pumpe). Neki od njih, poput Na+/K+ATPaze, učestvuju u mreži protoka punjenja, ali drugi ne. Oni se nazivaju "elektrogeni" i "neelektrogeni" transporteri.[7]
Mehanizam
urediSpajanje između ATP hidrolize i transporta je više ili manje stroga hemijska reakcija, u kojoj se određeni broj rastvorenih molekula prenosi na svaku molekulu ATP koja se hidrolizira; naprimjer, 3 Na+ ion iz ćelije i 2 K+ ion unutra po hidroliziranom ATP, za Na+/K+ izmjenjivač. Transmembranske ATPaze koriste hemijski potencijal energije ATP, jer oni obavljaju mehanički rad: oni transportiraju rastvorene supstance u smjeru suprotnom od svoje termodinamičkih preferiranih pravaca kretanja, to jest, sa strane membrane, gdje su u niskoj, na stranu gdje su u visokoj koncentraciji. Ovaj proces se označava kao aktivni transport.[8][9]
Nprimjer, blokiranje vezikulskih H+-ATPaza može unutar vezikule povećati pH vrijednost, a smanjiti je u citoplazmi.
Transmembranske ATP sintaze
urediATP sintaza mitohondrija i hloroplasta je anabolički enzim koji iskorištava energiju transmembranskog protonskog gradijenta kao izvor energije za dodavanje grupe neorganskog fosfata na molekulu adenozin difosfata (ADP) za formiranje molekule adenozin trifosfata (ATP).
Ovaj enzim djeluje kada proton obara gradijent koncentracije, dajući enzimu spinovano ketanje. Ovo je jedinstvena spinska veza zajedničkog kretanja ADP i P, kako bi nastao ATP.
ATP sintaza može funkcionirati u obrnuto, to jest, korištenjem energije koji oslobađa hidroliza ATP, za pumpanje protona protiv njihovog elektrohemijskog gradijenta.
Klasifikacija
urediPostoje različiti tipovi ATPaze, koji se međusobno razlikuju (funkcijski i strukturno sinteza i/ili hidroliza ATP) (F-, V- i A-ATPaze sadrže rotirajuče motore) i po tipu iona koe transportiraju.
- F-ATPaza (F1FO-ATPaze) u mitohondrijama, hloroplastima i bakterijskim plazma membranama su prvi proizvođači ATP, upotrebom protonskog gradijenta, koji je generiran u oksidacijskoj fosforilaciji (mitohondrije) ili fotosintezi (hloroplasti).
- V-ATPaze (V1VO-ATPaze) su prvenstveno nađene u eukariotskim vakuolama, gdje kataliziraju hidrolizu ATP za transport rastvorenih materija, nižeg pH i organela, kao što su protonske pumpe lizosoma.
- A-ATPaze (A1AO-ATPaze) su nađene kod Archaea, a funkcioniraju slično F-ATPazama.
- P-ATPaze (E1E2-ATPaze) su nađene kod bakterija, gljiva , u eukariotskim plazma membranama i organelama, a služ e za transprt različitih iona duž membrana.
- E-ATPaze du površinski ćelijski enzimi koji hidroliziraju moguće NTP, uključujući i vanćelijski ATP.
P-ATPaza
urediP-ATPazes (poznate i kao E1-E2 ATPaze) su nađene kod bakterija i u plazma mebranama eukariotskih organela. Njihovo ime potiče od kratkog vremena vezanost anorganskog fosfata za ostatke aspartats u trenutku aktivacije. Funkcija P-ATPaza je transport različitih spojeva, kao što su ioni i fosfolipidi, kroz membranu, pomoću energije koja nastaje hidrolizom ATP. Postoji mnogo različitih klasa P-ATPaza, koje prenose određenu vrstu iona. P-ATPaze se mogu sastojati od jednog ili dva polipeptida, a obično mogu imati dvije glavne konformacije, E1 i E2.
ATPazni geni čovjeka
uredi- Transportirajuća Na+/K+: ATP1A1, ATP1A2, ATP1A3, ATP1A4, ATP1B1, ATP1B2, ATP1B3, ATP1B4
- Ca++: ATP2A1, ATP2A2, ATP2A3, ATP2B1, ATP2B2, ATP2B3, ATP2B4, ATP2C1, ATP2C2
- Transportirajući Mg++: ATP3
- Razmjenska H+/K+: ATP4A
- Transportirajući H+, mitohondrijska: ATP5A1, ATP5B, ATP5C1, ATP5C2, ATP5D, ATP5E, ATP5F1, ATP5G1, ATP5G2, ATP5G3, ATP5H, ATP5I, ATP5J, ATP5J2, ATP5L, ATP5L2, ATP5O, ATP5S
- H+, lizosomska: ATP6AP1, ATP6AP2, ATP6V1A, ATP6V1B1, ATP6V1B2, ATP6V1C1, ATP6V1C2, ATP6V1D, ATP6V1E1, ATP6V1E2, ATP6V1F, ATP6V1G1, ATP6V1G2, ATP6V1G3, ATP6V1H, ATP6V0A1, ATP6V0A2, ATP6V0A4, ATP6V0B, ATP6V0C, ATP6V0D1, ATP6V0D2, ATP6V0E
- Transportirajuća Cu++: ATP7A, ATP7B
- Klasa I, tip 8: ATP8A1, ATP8B1, ATP8B2, ATP8B3, ATP8B4
- Klasa II, tip 9: ATP9A, ATP9B
- Klasa V, tip 10: ATP10A, ATP10B, ATP10D
- Klasa VI, tip 11: ATP11A, ATP11B, ATP11C
- Transportirajuća H+/K+, negastrična: ATP12A
- Tip 13: ATP13A1, ATP13A2, ATP13A3, ATP13A4, ATP13A5
Također pogledajte
urediReference
uredi- ^ Geider, K. and Hofmann-Berling, H. (1981). "Proteins controlling the helical structure of DNA". Annu. Rev. Biochem. 50: 233–260. PMID 6267987.CS1 održavanje: više imena: authors list (link)
- ^ Kielley, W.W. (1961). "Myosin adenosine triphosphatase". u Boyer, P.D., Lardy, H. and Myrbäck, K. (ured.). The Enzymes. 5 (2nd izd.). New York: Academic Press. str. 159–168.CS1 održavanje: više imena: editors list (link)
- ^ Martin, S.S. and Senior, H.E. (1980). "Membrane adenosine triphosphatase activities in rat pancreas". Biochim. Biophys. Acta. 602: 401–418. PMID 6252965.CS1 održavanje: više imena: authors list (link)
- ^ Njus, D., Knoth, J. and Zallakian, M. (1981). "Proton-linked transport in chromaffin granules". Curr. Top. Bioenerg. 11: 107–147.CS1 održavanje: više imena: authors list (link)
- ^ Riley, M.V. and Peters, M.I. (1981). "The localization of the anion-sensitive ATPase activity in corneal endothelium". Biochim. Biophys. Acta. 644: 251–256. PMID 6114746.CS1 održavanje: više imena: authors list (link)
- ^ Tjian, R. (1981). "Regulation of viral transcription and DNA replication by the SV40 large T antigen". Curr. Top. Microbiol. Immunol. 93: 5–24. PMID 6269805.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
- ^ Kapur Pojskić L. (2014). Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-8-3.
- ^ Međedović S., Maslić E., Hadžiselimović R. Biologija 2. Svjetlost, Sarajevo. ISBN 9958-10-222-6.CS1 održavanje: više imena: authors list (link)
Vanjski linkovi
uredi- Adenosinetriphosphatase na US National Library of Medicine Medical Subject Headings (MeSH)
