ADP-faktor ribozilacije
ADP-faktori ribozilacije (ARF) su članovi ARF porodice GTP-vezujućih proteina iz natporodice Ras. Proteini porodice ARF su sveprisutni u eukariotskim ćelijama, a u ćelijama sisara identifikovano je šest visoko konzerviranih članova porodice. Iako su ARF rastvorljivi, općenito se povezuju sa membranama zbog miristoilacija N-terminala Oni funkcionišu kao regulatori vezikulskog prometa i remodeliranja aktina.
| ADP-faktor ribozilacije | |
|---|---|
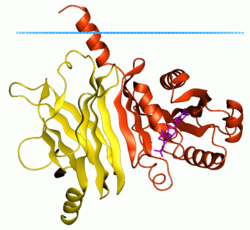 Protein 2 sličan faktoru ribozilacije ADP, vezan na membranu (ARL2 miša, crveno), kompleks sa fosfodiesterazom delta (žuta) (1ksg) Plave tačke pokazuju granicu ugljikovodičnog lipidnog dvosloja | |
| Identifikatori | |
| Simbol | Arf |
| ADP-faktor ribozilacije | |
|---|---|
 | |
| Identifikatori | |
| Simbol | ARF |

Mali ADP ribozilacijski faktor (Arf) GTP-vezujući proteini su glavni regulatori biogeneze vezikula u unutarćelijskom prometu.[1] Oni su osnivači rastuće porodice koja uključuje Arl (Arf-like), Arp (Arf-srodne proteine) i daljinski srodne Sar (povezane sa sekrecijom i Ras-srodne proteine). Arf proteini kruže između neaktivnih GDP-vezanih i aktivnih GTP-vezanih oblika koji se selektivno vezuju za efektore. Klasični strukturni GDP/GTP prekidač karakterizira se konformacijskim promjenama u takozvanim regijama prekidača 1 i prekidača 2, koji se čvrsto vezuju za gama-fosfat GTP-a, ali slabo ili nikako za GDP nukleotid. Strukturne studije Arf1 i Arf6 otkrile su da, iako ovi proteini imaju konformacijske promjene prekidača 1 i 2, odstupaju od drugih malih GTP-vezujućih proteina po tome što koriste dodatni, jedinstveni prekidač za propagiranje strukturnih informacija s jedne strane proteina na drugu.
Strukturni ciklusi GDP/GTP ljudskih Arf1 i Arf6 karakterišu jedinstvenu konformacijsku promjenu koja utiče na beta2beta3 lance koji povezuju prekidač 1 i prekidač 2 (međuprekidač), kao i na amfipatijski spiralni N-terminal. U Arf1 i Arf6 vezanim za GDP, međuprekidač se uvlači i formira džep za koji se veže spirala N-terminal, a potonji služi kao molekulski sklop za održavanje neaktivne konformacije. U GTP-vezanom obliku ovih proteina, međuprekidač prolazi kroz pomak registra s dva ostatka koji povlači prekidač 1 i prekidač 2 prema gore, vraćajući aktivnu konformaciju koja može vezati GTP. U ovoj konformaciji, međuprekidač izlazi iz proteina i istiskuje N-terminalnu kopču, zatvarajući njen džep za vezivanje.
Regulatorni proteini
urediARF se redovno povezuju s dvije vrste proteina, onima koji su uključeni u katalizu razmjene GTP/GDP i onima koji služe drugim funkcijama. ARF djeluju kao regulatorna podjedinica koja kontroliše sklop omotača u proteinu omotača I (COPI) i vezikule obložene klatrinom.
GTP/GDP proteini za razmjenu
urediARF se vezuje za dva oblika gvanozin-nukleotida, gvanozin.trifosfata (GTP) i gvanozin-difosfata (GDP). Oblik ARF molekula zavisi od oblika za koji je vezan, što mu omogućava da služi u regulatornom kapacitetu. ARF zahtijeva pomoć drugih proteina kako bi se prebacio između vezivanja za GTP i GDP. GTPaza-aktivirani proteini (GAP-i) prisiljava Arf da hidrolizira vezu GTP za GDP, a faktor zamjene guaninskih nukleotida prisiljava ARF da usvoji novu molekulu GTP, umjesto vezanog GDP-a .
Ostslii proteini
urediOstali proteini stupaju u interakciju s ARF, ovisno o tome da li je vezan za GTP ili GDP. Aktivni oblik, ARF*GTP, vezuje se za proteine omotača vezikula i adaptere, uključujući protein omotača I (COPI) i različite fosfolipide. Poznato je da se neaktivni oblik vezuje samo za klasu transmembranskih proteina.
Različiti tipovi ARF-a vezuju specifično različite vrste efektorskih proteina.
Filogenija
urediPostoji šest poznatih sisarskih ARF proteina, koji su podijeljeni u tri klase ARF-a:
Struktura
urediARF su mali proteini veličine približno 20 kDa. Sadrže dva preklopna regiona, koji mijenjaju relativne pozicije između ciklusa GDP/GTP-vezivanja. ARF su često miristoilirani u svom N-terminalnom području, što doprinosi njihovoj membranskoj povezanosti.
Primjeri
urediLjudski geni koji kodiraju proteine koji sadrže ovaj proteinski domen uključuju:
Također pogledajte
urediReference
uredi- ^ Pasqualato S, Renault L, Cherfils J (2002). "Arf, Arl, Arp and Sar proteins: A family of GTP-binding proteins with a structural device for 'front-back' communication". EMBO Reports. 3 (11): 1035–1041. doi:10.1093/embo-reports/kvf221. PMC 1307594. PMID 12429613.
Dopunska literatura
uredi- Donaldson JG, Honda A (2005). "Localization and function of Arf family GTPases". Biochemical Society Transactions. 33 (4): 639–642. doi:10.1042/BST0330639. PMID 16042562.
- Nie Z, Hirsch DS, Randazzo PA (2003). "Arf and its many interactors". Current Opinion in Cell Biology. 15 (4): 396–404. doi:10.1016/S0955-0674(03)00071-1. PMID 12892779.
- Amor JC, Harrison DH, Kahn RA, Ringe D (1994). "Structure of the human ADP-ribosylation factor 1 complexed with GDP". Nature. 372 (6507): 704–708. Bibcode:1994Natur.372..704C. doi:10.1038/372704a0. PMID 7990966. S2CID 4362056.
- Moss J, Vaughan M; Vaughan (1995). "Structure and function of ARF proteins: Activators of cholera toxin and critical components of intracellular vesicular transport processes". The Journal of Biological Chemistry. 270 (21): 12327–12330. doi:10.1074/jbc.270.21.12327. PMID 7759471.
- Boman AL, Kahn RA; Kahn (1995). "Arf proteins: The membrane traffic police?". Trends in Biochemical Sciences. 20 (4): 147–150. doi:10.1016/s0968-0004(00)88991-4. PMID 7770914.
- Kahn RA, Kern FG, Clark J, Gelmann EP, Rulka C (1991). "Human ADP-ribosylation factors. A functionally conserved family of GTP-binding proteins". The Journal of Biological Chemistry. 266 (4): 2606–2614. doi:10.1016/S0021-9258(18)52288-2. PMID 1899243.
Vanjski linkovi
urediEukaryotic Linear Motif resource motif class TRG_Cilium_Arf4_1