Siderofor
Siderofori (grč. σίδηρος – sídēros = gvožđe + φόρος – foros = nosač; nosač gvožđa) su mala, visoko afinitetna gvožđem-helirani spojevi koje izlučuju mikroorganizmi poput bakterija i gljiva i služe prvenstveno za transport gvožđaa preko ćelijskih membrana,[2][3][4][5] iako se sada procjenjuje širi raspon funkcija siderofora[6] Siderofori su među najjačim poznatim agensima za vezanje Fe3+.
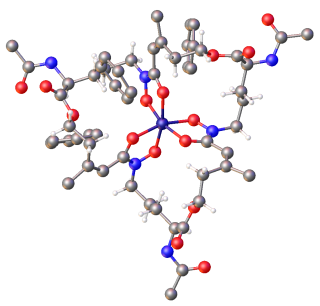
(crveno = kisik, sivo = ugljik, plavo = dušik, tamnoplavo = gvožđe).[1]

Oskudica rastvorljivog gvožđa
urediIako je jedan od najzastupljenijih elemenata u Zemljinoj kori, gvožđe nije lahko bioraspoloživo. U većini aerobnih okruženja, poput tla ili mora, postoji u gvožđevom (Fe3+) stanju, koje ima tendenciju da stvara netopive čvrste materije slične hrđi. Da bi bile efikasne, hranjive tvari ne samo da moraju biti dostupne, već moraju biti i rastvorljive.[7] Mikrobi oslobađaju siderofore za uklanjanje gvožđa iz ovih mineralnih faza stvaranjem topivih Fe3+ kompleksa, koji se mogu preuzeti mehanizmima aktivnog transporta. Mnogi siderofori su neribosomski peptidi,[3][8] iako ih se nekoliko biosintezira nezavisno.[9]
Kod nekih patogenih bakterija, siderofori su važni i za dobijanje gvožđa .[3][4][10] Kod sisarskih domaćina gvožđe je čvrsto vezano za proteine kao što su hemoglobin, transferin, laktoferin i feritin. Stroga homeostaza gvožđa dovodi do slobodne koncentracije od oko 10−24 molL−1,[11] zbog čega postoje veliki evolucijski pritisci na patogene bakterije da bi se dobio ovaj metal. Naprimjer, patogeni antraks Bacillus anthracis oslobađa dva siderofora, bacilibaktin i petrobaktin, kako bi se gvožđe odvojilo od proteina. Iako je dokazano da se bacilibaktin veže na imunskog sistema proteinskog siderokalina,[12] pretpostavlja se da petrobaktin izbjegava imunski sistem što se pokazalo važnim za virulenciju kod miševa.[13]
Siderofori su među najjačim vezovima za Fe3+, s tim što je enterobaktin jedan od najsnažnijih među njima.[11] Zbog ovog svojstva privukli su interes medicinske nauke za metalnu helacijsku terapiju, sa siderofornim desferrioksaminom B koji dobija široku upotrebu u tretmanima trovanja gvožđem i talasemije.[14]
Pored siderofora, neke patogene bakterije proizvode hemofore (hem-vežuće proteine) koji uklanjaju ili imaju receptore koji se direktno vežu za proteine gvožđa/hema.[15] U eukariota, druge strategije za povećanje topivosti i apsorpcije gvožđa su zakiseljavanje okoline (npr. koriste ga korijeni biljaka) ili vanćelijska redukcija Fe3+ u topivije ione Fe2+.
Struktura
urediSiderofori obično čine stabilan, heksadentatni, oktaedar, preferencijalno sa Fe3+ u poređenju sa drugim prirodnim obilnim metalnim ionima, iako prisustvo vode manje od šest donorskih atoma može također koordinirati. Najučinkovitiji siderofori su oni koji imaju tri bidentatna liganda po molekuli, tvoreći heksadentatni kompleks i uzrokujući manju entropijsku promjenu od one izazvane heliranjem jednog gvožđevog iona s odvojenim ligandima.[16] Fe3+ je jaka Lewisova kiselina, preferirajući jake Lewisove baze. kao što su anionski ili neutralni atomi kisika sa kojima se koordinira. Mikrobi obično oslobađaju gvožđe iz siderofora, redukcijom na Fe2+ koji ima mali afinitet za ove ligande.[2][8]
Siderofori se obično klasifiraju po ligandima koji se koriste za helatiranje feri gvožđa. Glavne skupine siderofora uključuju kateholate (fenolati), hidroksamate i karboksilate (npr. derivati [[limunska kiselina|limunske kiseline.[3] Citric acid can also act as a siderophore.[17] Široka raznolikost siderofora može biti posljedica evolucijskih pritisaka na mikrobe koji proizvode strukturno različite siderofore koji se ne mogu transportirati specifičnim aktivnim transportnim sistemima drugih mikroba ili u slučaju patogena koji deaktivira organizam domaćina.[3][10]
Raznolikost
urediPrimjeri siderofora koje proizvode razne bakterije i gljive:
Hidroksamatski siderofori
| Siderofor | Organizam |
|---|---|
| Ferihrom | Ustilago sphaerogena |
| Dezferioksamin B | Streptomyces pilosus |
| Dezferioksamin E | Streptomyces coelicolor |
| Fuzarinin C | Fusarium roseum |
| Ornibaktin | Burkholderia cepacia |
| Rodotorulna kiselina | Rhodotorula pilimanae |
Kateholatni siderofori
| Siderofor | Organizam |
|---|---|
| Enterobaktin | Escherichia coli
crijevna bakterija |
| Bacilibaktin | Bacillus subtilis |
| Vibriobaktin | Vibrio cholerae |
Mješoviti ligandi
| Siderofor | Organizam |
|---|---|
| Azotobaktin | Azotobacter vinelandii |
| Pioverdin | Pseudomonas aeruginosa |
| Jersiniabaktin | Yersinia pestis |
Sveobuhvatan popis struktura siderofora (preko 250) dat je u Dodatku 1. kao referenca.[3]
Biološka funkcija
urediBakterije i gljive
urediKao odgovor na ograničenje gvožđa u njihovoj okolini, geni koji sudjeluju u proizvodnji i usvajanju mikrobnih siderofora su depresivni, što dovodi do proizvodnje siderofora i odgovarajućih proteina koje usvajaju. U bakterijama, Fe2+-zavisni represori vežu se za DNK, uzvodno od gena koji su uključeni u proizvodnju siderofora pri visokim unutarćelijskim koncentracijama gvožđa. U malim koncentracijama, Fe2+ se disocira od represora, koji se pak disocira od DNK, što dovodi do transkripcije gena. U Gram-negativnim i AT-bogatim Gram-pozitivnim bakterijama to obično regulira represor Fur (regulator usvajanja gvožđa), dok je u Gram-pozitivnih bakterija bogatih GC (npr. Actinobacteria) to ovaj sistem također regulira preko DtxR (suzbijač toksina za difteriju), kao proizvodnju opasnog difterijskog toksina u Corynebacterium diphtheriae.[8]
Nakon toga, slijedi izlučivanje siderofora u vanćelijsko okruženje, gdje djeluje tako da odvaja i otapa gvožđe .[3][18][19][20] Siderofore tada prepoznaju ćelijski specifični receptori na spoljnoj membrani ćelije.[2][3][21] Kod gljiva i drugih eukariota, kompleks Fe-siderofora može se vanćelijski reducirati na Fe2+, dok se u mnogim slučajevima cijeli kompleks Fe-siderofora aktivno transportuje kroz ćelijsku membranu. U Gram-negativnim bakterijama oni se prenose u periplazmu putem TonB-zavisnih receptora, a u citoplazmu prenose ih ABC transporteri.[3][8][16][22]
U citoplazmi ćelije, kompleks Fe3+-siderofora obično se reducira na Fe 2+ da oslobodi gvožđe, posebno u slučaju "slabijeg" siderofornog liganda poput hidroksamata i karboksilata. Razgradnja siderofora ili drugi biološki mehanizmi mogu također osloboditi gvožđe.,[16] posebno u slučaju kateholata kao što je feri-enterobaktin, čiji je potencijal redukcije prenizak za redukcijska sredstva, kao što je flavin-adenin dinukleotid, pa je potrebna enzimska razgradnja da bi se gvožđe oslobodilo.[11]
Medicinska primjena
urediSiderofori imaju primjenu u medicini za terapiju preopterećenja gvožđem i aluminijem i kao kao antibiotici za poboljšano ciljanje.[3][10][23] Razumijevanje mehaničkih puteva siderofora dovelo je do mogućnosti za dizajniranje inhibitora malih molekula koji blokiraju biosintezu siderofora, a time i rast bakterija i virulenciju u okruženjima sa ograničenim gvožđem.[24][25]
Siderofori su korisni kao lijekovi u olakšavanju mobilizacije gvožđa kod ljudi, posebno u liječenju bolesti nedostatka gvožđa, zbog visokog afiniteta za gvožđe. Jedna potencijalno moćna aplikacija je upotreba sposobnosti transporta siderofora za prenošenje gvožđa za unošenje lijekova u ćelije pripremom konjugata između siderofora i antimikrobnih sredstava. Budući da mikrobi prepoznaju i koriste samo određene siderofore, očekuje se da takvi konjugati imaju selektivnu antimikrobnu aktivnost. Primjer je cefalosporinski antibiotik cefiderokol.[26]
Transport lijeka posredovana mikrobnom dostavom gvožđa koristi prepoznavanje siderofora kao sredstava za isporuku, kako bi mikrobi asimilirali konjugate siderofora s vezanim lijekovima. Ovi lijekovi su smrtonosni za mikrobe i uzrokuju apoptoze mikroba, kada asimilira konjugat siderofora. Dodavanjem funkcionalnih grupa siderofora koji vežu gvožđe za antibiotike, potencija je znatno povećana. To je zbog sistema usvajanja bakterija posredovanog sideroforima
Također pogledakte
urediReference
uredi- ^ Hossain MB, Eng-Wilmot DL, Loghry RA, an der Helm D (1980). "Circular Dichroism, Crystal Structure, and Absolute Configuration of the Siderophore Ferric N,N',N"-Triacetylfusarinine, FeC39H57N6O15". Journal of the American Chemical Society. 102 (18): 5766–5773. doi:10.1021/ja00538a012.
- ^ a b c Neilands JB (novembar 1995). "Siderophores: structure and function of microbial iron transport compounds". The Journal of Biological Chemistry. 270 (45): 26723–6. doi:10.1074/jbc.270.45.26723. PMID 7592901.
- ^ a b c d e f g h i j Hider RC, Kong X (maj 2010). "Chemistry and biology of siderophores". Natural Product Reports. 27 (5): 637–57. doi:10.1039/b906679a. PMID 20376388.
- ^ a b Crosa JH, Mey AR, Payne SM, ured. (2004). Iron Transport in Bacteria. ASM Press. ISBN 978-1-55581-292-8.
- ^ Cornelis P, Andrews SC, ured. (2010). Iron Uptake and Homeostasis in Microorganisms. Caister Academic Press. ISBN 978-1-904455-65-3.
- ^ Johnstone TC, Nolan EM (april 2015). "Beyond iron: non-classical biological functions of bacterial siderophores". Dalton Transactions. 44 (14): 6320–39. doi:10.1039/C4DT03559C. PMC 4375017. PMID 25764171.
- ^ Kraemer SM (2005). "Iron oxide dissolution and solubility in the presence of siderophores" (PDF). Aquatic Sciences. 66: 3–18. doi:10.1007/s00027-003-0690-5. hdl:20.500.11850/51424.
- ^ a b c d Miethke M, Marahiel MA (septembar 2007). "Siderophore-based iron acquisition and pathogen control". Microbiology and Molecular Biology Reviews. 71 (3): 413–51. doi:10.1128/MMBR.00012-07. PMC 2168645. PMID 17804665.
- ^ Challis GL (april 2005). "A widely distributed bacterial pathway for siderophore biosynthesis independent of nonribosomal peptide synthetases". ChemBioChem. 6 (4): 601–11. doi:10.1002/cbic.200400283. PMID 15719346.
- ^ a b c Miller, Marvin J.; Malouin, Francois (1993). "Microbial iron chelators as drug delivery agents: the rational design and synthesis of siderophore-drug conjugates". Accounts of Chemical Research. 26 (5): 241–249. doi:10.1021/ar00029a003.
- ^ a b c Raymond KN, Dertz EA, Kim SS (april 2003). "Enterobactin: an archetype for microbial iron transport". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3584–8. Bibcode:2003PNAS..100.3584R. doi:10.1073/pnas.0630018100. PMC 152965. PMID 12655062.
- ^ Abergel RJ, Wilson MK, Arceneaux JE, Hoette TM, Strong RK, Byers BR, Raymond KN (decembar 2006). "Anthrax pathogen evades the mammalian immune system through stealth siderophore production". Proceedings of the National Academy of Sciences of the United States of America. 103 (49): 18499–503. Bibcode:2006PNAS..10318499A. doi:10.1073/pnas.0607055103. PMC 1693691. PMID 17132740.
- ^ Cendrowski S, MacArthur W, Hanna P (januar 2004). "Bacillus anthracis requires siderophore biosynthesis for growth in macrophages and mouse virulence" (PDF). Molecular Microbiology. 51 (2): 407–17. doi:10.1046/j.1365-2958.2003.03861.x. hdl:2027.42/72033. PMID 14756782.
- ^ Zhou T, Ma Y, Kong X, Hider RC (juni 2012). "Design of iron chelators with therapeutic application". Dalton Transactions. 41 (21): 6371–89. doi:10.1039/c2dt12159j. PMID 22391807.
- ^ Krewulak KD, Vogel HJ (septembar 2008). "Structural biology of bacterial iron uptake". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1778 (9): 1781–804. doi:10.1016/j.bbamem.2007.07.026. PMID 17916327.
- ^ a b c Roosenberg JM, Lin YM, Lu Y, Miller MJ (februar 2000). "Studies and syntheses of siderophores, microbial iron chelators, and analogs as potential drug delivery agents". Current Medicinal Chemistry. 7 (2): 159–97. doi:10.2174/0929867003375353. PMID 10637361.
- ^ Winkelmann G, Drechsel H (1999). "Chapter 5: Microbial Siderophores". Biotechnology (2nd izd.).
- ^ Kraemer, Stephan M.; Crowley, David; Kretzschmar, Ruben (2006). Siderophores in Plant Iron Acquisition: Geochemical Aspects. Advances in Agronomy. 91. str. 1–46. doi:10.1016/S0065-2113(06)91001-3. ISBN 978-0-12-000809-4.
- ^ Kraemer, Stephan M.; Butler, Allison; Borer, Paul; Cervini-Silva, Javiera (2005). "Siderophores and the dissolution of iron bearing minerals in marine systems". Reviews in Mineralogy and Geochemistry. 59 (1): 53–76. Bibcode:2005RvMG...59...53K. doi:10.2138/rmg.2005.59.4.
- ^ Huyer, Marianne; Page, William J. (1988). "Zn2+ Increases Siderophore Production in Azotobacter vinelandii". Applied and Environmental Microbiology. 54 (11): 2625–2631. doi:10.1128/AEM.54.11.2625-2631.1988. PMID 16347766.
- ^ del Olmo A, Caramelo C, SanJose C (decembar 2003). "Fluorescent complex of pyoverdin with aluminum". Journal of Inorganic Biochemistry. 97 (4): 384–7. doi:10.1016/S0162-0134(03)00316-7. PMID 14568244.
- ^ Cobessi D, Meksem A, Brillet K (februar 2010). "Structure of the heme/hemoglobin outer membrane receptor ShuA from Shigella dysenteriae: heme binding by an induced fit mechanism". Proteins. 78 (2): 286–94. doi:10.1002/prot.22539. PMID 19731368.
- ^ Gumienna-Kontecka, Elzbieta; Carver, Peggy L. (2019). "Chapter 7. Building a Trojan Horse: Siderophore-Drug Conjugates for the Treatment of Infectious Diseases". u Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (ured.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Metal Ions in Life Sciences. 19. Berlin: de Gruyter GmbH. str. 181–202. doi:10.1515/9783110527872-013. ISBN 978-3-11-052691-2. PMID 30855108.
- ^ Ferreras JA, Ryu JS, Di Lello F, Tan DS, Quadri LE (juni 2005). "Small-molecule inhibition of siderophore biosynthesis in Mycobacterium tuberculosis and Yersinia pestis". Nature Chemical Biology. 1 (1): 29–32. doi:10.1038/nchembio706. PMID 16407990.
- ^ Simpson, Daniel H.; Scott, Peter (2017). "Antimicrobial Metallodrugs". u Lo, Kenneth (ured.). Inorganic and Organometallic Transition Metal Complexes with Biological Molecules and Living Cells. Elsevier. ISBN 9780128038871.
- ^ Ito A, Nishikawa T, Matsumoto S, et al. (decembar 2016). "Siderophore Cephalosporin Cefiderocol Utilizes Ferric Iron Transporter Systems for Antibacterial Activity against Pseudomonas aeruginosa". Antimicrobial Agents and Chemotherapy. 60 (12): 7396–7401. doi:10.1128/AAC.01405-16. PMC 5119021. PMID 27736756.
Dopunska literatura
uredi- Neilands JB (1952). "A Crystalline Organo-iron Pigment from a Rust Fungus (Ustilago sphaerogena)". J. Am. Chem. Soc. 74 (19): 4846–4847. doi:10.1021/ja01139a033.