Hidratacija
Hidratacija – u hemiji – je reakcija u kojoj se ioni, molekule ili koloidne čestice vežu sa molekulama vode.[1][2][3][4][5][6]
- U anorganskim reakcijama, na taj način nastaju hidrati, spojevi s kristalnom vodom (CuSO4 • 5H2O, naprimjer). Soli se također otapaju u vodi, čije se molekule vežu uz ione koji tvore soli, oslobađajući ih iz kristalne rešetke. Ion vodika u vodenoj otopini redovno je hidratacijski dopunjen jednom molekulom vode (hidronijev ion, H3O+).
- U organskim hemijskim reakcijama, hidratacija uključuje vezanje molekula vode na molekule nezasićenih spojeva, kada, naprimjer od etilena (H2C=CH2) nastaje etanol (H3C–CH2OH).
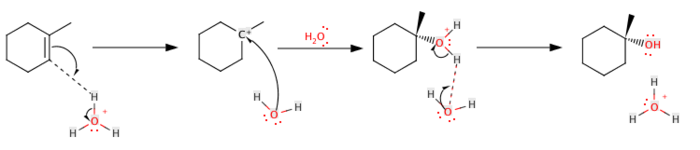
U ovoj reakciji se, dakle, hidroksilna grupa (OH-) i vodik vežu za dva atoma ugljika, koji su međusobno kovalentno povezani dvostrukom vezom:
- RRC=CH2 + H2O/kiselina → RRCH-CH2-OH.
Hidratacija je niz hemijskih i fizičkih procesa, u kojima se voda ponaša kao jedini spoj sa drugom supstancijom bez ostatka. Procesi hidratacije su posebni oblik procesa solvatacije.
U procesu hidratacije, voda može da bude u tečnom ili gasovitom stanju. Razne forme procesa hidratacije se zasnivaju na različitom vezanju molekula vode sa molekulama drugih supstanci ili njihovim ionima. Voda u produktima ovog procesa može i dalje ostati u molekulskom obliku ili je njen dio u novonastalom hemijskom spoju smjesa vodika i kisika u istom srazmjeru kao i u molekuli vode, tj. u odnosu 2:1. Mogući oblici hidratacije uključuju:
- hemijsku reakciju sinteze, podjednako u neorganskoj i organskoj), npr. u reakciji vode sa kisikom koja daje hidroksid;
- nastanak koordinatne veze u kristalnoj rešetki nekih jedinjenja, nakon čega, od bezvodne soli, nastaje "uvodnjena" so.
- jedinjenja u vodenom rastvoru sa nekim kationima, kada nastaju kompleksni kationi.
Organska hemija
urediEpoksidi glikola
urediPutem hidratacije etilen oksida, godišnje se proizvede nekoliko milijardi kilograma etilen glikola:
- C2H4O + H2O → HO-CH2CH2-OH .
Tom prilikom se obično koriste kiselinski katalizatori.
Alkeni
urediZa hidrataciju alkena, opća hemijska jednačina reakcije je slijedeća:
- RRC=CH2 u H2O/kiselina → RRC(-OH)-CH3
Hidroksilna grupa (OH–) pridaje jedan ugljik dvostruke veze, a proton (H+) se dodaje na drugu ugljik dvostruke veze. Reakcija je vrlo egzotermna. U prvom koraku, alken djeluje kao nukleofil i napada proton, prema Markovnikovljevom pravilu. U drugom koraku H2O molekule vežu visoko izmjenjeni ugljik. Atom kisika sada ima tri veze i nosi pozitivan naboj (tj. molekula je oksonij). Zajedno dolazi još jedna molekula vode i zauzima dodatni proton. Ova reakcija ima tendenciju da daje mnogo neželjenih proizvoda, kao naprimjer dietil eter u procesu stvaranja etanola, pa se ne smatra vrlo korisnom za proizvodnju alkohola.[7][8][9]
Uzimaju se dva pristupa. Tradicijski, alken se tretira sa sumpornom kiselinom dajući alkil sulfat estre. U slučaju proizvodnje etanola, ovaj korak se može opisati obrascem:
- H2SO4+C2H4→C2H5-O-SO3H.
Nakon toga ovaj sulfat ester se hidrolizira za regeneraciju sumporne kiseline i oslobađe etanol:
- C2H5-O-SO3H + H2O → H2SO4 + C2H5OH.
Ova dva koraka rute se zove "indirektni proces".
U "direktnom proces", kiselina protonizira alken, a voda reagira s ovom početni karbokationom. ajući alkohol. Direktni proces je više popularan jer je jednostavniji. Kiselinski katalizatori uključuju fosfornu kiselinu i nekoliko solidnih kiselina .
Postoje mnogi alternativni pravci za proizvodnju alkohola, uključujući i hidroboracija-oksidacija reakciju, u oksimerkuracijskoj redukciji, fermentaciji i redukciji ketona i aldehida.
Hidratacija ostalih podloga
urediNezasićeni organski spojevi su podložni hidrataciju. Acetilen hidrati daju acetaldehid: Proces se obično oslanja na živine katalizatore i više se ne koristi na Zapadu, ali se još uvijek prakticira u Kini. Hg2+ centar se veže za C≡C trostruku vezu, koja se zatim veže vodu. Reakcija je:
- H2O + C2H2 → CH3CHO.
Nitrili prolaze hidrataciju dajući amide:
- H2O + RCN → RC(O)NH2
Ova reakcija se primjenjuje u proizvodnji akrilamida. Aldehidi i donekle čak i ketoni, hidrat acijom daju geminalne diole. Reakcija je posebno dominantna za formaldehid, koji , u prisustvu vode, postaje značajan kao dihidroksimetan.
Konceptualno slične reakcije uključuju hidroaminaciju i hidroalkoksilaciju, koje uključuju dodavanje amina i alkohola do alkena.
Hemija neorganskih materijala
urediHidratacija je važan proces u mnogim drugim aplikacijama; jedan primjer je proizvodnja Portland cementa do umrežavanja kalcij oksida i silikata koji je izazvan vodom. Hidratacija je proces kojim funkcioniraju sredstva za sušenje.
Također pogledajte
urediReference
uredi- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
- ^ Alberts B. (2002)ː Molecular biology of the cell. Garland Science, New York, ISBN 0-8153-3218-1.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Warrell D. A., Cox T. M., Firth J. D. (2010): The Oxford Textbook of Medicine Arhivirano 21. 3. 2012. na Wayback Machine (5th ed.). Oxford University Press
- ^ Atkins P., de Paula J. (2006): Physical chemistry, 8th Ed. W. H. Freeman, San Francisco, ISBN 0-7167-8759-8
- ^ Binder H. H. (1999): Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart, ISBN 3-7776-0736-3.
- ^ Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.