Ponavljanje bogato leucinom
Leucin-bogato ponavljanje (LRR) je proteinski strukturni motiv koji formira α/β potkovičasti nabor.[1][2] Sastoji se od ponavljajućih 20-30 aminokiselinskih dionica koje su neobično bogate hidrofobnom aminokiselinom leucin. Ova tandemska ponavljanja se obično savijaju zajedno, kako bi formirali domen solenoidnog proteina, koji se naziva domen ponavljanja bogatog leucinom. Tipski, svaka ponavljajuća jedinica ima beta sekvencu-okret-alfa heliksnu strukturu, i sastavljeni domen, građen od mnogih takvih ponavljanja; ima oblik potkovice s unutrašnjim paralelnim beta-listom i vanjskim nizom heliksa. Jedna strana beta lista i jedna strana heliksnog niza izložene su rastvaraču i stoga dominiraju hidrofilni ostaci. Područje između spirala i listova je hidrofobno jezgro proteina i čvrsto je sternonabijeno ostacima leucina.
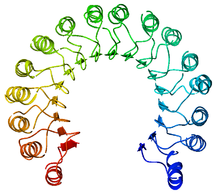 Primjer proteina sa leucin-bogatim ponavljanjem, svinjski inhibitor ribonukleaze | |||||||||
| Identifikatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Simbol | LRR_1 | ||||||||
| Pfam | PF00560 | ||||||||
| Pfam klan | CL0022 | ||||||||
| InterPro | IPR001611 | ||||||||
| SCOP2 | 2bnh / SCOPe / SUPFAM | ||||||||
| Membranom | 605 | ||||||||
| |||||||||
| Varijanta leucin bogatog ponavljanja | |
|---|---|
 Varijanta leucin-bogatog ponavljanja s novim repetitivnim peroteinskim strukturnim motivom | |
| Identifikatori | |
| Simbol | LRV |
| Susjedni LRR | |
|---|---|
 Internalin H: kristalna struktura spojenih N-terminalnih domena. | |
| Identifikatori | |
| Simbol | LRR-adjacent |
| N-terminakni domen leucinski bogatog ponavljanja | |
|---|---|
 Dimerni dekorin ekstrahovan iz goveđeg tkiva, kristalni oblik 2 | |
| Identifikatori | |
| Simbol | LRRNT |
| N-terminakni domen leucinski bogatog ponavljanja | |
|---|---|
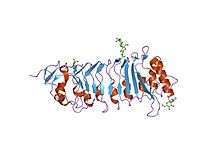 Kristalna struktura PGIP-a (protein inhibicije poligalakturonaze), proteina bogatog leucinom koji je uključen u odbranu biljaka | |
| Identifikatori | |
| Simbol | LRRNT-2 |
| N-terminakni domen leucinski bogatog ponavljanja | |
|---|---|
 treći lrr domen proreza kod Drosophila | |
| Identifikatori | |
| Simbol | LRRCT |
| LRV protein klastera FeS4 | |
|---|---|
 Varijanta leucinom bogatog ponavljanja sa novim repetitivnim strukturnim motivom proteina | |
| Identifikatori | |
| Simbol | LRV-FeS |
Ponavljanja bogata leucinom često su uključena u formiranje interakcija protein-protein.[3][4]
Primjeri
urediMotivi ponavljanja bogati leucinom identificirani su u velikom broju funkcionalno nepovezanih proteina.[5] Najpoznatiji primjer je inhibitor ribonukleaze, ali drugi proteini kao što su tropomiozinski regulator tropomodulin i toll-liki receptor također dijele motiv. Zapravo, toll-liki receptor posjeduje 10 uzastopnih LRR motiva koji služe za vezivanje molekulskih obrazaca povezanih s patogenima i opasnostima.
Iako kanonski LRR protein sadrži otprilike jednu spiralu za svaki beta-lanac, varijante koje formiraju beta-alfa superheliksne nabore ponekad imaju duge petlje, a ne spirale koje povezuju uzastopne beta niti.
Jedna varijantna forma domena bogata leucinom (LRV) ima novi repetitivni strukturni motiv koji se sastoji od naizmjeničnih alfa- i 310-heliksa raspoređenih u desnostranom superheliksu, sa odsustvom beta-listova prisutnih u drugim ponavljanjima bogatim leucinom.[6]
Asocirani domeni
urediPonavljanja bogata leucinom su često praćena sa N-terminalnim i C-terminalnom cistein-bogatim domenima, ali ne uvijek kao što je slučaj sa C5orf36
Oni se takođe pojavljuju zajedno sa LRR-ovim susjednim domenima. Ovo su mali, svi betalančani domeni, koji su strukturno opisani za protein internalin (InlA) i srodne proteine InlB, InlE, InlH iz patogenih bakterija Listeria monocytogenes. Čini se da je njihova funkcija uglavnom strukturna: spojeni su na terminalni dio ponavljanja bogatih leucinom, značajno stabilizirajući LRR i formirajući zajednički kruti entitet sa LRR. Oni sami nisu uključeni u protein-protein-interakcije, ali pomažu da se predstavi susjedni LRR-domen u tu svrhu. Ovi domeni pripadaju porodici Ig-sličnim domenima po tome što se sastoje od dva usendvičena beta-lista koji prate klasičnu povezanost Ig-domena. Beta lanci u jednom od listova su, međutim, mnogo manji nego u većini standardnih Ig-sličnih domena, što ga čini pomalo izvanrednim.[7][8][9]
Klaster gvožđa sumpora nalazi se na N-kraju nekih proteina koji sadrže leucinom bogatu varijantni domen (LRV). Ovi proteini imaju dvodomensku strukturu, sastavljenu od male N-terminalnog domena koji sadrži klaster od četiri cisteinska ostatka u kojem se nalazi 4Fe:4S klaster, i domen većeg C-terminala koji sadrži LRV ponavljanja.[6] Biohemijske studije otkrile su da je 4Fe:4S klaster osjetljiv na kisik, ali izgleda da nema reverzibilne redoks aktivnosti.
Također pogledajte
urediReference
uredi- ^ Kobe B, Deisenhofer J (oktobar 1994). "The leucine-rich repeat: a versatile binding motif". Trends Biochem. Sci. 19 (10): 415–21. doi:10.1016/0968-0004(94)90090-6. PMID 7817399.
- ^ Enkhbayar P, Kamiya M, Osaki M, Matsumoto T, Matsushima N (februar 2004). "Structural principles of leucine-rich repeat (LRR) proteins". Proteins. 54 (3): 394–403. doi:10.1002/prot.10605. PMID 14747988. S2CID 19951452.
- ^ Kobe B, Kajava AV (decembar 2001). "The leucine-rich repeat as a protein recognition motif". Curr. Opin. Struct. Biol. 11 (6): 725–32. doi:10.1016/S0959-440X(01)00266-4. PMID 11751054.
- ^ Gay NJ, Packman LC, Weldon MA, Barna JC (oktobar 1991). "A leucine-rich repeat peptide derived from the Drosophila Toll receptor forms extended filaments with a beta-sheet structure". FEBS Lett. 291 (1): 87–91. doi:10.1016/0014-5793(91)81110-T. PMID 1657640. S2CID 84294221.
- ^ Rothberg JM, Jacobs JR, Goodman CS, Artavanis-Tsakonas S (decembar 1990). "slit: an extracellular protein necessary for development of midline glia and commissural axon pathways contains both EGF and LRR domains". Genes Dev. 4 (12A): 2169–87. doi:10.1101/gad.4.12a.2169. PMID 2176636.
- ^ a b Peters JW, Stowell MH, Rees DC (decembar 1996). "A leucine-rich repeat variant with a novel repetitive protein structural motif". Nat. Struct. Biol. 3 (12): 991–4. doi:10.1038/nsb1296-991. PMID 8946850. S2CID 36535731.
- ^ Schubert WD, Gobel G, Diepholz M, Darji A, Kloer D, Hain T, Chakraborty T, Wehland J, Domann E, Heinz DW (septembar 2001). "Internalins from the human pathogen Listeria monocytogenes combine three distinct folds into a contiguous internalin domain". J. Mol. Biol. 312 (4): 783–94. doi:10.1006/jmbi.2001.4989. PMID 11575932.
- ^ Schubert WD, Urbanke C, Ziehm T, Beier V, Machner MP, Domann E, Wehland J, Chakraborty T, Heinz DW (decembar 2002). "Structure of internalin, a major invasion protein of Listeria monocytogenes, in complex with its human receptor E-cadherin". Cell. 111 (6): 825–36. doi:10.1016/S0092-8674(02)01136-4. PMID 12526809. S2CID 17232767.
- ^ Freiberg A, Machner MP, Pfeil W, Schubert WD, Heinz DW, Seckler R (mart 2004). "Folding and stability of the leucine-rich repeat domain of internalin B from Listeri monocytogenes". J. Mol. Biol. 337 (2): 453–61. doi:10.1016/j.jmb.2004.01.044. PMID 15003459.
Dopunska literatura
uredi- Tooze, John; Brändén, Carl-Ivar (1999). Introduction to Protein Structure (2nd izd.). New York: Garland Publishing. ISBN 0-8153-2305-0.
- Wei T, Gong J, Jamitzky F, Heckl WM, Stark RW, Roessle SC (novembar 2008). "LRRML: a conformational database and an XML description of leucine-rich repeats (LRRs)". BMC Struct. Biol. 8 (1): 47. doi:10.1186/1472-6807-8-47. PMC 2645405. PMID 18986514.
Vanjski linkovi
urediEukaryotic Linear Motif resource motif class LIG_SCF_Skp2-Cks1_1
- SCOP LRR fold
- CATH Alpha-beta horseshoe architecture
- LRRML: a conformational database of leucine-rich repeats
Šablon:Proteinski domeni Šablon:Tercijarna struktura proteina